三种工艺提取丹参有效成分及丹酚酸B分离纯化研究
2019-03-21邹蔓姝韩远山王宇红
邹蔓姝,韩远山,王宇红
(1.湖南中医药大学 药学院,湖南 长沙 410208;2.湖南中医药大学第一附属医院,湖南 长沙 410007;3.湖南省中药粉体与创新药物省部共建国家重点实验室培育基地,湖南 长沙 410208)
丹参(Salviamiltiorrhiza)为唇形科鼠尾草属植物丹参干燥的根及根茎,始载于《神农本草经》,列为上品[1]。丹参具有祛瘀止痛、活血通经、清心除烦等功效,为活血化瘀的著名中药[2]。现代药理学研究表明,丹参中作用于心血管的主要有效成分为水溶性酚性物质[3-4],其中尤以丹酚酸B含量最高,活性最强。传统丹酚酸的提取方法为水回流提取,得到的水溶性杂质多,且纯化工艺步骤繁琐,操作复杂,成本高[5]。大孔树脂是近年来发展起来的一种以吸附和分子筛原理相结合的分离材料,具有稳定性高、选择性好、再生处理方便、吸附速率快、不受无机盐类、强离子和低分子化合物影响的优势[6-8]。利用大孔树脂吸附分离技术对丹参提取液进行分离纯化,以丹酚酸B含量为指标,通过静态和动态吸附-解吸附变化,考察最佳分离纯化条件,并优化其工艺,现报道如下。
1 仪器与材料
1.1 仪器
AY120 Shimadzu电子分析天平(Shimadzu Corporation Japan);98-1C型数字控温电热套(天津市斯特仪器有限公司);SHZ-Ⅲ型循环水真空泵(上海亚荣生化仪器厂);旋转蒸发仪(上海亚荣生化仪器厂,RE-52A );TL9900数据处理软件;SK2200HP超声波清洗器(上海科导超声仪器有限公司,功率250 W,频率30 kHz);PHS-25酸度计(上海雷磁仪器厂);TU-1901型双光束紫外分光光度计(北京普析通用仪器责任有限公司);Agilent1100高效液相色谱仪(美国HP公司);Hypersil BDS C18色谱柱(Thermo)(4.6 mm×200 mm,5 μm);HA121-50-01型超临界萃取装置(江苏南通华安超临界萃取有限公司);SA-6000自动血流变测试仪(北京赛科希德科技发展有限公司)。
1.2 试剂
丹参酮IIA(批号:110766-201520,中国食品药品检定研究院,纯度≥98%);丹酚酸B(批号:111562-201615,中国食品药品检定研究院,纯度≥99%);丹参药材(由湖南中医药大学第一附属医院提供);色谱甲醇(SPECTAUM);色谱乙腈(SPECTAUM);冰醋酸(湖南汇虹试剂有限公司);大孔吸附树脂:D101(天津农药股份有限公司);HPD100,HPD600(沧州宝恩化工厂);AB-8,NK-II,SIPI905(南开大学化工厂)。
1.3 动物
SPF级雄性SD大鼠48只,体重180~220 g,购自湖南斯莱克景达实验动物有限公司(动物许可证号 SCXK(湘)2013-0004)。
2 方法与结果
2.1 样品制备
2.1.1 乙醇超声提取 参照《动植物药有效成分提取分离和药理活性筛选汇编》方法[9],取丹参药材100 g,加10倍量乙醇浸泡12 h,再加5倍乙醇超声提取2次,每次1h,合并提取液,减压浓缩至干,加水溶解后,采用大孔树脂吸附纯化,以50%乙醇洗脱,得洗脱液,减压浓缩至干,编号为①。
2.1.2 不同浓度乙醇提取 参照《中国药典》2015年版一部复方丹参片中丹参提取方法,取丹参药材100 g加8倍量乙醇回流提取1.5 h,过滤,滤液回收乙醇,减压浓缩至干,备用;药渣加6倍量50%乙醇回流提取1.5 h,过滤,滤液回收乙醇,减压浓缩至干,备用;药渣加6倍量水提取2 h,过滤,滤液减压浓缩至干,备用;合并上述浸膏,编号为②。
2.1.3 SFE-CO2萃取 取丹参药材100 g,采用SFE-CO2萃取,以萃取压力22 MPa、温度40 ℃、解析压力22 MPa、温度40 ℃、夹带剂为30%药材量的乙醇的条件对丹参脂溶性成分进行萃取,得萃取物备用;药渣同“2.1.1”项下处理,所得浸膏与萃取物合并,编号为③。
2.2 三种工艺样品的化学成分比较
以丹参酮IIA和丹酚酸B的提取量为考查指标,对3种工艺制备的样品进行化学成分比较研究。参照中国药典2015年版一部丹参项下丹酚酸B、丹参酮IIA含量测定方法进行检测。
2.2.1 色谱条件 丹酚酸B:用十八烷基硅烷键合硅胶为填充剂;乙腈-0.02%磷酸水为流动相,进行梯度洗脱;柱温为20 ℃;检测波长为270 nm。丹参酮IIA:用十八烷基硅烷键合硅胶为填充剂;乙腈-0.1%磷酸水(22∶78);柱温为20 ℃;流速为1.2 mL/min;检测波长为286 nm。两者理论塔板数均不低于6 000。
2.2.2 对照品溶液制备 精密称取丹酚酸B对照品10 mg,置于100 mL容量瓶中,加甲醇-水(8∶2)至刻度,摇匀,即得(丹酚酸B浓度0.1 mg/mL)。精密称取丹参酮IIA对照品10 mg,置于50 mL棕色容量瓶中,加甲醇至刻度,摇匀;精密量取2.5 mL,置于25 mL棕色量瓶中,加甲醇至刻度,摇匀,即得(丹参酮IIA浓度20 μg/mL)。
2.2.3 供试品溶液制备 取上述3种样品浸膏,精密称定,置于具塞锥形瓶中,精密加入甲醇50 mL,密塞,称定重量,加热回流1 h,取出,放冷,再称定重量,用甲醇溶液补足减失的重量,摇匀,用0.22 μm微孔滤膜过滤,取续滤液,即得。
2.2.4 测定法 分别精密吸取两种对照品溶液与三种供试品溶液各10 μL,依次注入液相色谱仪,测定,即得。结果表明,采用SFE-CO2萃取后药渣再醇提的方法优于其他两种提取方法。见表1。

表1 不同提取方法对提取率的影响
注:指100g丹参药材中丹酚酸B、丹参酮IIA的提取量;丹参药材中丹酚酸B的含量不少于3.0%、丹参酮IIA的含量不少于0.25%。
2.3丹参不同提取液对大鼠血液流变学参数的影响
2.3.1 动物造模方法及分组 先给予大鼠皮下注射大剂量肾上腺素模拟暴怒时机体状态,再以冰水浸泡模拟寒邪侵袭,二者综合作用可迅速复制出血液流变性呈黏、浓、凝、聚的模型[10-12]。因血瘀模型形成较迅速,故采用预防性实验治疗[13],即先给药7 d,待活血化瘀作用出现时,再开始造模。取雄性SD大鼠48只,按体重随机分为空白对照组,血瘀模型组,阳性药物组(复方丹参片),丹参①、②、③组。给药组每日灌胃给药1次,连续给药7 d,空白对照组和血瘀模型组大鼠给予等体积生理盐水。第7 天给药1 h后,除空白对照组外,其他各组大鼠均皮下注射盐酸肾上腺素注射液0.08 mL/100 g,共2次,每次间隔4 h,在两次注射之间,将大鼠放入0℃冰水中,浸泡5 min后取出。空白对照组大鼠皮下注射等体积的生理盐水,且不放入冰水中。
2.3.2 测定指标 所有大鼠禁食12 h,次晨股动脉采血,3% EDTA抗凝,测定纤维蛋白原,另用肝素抗凝,采用血流变测试仪测定血液流变学指标。
2.3.3 结果 模型组大鼠全血黏度、血浆黏度、红细胞压积指数高于正常对照组。与模型组相比,药物组大鼠全血黏度、血浆黏度、红细胞压积指数、纤维蛋白原,红细胞聚集指数等明显降低。组间比较可得,丹参①和丹参③具有较好的改善血液流变学的作用,两者之间无显著性差异(P<0.05),但效果皆明显优于丹参②。考虑工艺的简化和稳定以及节约成本因素,宜选择乙醇超声提取。见表2、表3。
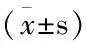
表2 丹参不同提取液对大鼠血液流变学参数的影响
注:与空白对照组比较,++P<0.01,+P<0.05;血瘀模型组比较,**P<0.01,*P<0.05。

表3 丹参不同提取液对大鼠血液流变学参数的影响
注:与血瘀模型组比较,**P<0.01,*P<0.05。
2.4 样品制备与大孔吸附树脂前处理
2.4.1 供试品溶液制备 取“2.1.1”项下干浸膏粉末,加水溶解成浓度为0.3 g生药/mL(含丹酚酸B为9.9 mg/mL)的供试品溶液备用。
2.4.2 对照品溶液的制备 取丹酚酸B对照品,加蒸馏水制成0.12 mg/mL浓度的溶液,备用。
2.4.3 大孔树脂前处理 称取适量各型号大孔树脂,无水乙醇浸泡24 h后装柱,加乙醇静止浸泡4 h后,以2 BV/h流速通过树脂柱至洗脱液加水不出现白色浑浊,蒸馏水洗至无醇味;5%HCl浸泡洗脱4 h,体积流量4 BV/h,蒸馏水洗至流出的洗脱液呈中性,0.2%NaOH浸泡洗脱4 h,体积流量4 BV/h,蒸馏水洗至流出的洗脱液呈中性。
2.5 丹酚酸B含量测定
分别精密吸取对照品溶液0.5、1.0、1.5、2.0、2.5、3.0 mL,分别置于10 mL量瓶中,加蒸馏水至刻度,摇匀,作为不同浓度的对照品溶液。分别于286 nm波长处测定吸光度,以浓度为横坐标,吸光度为纵坐标,绘制标准曲线,回归方程为Y=0.03824X+0.001 7,相关系数r2=0.9995,表明丹酚酸B在10.0~90.0 μg/mL浓度范围内与吸光度值线性关系良好。
2.6 吸附洗脱特性参数
比上柱量S:达吸附终点时,单位质量干树脂吸附夹带成分的和。S=(上柱液中成分质量-过柱流出液中成分质量)/干树脂质量。
比吸附量A:单位质量干树脂吸附成分的总和。A=(上柱液中成分质量-过柱流出液中成分质量-洗脱成分质量)/干树脂质量。
比洗脱量E:吸附饱和后,用一定量溶剂洗脱至终点,单位质量干树脂洗脱成分的质量。E= 洗脱成分质量/干树脂质量。
2.7 影响吸附的因素考察
2.7.1 吸附树脂的筛选 按照“2.4.3”项下的方法对5种树脂进行预处理,取适量(相当于1 g干树脂)处理后的树脂,装入玻璃柱中。将质量浓度为9.9 mg/mL的丹参样品液1 mL,加于各柱顶,先用水以相同的流速洗脱,再用10%、20%、30%乙醇梯度洗脱,分段收集过柱残液与水洗液,供含量测定用。根据计算结果可知,不同树脂对丹酚酸B的吸附与解吸附效果有差别,其中在SIPI905与D101树脂的比上柱量和比洗脱量都较大,说明这两种型号的树脂吸附与解吸附的性能较强,较宜选择使用。见表4。

表4 丹酚酸B的吸附和洗脱量
2.7.2 吸附速率测定 按照“2.4.3”项下的方法对5种树脂进行预处理,取适量(相当于1 g干树脂)处理后的5种树脂,置于具塞锥形瓶中,加样品液2 mL,至恒温震荡器中室温振荡,分别于0、2、4、6、8、18 h取样,测定样品液中丹酚酸B的含量,计算树脂对样品的比吸附量,根据以下公式计算吸附速率。结果表明,SIPI905树脂的吸附速率最快,综合考虑2个因素,以选择SIPl905树脂为佳。见表5。
Kt=-ln(1-Qt/Q)。注:Kt:吸附速率常数;T:吸附时间;Qt:t时间内的吸附量;Q:平衡吸附量。

表5 不同树脂类型对丹酚酸B的吸附速率 K(h-1)
2.7.3 样品浓度对吸附效果影响 按照“2.4.3”项下的方法对SIPI905树脂进行预处理,称取6份处理后的树脂,湿法装柱。将6份丹酚酸B质量浓度为0.5750、0.8625、1.1500、1.4375、1.7254、2.3000 mg·mL-1的样品液2 mL,分别加于各柱顶,用水以相同流速通过大孔树脂,待完全吸附后,测定吸附后样品液中丹酚酸B含量,计算比吸附量。从结果可以看出,随着样品液浓度的增加,比吸附量也相应增加,且比吸附量与样品的浓度之间符合弗兰德里希(Freundlich)吸附等温式和朗缪尔(Langmuir)方程,由此可见二者之间主要以物理吸附为主。见表6。

表6 样品浓度对大孔树脂吸附的影响
注:C0上柱样品丹酚酸B的浓度,X/M比吸附量。对Frendlich公式拟合:lgX/M=1.0265lgC0+0.8562,r=0.9818;对Langmuir公式拟合:1/X/M=0.1289/C0+0.0092,r=0.9723。
2.7.4 盐溶液对吸附效果的影响 按照“2.4.3”项下方法对SIPI905树脂进行预处理,称取5份(相当于1 g干树脂)预处理后的SIPI905型树脂置于具塞锥形瓶中,加入2 mL丹参样品液,再分别往瓶中加入质量分数为0%、4%、8%、12%、16%NaCl溶液1 mL。于25 ℃、120 r/min水浴恒温恒速振荡1h,抽滤得上清液,测量滤液中丹酚酸B含量并计算树脂的比上柱量。从表7数据可以看出,盐溶液的存在会使比上柱量减小,因此样品液中应避免盐类。见表7。

表7 盐溶液浓度对大孔树脂吸附的影响
2.7.5 温度对吸附效果的影响 按照“2.4.3”项下方法对SIPI905树脂进行预处理,称取5份等量(相当于1 g干树脂)预处理后的SIPI905型树脂置于具塞锥形瓶中,并加入2 mL丹参样品液,放置在120 r/min的振荡器中,于20℃、30℃、40℃、50℃、60℃条件下震荡1 h,抽滤得上清液,测定滤液中丹酚酸B含量。结果表明,温度对吸附纯化的效果影响较大,在室温范围内对吸附影响较小,比上柱量随着温度的升高而下降。见表8。

表8 温度对大孔树脂吸附的影响
2.7.6 最大上样量的确定 按照“2.4.3”项下方法对SIPI905树脂进行预处理,称取处理后的SIPI905型树脂适量5份(相当于5g干树脂),分别装入5根层析柱,加样品液5、10、15、20、25 mL,静置30 min,流出液重吸附3次,再用蒸馏水、20%乙醇各100 mL洗脱,收集20%乙醇洗脱液,测定丹酚酸B含量。结果表明,上样量达15 mL后,洗脱液中丹酚酸B含量无显著性增加,即超过树脂的吸附容量,因此15 mL为饱和上样量。见表9。

表9 上柱量对丹酚酸B得量的影响
2.7.7 最佳吸附时间的确定 按照“2.4.3”项下方法对SIPI905树脂进行预处理,称取处理后的SIPI905型树脂适量5份(相当于5 g干树脂),分别装入5根层析柱,取15 mL丹参样品液上样,流出液重吸附3次,5根层析柱分别静置10、15、30、60 min,依次用蒸馏水、20%乙醇各150 mL洗脱,收集20%乙醇洗脱液,测定丹酚酸B含量。结果表明,静置30 min时,洗脱液中丹酚酸B含量最高,时间过短,吸附不完全,时间过长,解吸附难。见表10。
2.8 洗脱工艺参数考察
2.8.1 洗脱溶剂选择 按照“2.4.3”项下方法对SIPI905树脂进行预处理,装柱(柱内径与长度比为1∶10,干重10 g),取15 mL丹参样品液上样,依次用蒸馏水、10%、20%、30%、50%乙醇各200 mL梯度洗脱,流速为1 mL/min,每50 mL收集1份,共20份;分别蒸干,加蒸馏水溶解,过滤,定容至5 mL,编号,测定丹酚酸B含量。以样品编号为横坐标,丹酚酸B含量为纵坐标,绘制洗脱曲线。结果表明,20%~30%的乙醇洗脱液中丹酚酸B含量较高,占总得率的88.2%,且解吸附能力20%乙醇强于30%乙醇,故确定洗脱条件为先用蒸馏水洗去杂质,再用20%乙醇洗脱丹参中丹酚酸B。见图1。

表10 吸附时间对丹酚酸B得量的影响

图1 丹参样品液洗脱曲线
2.8.2 洗脱溶剂用量的选择及洗脱率的测定 按照“2.4.3”项下方法对SIPI905树脂进行预处理,装柱(柱内径与长度比为1∶10,干重10 g),取15 mL丹参样品液上样,静置30 min,先用250 mL蒸馏水洗脱,再用20%乙醇250 mL分次(50 mL/次)洗脱,洗脱液流速为1 mL/min,共收集5份,分别蒸干,用甲醇溶解,过滤,定容至5 mL,分别测定丹酚酸B得量。结果表明,丹酚酸B集中在前150mL内被洗脱,故确定20%乙醇洗脱剂用量为150 mL。见表11。

表11 洗脱溶剂用量对丹酚酸B得量的影响
2.8.3 验证试验 取同一批药材,按照优选的工艺条件进行大孔吸附树脂吸附的验证试验,结果洗脱液中的总固体物得率分别为5.56%、5.49%、5.62%,平均值为5.56%;丹酚酸B得率分别为3.78%、3.57%、3.48%,平均值为3.61%,丹酚酸B得量占固体物量的64.98%,表明大孔树脂的纯化工艺基本合理。工艺条件为1 g丹参提取物,丹参中丹酚酸B的最大上样量(即比吸附量)为9.20 mg/g,洗脱剂为20%乙醇,用量为150 mL。
2.8.4 树脂再生的考察 按照“2.4.3”项下方法对SIPI905树脂进行预处理,取适量(相当于1 g干树脂)处理后的树脂,装入玻璃柱中。取1 mL丹参样品液进行上柱、吸附和洗脱,在同一根树脂上重复操作5次,分别计算5次丹酚酸B的吸附量。结果表明,树脂经连续使用3次后吸附率下降,应考虑对树脂进行再生处理。见表12。
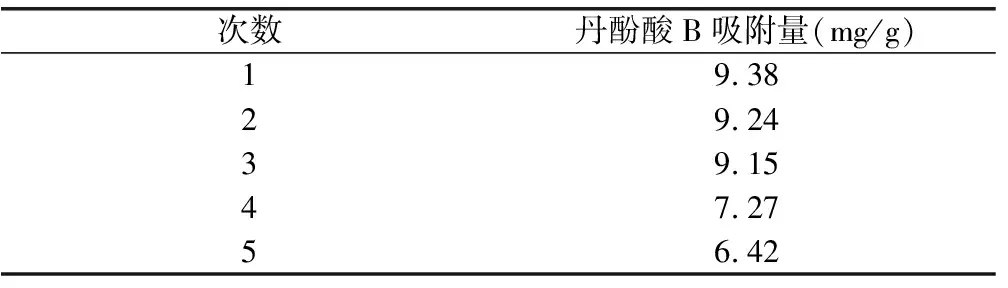
表12 树脂重复利用次数对丹酚酸B吸附量的影响
3 讨论
本实验采用3种提取方法同时提取丹参中两种有效成分丹参酮IIA和丹酚酸B,以两者的提取率,结合抗心肌缺血实验的血液流变参数为评价指标,考察并确定该两种成分的最佳提取工艺。采用超声技术提取丹参有效成分,利用超声波的特性可加速药物有效成分进入溶剂。脂溶性成分丹参酮具有活血化瘀的作用[14],但对热不稳定,在提取、纯化、干燥过程中易降解,若要提高其保留率,需采用超临界萃取工艺。抗心肌缺血主要药效试验结果表明,SFE-CO2萃取样品较乙醇超声提取样品的药效作用稍强,但经统计学处理组间无显著性差异,为降低成本,简化工艺,保证质量稳定,宜采用乙醇超声提取。
在此基础上,本实验从树脂选择、上样流速、样品浓度、温度等方面考察并得到水溶性成分丹酚酸B的最佳纯化工艺参数,通过验证表明其纯化效果较好。SIPI905大孔树脂具有吸附“大、快、高”及再生处理方便等优点,其吸附性与筛分性相结合的特点尤适合于丹参中丹酚酸B的分离、纯化。树脂对有效成分的吸附一般分为四个阶段:①溶液中外扩散;②树脂表面液膜扩散;③树脂内部孔径扩散;④吸附和解吸附。丹酚酸B在大孔树脂上的吸附随着温度的升高,吸附量下降,说明该吸附过程属于放热过程,降低温度有利于吸附。吸附量与药液符合弗兰德里希(Freundlich)吸附模型和朗缪尔(Langmuir)方程,即在达到平衡吸附之前,同一温度下,浓度越大,吸附量也会增大。
大孔树脂吸附分离技术已日益显示其独特的效果,不仅为中药制剂质量控制研究提供了更有效、可靠的纯化富集手段,更重要的是改善了传统中药制剂“粗、大、黑”的外观和服用量过大等缺点。目前,实验室阶段的研究日益增多,有助于后期工业化的大规模应用,今后若大孔吸附树脂技术可以与其他技术相结合,将能为中药的分离纯化、产品开发提供更可靠的保证。
