菊芋悬浮细胞对盐胁迫的生理响应
2019-03-19曹明武庞秋颖
曹明武 罗 蕊 安 慧 庞秋颖
(东北林业大学盐碱地生物资源环境研究中心/东北盐碱植被恢复与重建教育部重点实验室,哈尔滨 150040)
菊芋(Helianthustuberosus)是菊科(Compositae)向日葵属(Helianthus)的草本植物,植株高大、生长迅速,具有耐寒、耐旱、耐贫瘠的生物生态学特性,由于适应性强而在我国各地均有栽培。2004年,菊芋被引入松嫩盐碱草地,在中度盐碱程度的退化草地上能够自然生长,经过选育后某些耐盐碱能力强的品系可以在重度盐碱程度的退化草地上生长并结出块茎[1~2]。近十余年,结合菊芋生态适应性及劣质土地利用,菊芋胁迫生理生态学研究陆续开展,并且这些工作主要在国内展开。有关菊芋耐盐性及盐胁迫下的生理响应、耐盐机理分析的报道较多,主要涉及盐胁迫下菊芋不同生态型、品系的生理响应,如生物量、光合特性、叶片光合放氧速率和PSⅡ反应中心光化学效率、抗氧化酶(SOD、POD、CAT等)活性等[3~8],对耐盐机理的分析则主要涉及到甜菜碱、脯氨酸、可溶性糖等的渗透调节作用,Na+、Cl-、K+的选择性吸收以及可能与维持高Na+/K+相关的H+-ATPase的作用等[9~11]。这些研究工作主要是针对叶片、块茎等菊芋植株而进行,对菊芋悬浮细胞的生理学研究则少有报道。
植物悬浮培养细胞体系具有均一、同质、再现性好等适于精细调控研究的优势。在前期有关萌芽菊芋块茎对盐碱土壤胁迫的生理响应及调控机理研究[2,12~13]的基础上,本文报告菊芋块茎悬浮细胞对盐胁迫的生理响应。
1 材料与方法
1.1 菊芋悬浮细胞培养及盐处理
菊芋块茎经常规消毒处理后,切成边长约0.5 cm的小块,接种于pH6.0、含有BA 1.0 mg·L-1+NAA 1.0 mg·L-1的MS固体培养基上诱导愈伤组织,每3周继代培养1次。转接3次后取愈伤组织转接到pH6.0、含有BA 3.0 mg·L-1+NAA 1.0 mg·L-1的MS液体培养基中,置于120 r·min-1的摇床上黑暗培养,20天后继代1次。继代后第14天,向培养基中添加NaCl溶液,使培养基盐浓度分别为50、100、150、200、250 mmol·L-1,并分别补充相应量的无菌水平衡各处理间的培养基浓度。盐处理后的第1、3、5、7天取样测定悬浮培养细胞鲜重及相对细胞活力(TTC法)[14],同时取样品液氮速冻,备存于-80℃用于悬浮培养细胞干重及生理指标测定。
1.2 生理指标测定
菊芋悬浮细胞中丙二醛含量、脯氨酸含量、可溶性糖含量、可溶性蛋白含量分别采用硫代巴比妥酸法、水合茚三酮法、蒽酮法、考马斯亮蓝G-250染色法测定[14]。按照已建立的方法体系,采用DAB(3,3′-diaminobenzidine)显色法测定过氧化氢含量[15],采用商品化抗氧化酶活性测定试剂盒(中国南京建成生物工程研究所)测定各种抗氧化酶(超氧化物歧化酶、过氧化物酶、过氧化氢酶、抗坏血酸过氧化物酶)活性。
1.3 酚类物质含量测定
取菊芋悬浮细胞速冻样品,冻干后以60%乙醇提取总酚,福林酚法测定总酚含量。采用超效液相色谱-质谱联用法(UPLC-MS)鉴定并测定14种酚类化合物的含量[16]。
1.4 数据处理
使用SPSS Statistics v17.0软件进行分析统计,并利用单因素方差分析(one-way ANOVA)比较不同数据组间的差异。
2 结果与分析
2.1 菊芋悬浮细胞的生物量和生理状态
随着NaCl处理浓度的增加,菊芋悬浮细胞的鲜重和干重均呈现逐渐减少的趋势,表明盐胁迫明显抑制了菊芋悬浮细胞的生长(图1)。当NaCl浓度达到200 mmol·L-1时,菊芋悬浮细胞几乎停止增长,因此后续研究中以200 mmol·L-1NaCl作为最高的盐处理浓度。
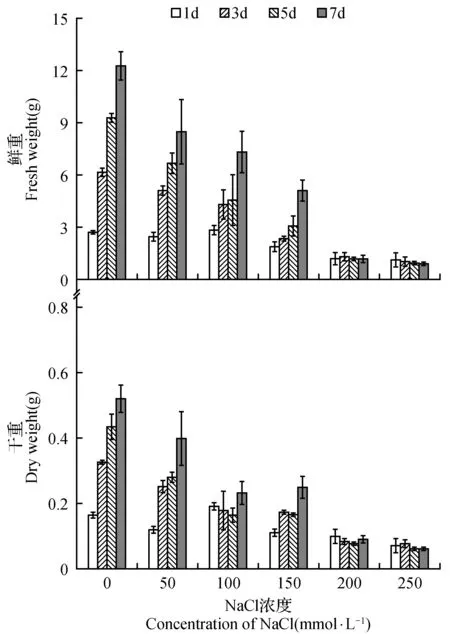
图1 NaCl胁迫对菊芋悬浮细胞生物量的影响Fig.1 Effect of NaCl stress on biomass of suspension cells of H.tuberosus
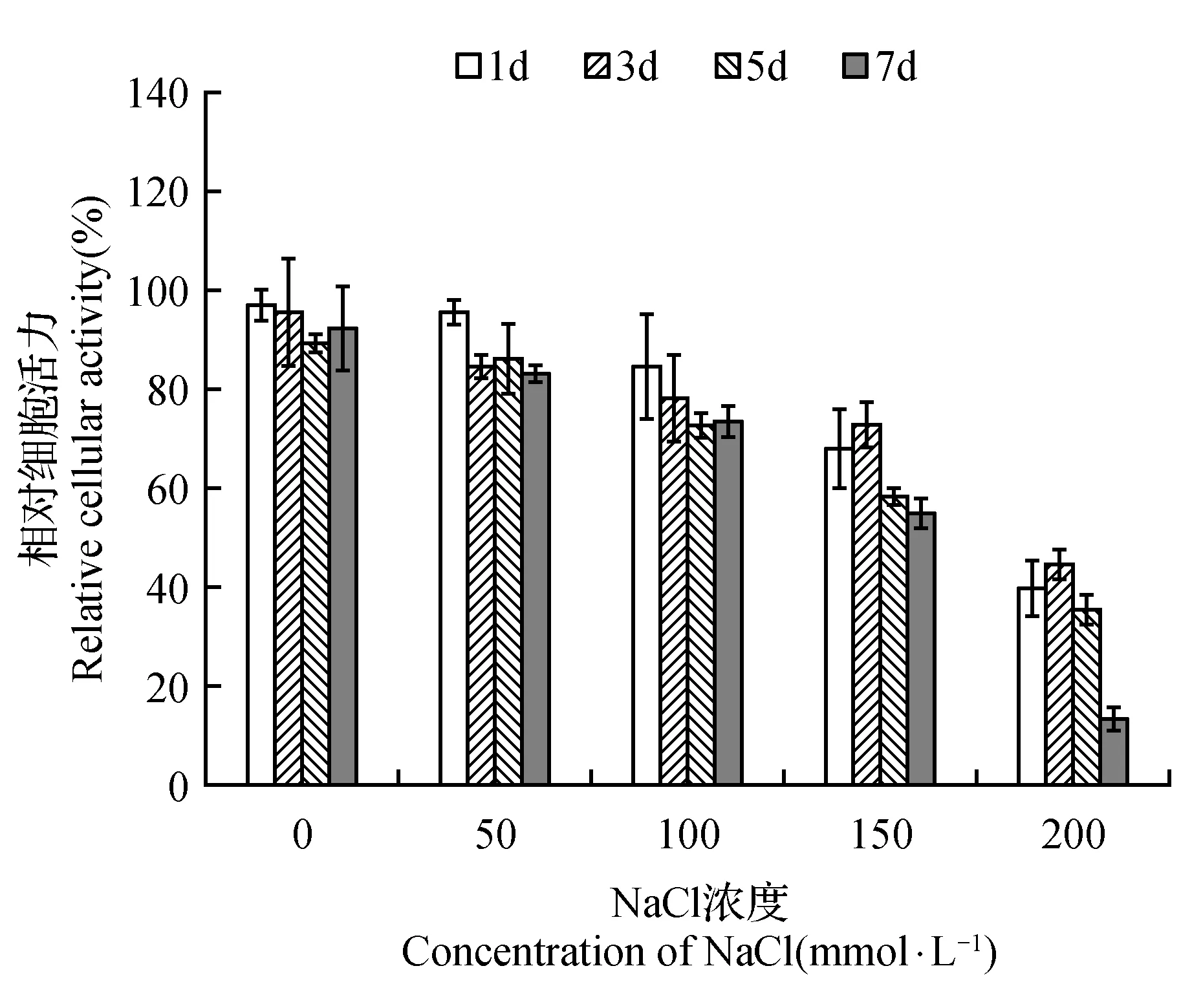
图2 NaCl胁迫对菊芋悬浮细胞相对细胞活力的影响Fig.2 Effect of NaCl stress on relative cellular activity of suspension cells of H.tuberosus
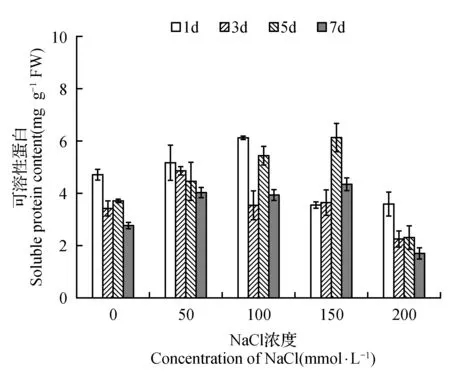
图3 NaCl胁迫对菊芋悬浮细胞可溶性蛋白质含量的影响Fig.3 Effect of NaCl stress on soluble protein content in suspension cells of H.tuberosus
相对细胞活力进一步反映了菊芋悬浮细胞的生理状态。图2显示,菊芋悬浮细胞的相对细胞活力随着NaCl处理浓度的增加呈下降趋势,这也印证了盐胁迫对菊芋悬浮细胞生长的抑制。可溶性蛋白质主要是维系细胞生理代谢过程的重要酶类。随着NaCl处理浓度的升高,菊芋悬浮细胞中的可溶性蛋白质含量呈先增加而后下降的趋势,在100 mmol·L-1NaCl处理的第1天、150 mmol·L-1NaCl处理的第5天呈现了最高值(图3),这意味着菊芋悬浮细胞中复杂的酶系统对于NaCl胁迫可能有一个从响应到适应的复杂调控过程。
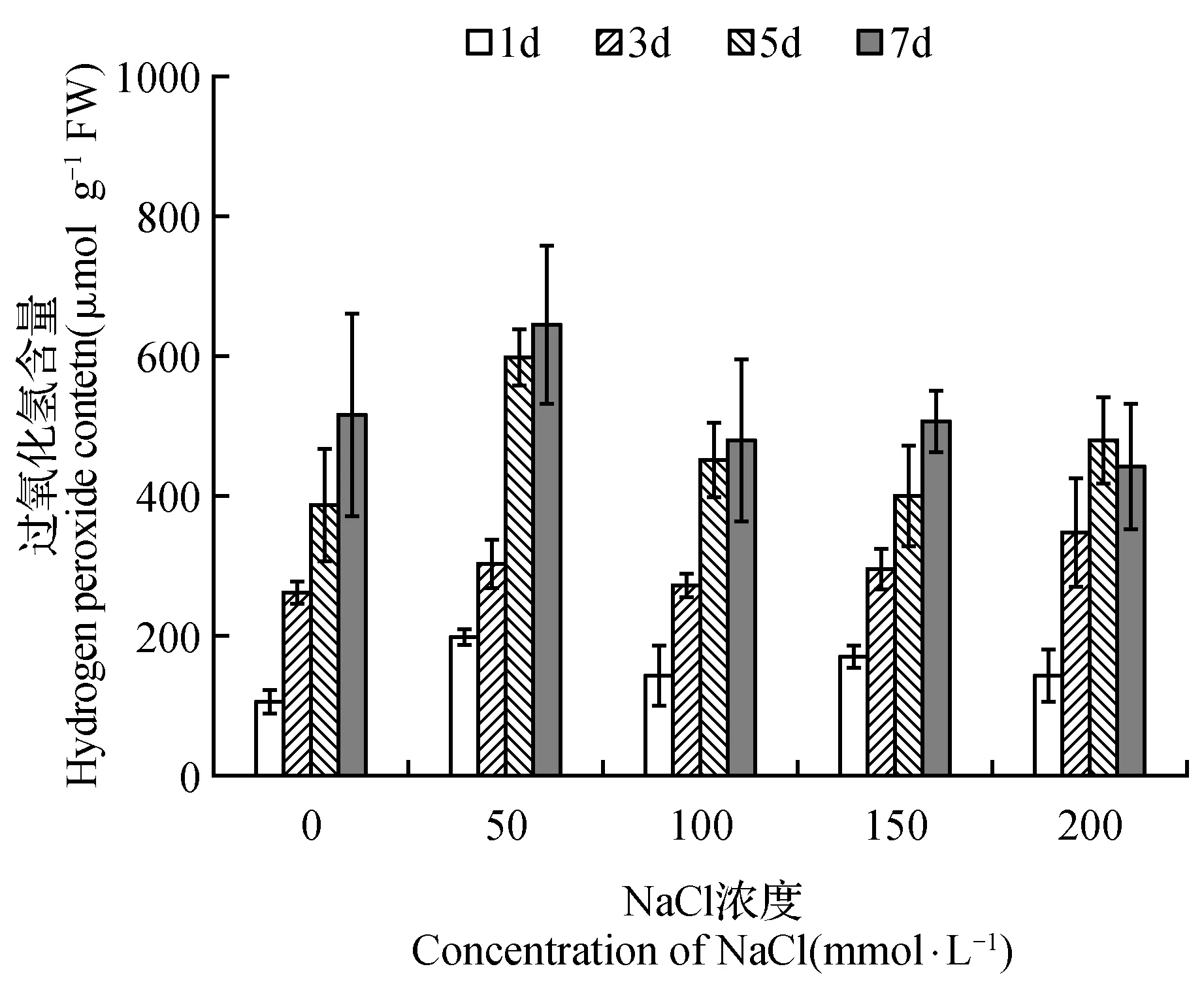
图4 NaCl胁迫对菊芋悬浮细胞中过氧化氢含量的影响Fig.4 Effect of NaCl stress on hydrogen peroxide content in suspension cells of H.tuberosus
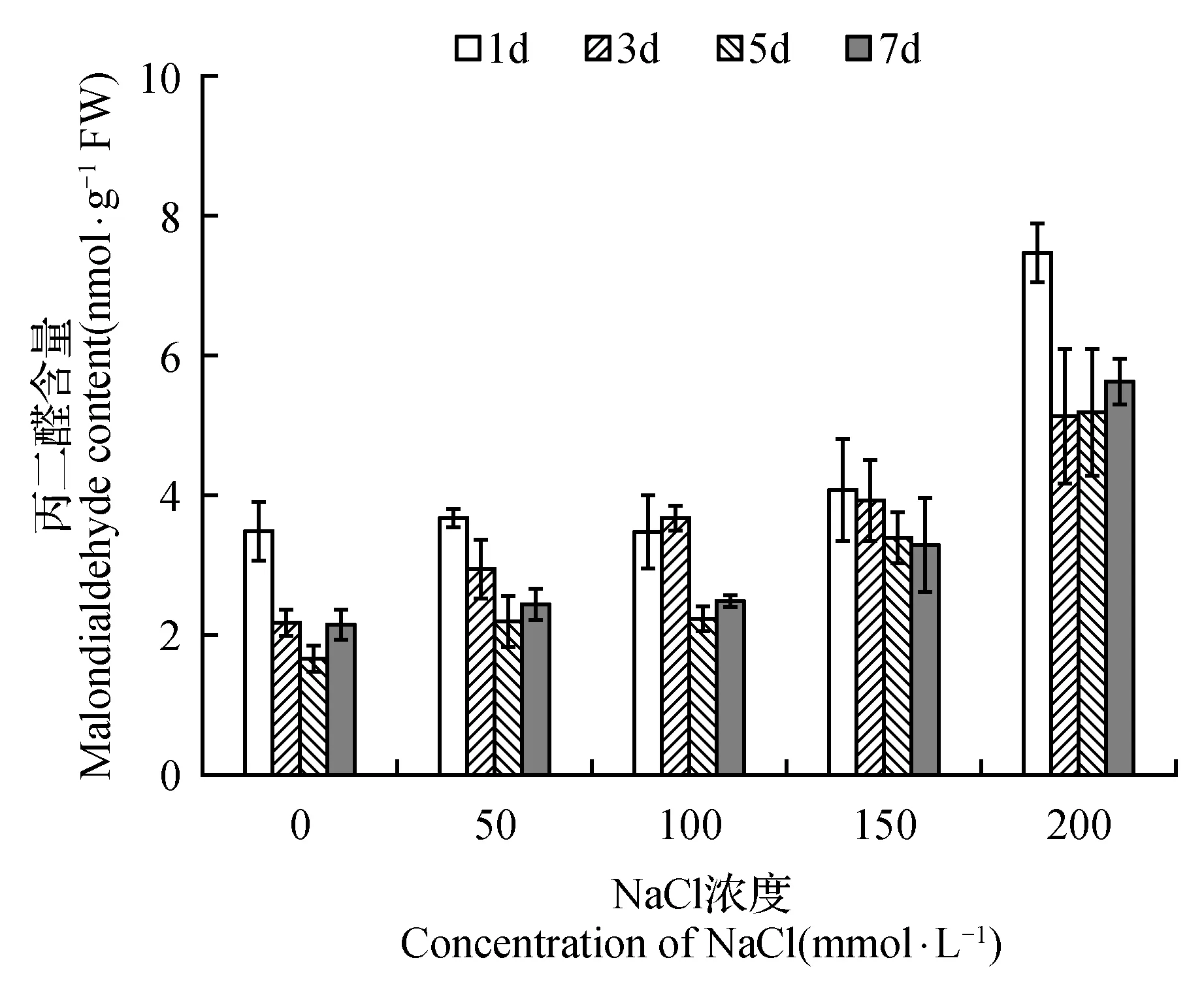
图5 NaCl胁迫对菊芋悬浮细胞中丙二醛含量的影响Fig.5 Effect of NaCl stress on malondiadehyde content in suspension cells of H.tuberosus
2.2 菊芋悬浮细胞的氧化胁迫和抗氧化酶活性
虽然随着培养时间的增加,各处理的菊芋悬浮细胞中过氧化氢(H2O2)均大量累积,但NaCl处理并未引起细胞内H2O2含量的增加(图4)。丙二醛是细胞膜脂质过氧化的产物之一,通常用于指征细胞内发生的氧化胁迫以及受害程度。从图5可以看到,150 mmol·L-1以下的NaCl处理没有导致菊芋悬浮细胞内丙二醛含量的明显增加,200 mmol·L-1NaCl处理的丙二醛含量才显著增加。随NaCl处理浓度增加,抗坏血酸过氧化物酶(APX)、过氧化物酶(POD)活性呈现增高的趋势,而过氧化氢酶(CAT)和超氧化物歧化酶(SOD)可看出明确的变化规律(图6)。
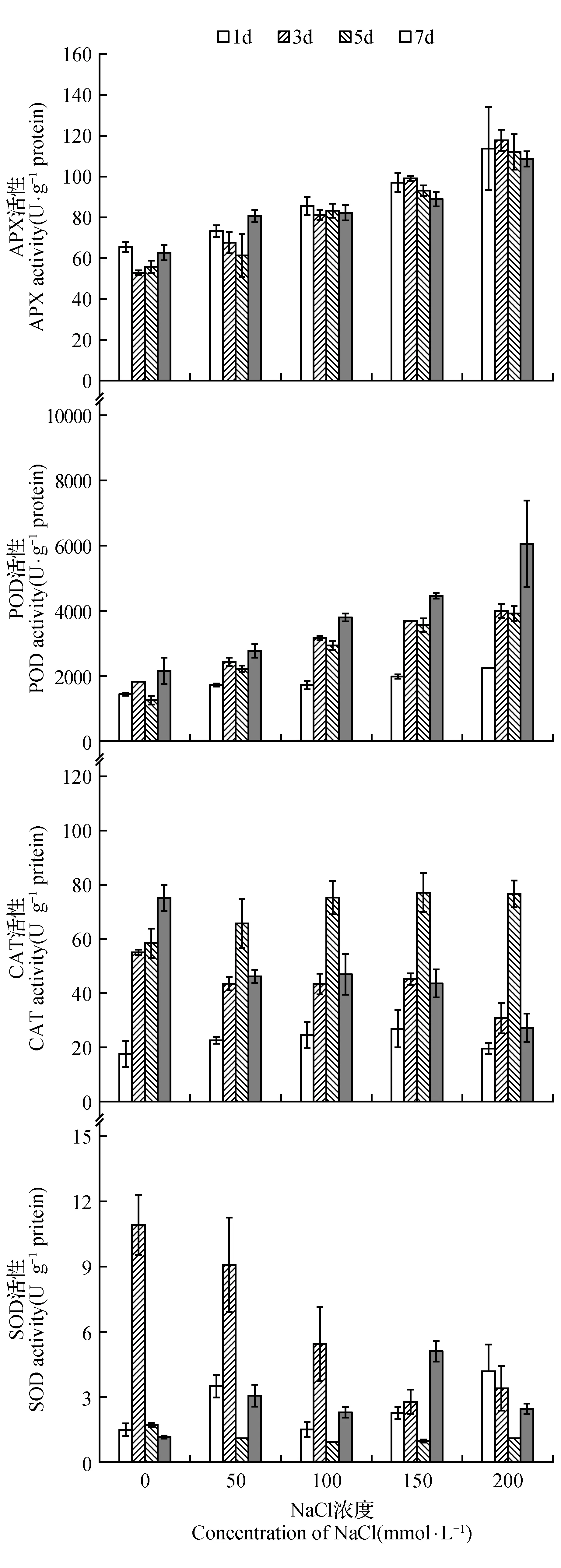
图6 NaCl胁迫下菊芋悬浮细胞中的抗氧化酶活性Fig.6 Antioxidant enzyme activitiesin suspension cells of H.tuberosus under NaCl stress
2.3 菊芋悬浮细胞的酚类物质
一般认为酚类化合物具有较强的抗氧化能力,在植物细胞中发挥着抗氧化作用,这里对NaCl处理第7天菊芋悬浮细胞的总酚含量和14种酚类化合物含量进行了初步的分析。图7显示,150 mmol·L-1NaCl处理下菊芋悬浮细胞中的总酚含量显著增加,表明酚类物质和抗氧化酶系统共同参与了应对氧化胁迫的抗氧化作用。测定的14种酚类化合物在NaCl处理下的变化不完全相同,随盐胁迫强度增强而增加较多的化合物有:羟基苯甲酸类的对羟基苯甲酸,羟基肉桂酸类的3-羟基肉桂酸、咖啡酸、阿魏酸、绿原酸、芥子酸,苯丙烷类的4-羟基香豆素、东莨菪内脂,黄酮类的槲皮素、表儿茶素(表1)。
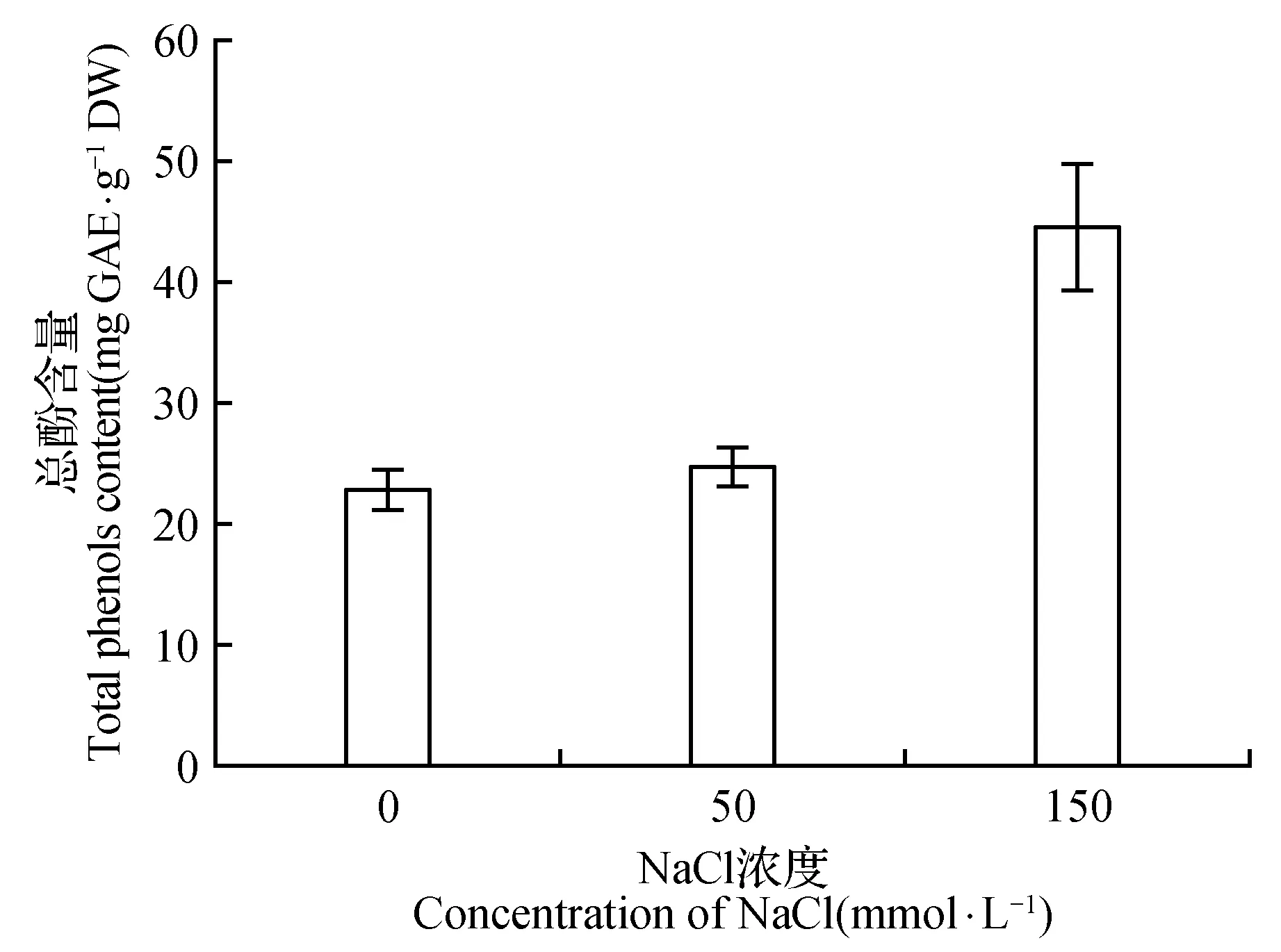
图7 NaCl胁迫对菊芋悬浮细胞中总酚含量的影响Fig.7 Effect of NaCl stress on total phenols content in suspension cells of H.tuberosus

图8 NaCl胁迫对菊芋悬浮细胞中脯氨酸含量的影响Fig.8 Effect of NaCl stress on proline content in suspension cells of H.tuberosus
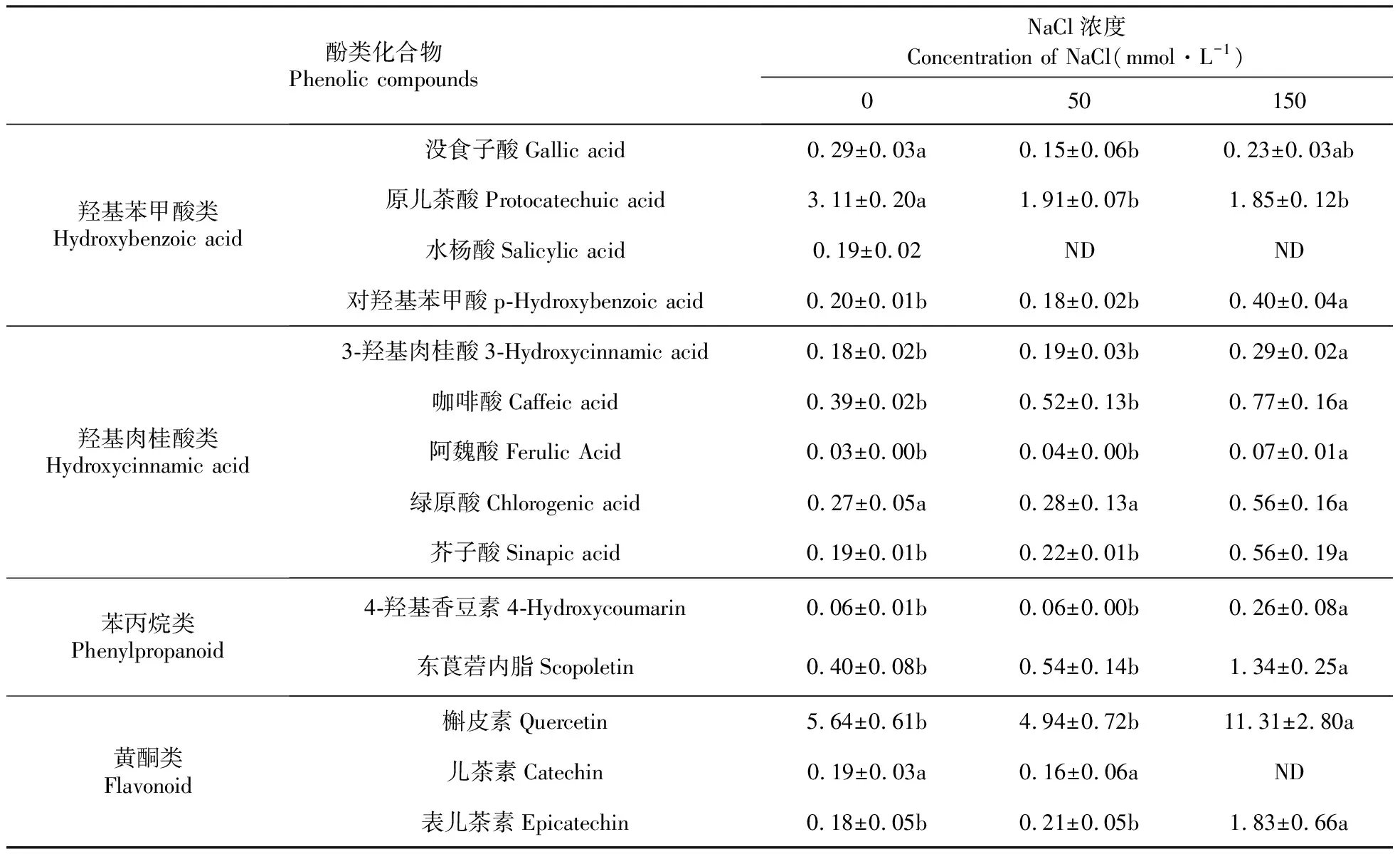
酚类化合物Phenolic compoundsNaCl浓度Concentration of NaCl(mmol·L-1)050150羟基苯甲酸类Hydroxybenzoic acid没食子酸Gallic acid0.29±0.03a0.15±0.06b0.23±0.03ab原儿茶酸Protocatechuic acid3.11±0.20a1.91±0.07b1.85±0.12b水杨酸Salicylic acid0.19±0.02NDND对羟基苯甲酸p-Hydroxybenzoic acid0.20±0.01b0.18±0.02b0.40±0.04a羟基肉桂酸类Hydroxycinnamic acid3-羟基肉桂酸3-Hydroxycinnamic acid0.18±0.02b0.19±0.03b0.29±0.02a咖啡酸Caffeic acid0.39±0.02b0.52±0.13b0.77±0.16a阿魏酸Ferulic Acid0.03±0.00b0.04±0.00b0.07±0.01a绿原酸Chlorogenic acid0.27±0.05a0.28±0.13a0.56±0.16a芥子酸Sinapic acid0.19±0.01b0.22±0.01b0.56±0.19a苯丙烷类Phenylpropanoid4-羟基香豆素4-Hydroxycoumarin0.06±0.01b0.06±0.00b0.26±0.08a东莨菪内脂Scopoletin0.40±0.08b0.54±0.14b1.34±0.25a黄酮类Flavonoid槲皮素Quercetin5.64±0.61b4.94±0.72b11.31±2.80a儿茶素Catechin0.19±0.03a0.16±0.06aND表儿茶素Epicatechin0.18±0.05b0.21±0.05b1.83±0.66a
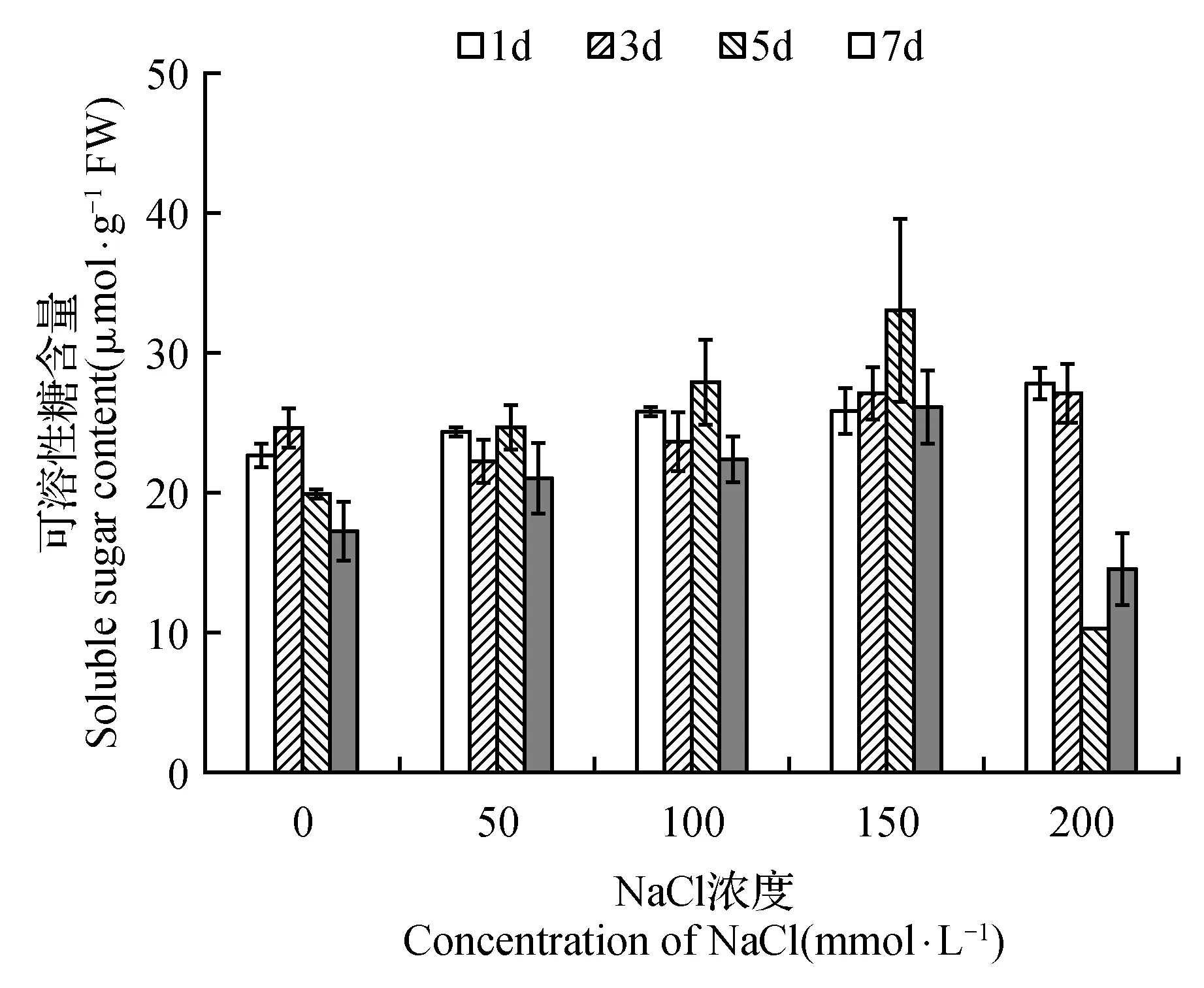
图9 NaCl胁迫对菊芋悬浮细胞中可溶性糖含量的影响Fig.9 Effect of NaCl stress on soluble sugar content in suspension cells of H.tuberosus
2.4 菊芋悬浮细胞的渗透调节
在NaCl处理产生的渗透胁迫下,菊芋悬浮细胞中的脯氨酸含量显著增加,并且随着NaCl胁迫强度的增加累积的幅度也明显增大(图8),表明盐胁迫下菊芋悬浮细胞内发生了明确的渗透调节过程。可溶性糖也被认为是主要的渗透调节物质,但NaCl处理并未引起菊芋悬浮细胞内可溶性糖含量的显著变化(图9),这意味着可溶性糖在菊芋悬浮细胞应对NaCl渗透胁迫的渗透调节作用中发挥的作用不大。
3 讨论
植物应激盐胁迫有多种表现形式,如生长速度的改变、形态特征的变化、生理生化及代谢途径的调整等。与以往苦苣菜[17]、黄瓜[18]等悬浮细胞的研究结果类似,本研究的结果显示盐胁迫也显著降低了菊芋悬浮细胞的活力,抑制了细胞的生长,并且随着盐浓度和处理时间的增加,抑制强度也在增大。
盐胁迫通常会导致细胞内氧自由基积累,积累的氧自由基首先攻击膜系统,膜脂肪酸中的不饱和键被氧化,最终形成丙二醛,因而丙二醛的含量是反应细胞膜脂过氧化作用强弱和脂膜破坏程度的重要指标[19]。同时,细胞内也存在有活性氧自由基清除系统即抗氧化系统,防御活性氧对膜脂的攻击而维持膜结构的完整性。各种抗氧化酶(超氧化物歧化酶、过氧化物酶、过氧化氢酶、抗坏血酸过氧化物酶)协作而形成酶促抗氧化系统,而酚类化合物则属于非酶促抗氧化系统,3-羟基肉桂酸、咖啡酸、芥子酸等能抑制脂质过氧化,槲皮素和表儿茶素等黄酮类物质可以清除自由基,它们具有很强的抗氧化能力,是很好的还原剂、单线态氧猝灭剂和供氢体[20~22]。本研究结果显示,150 mmol·L-1以下的NaCl处理没有导致菊芋悬浮细胞内丙二醛含量的明显增加,200 mmol·L-1NaCl处理的丙二醛含量才显著增加(图5),而过氧化氢含量仅是50 mmol·L-1NaCl处理的略高于对照组,更高的NaCl浓度下又逐渐恢复到近于对照水平(图4)。这样的结果并不意味着NaCl处理没有诱发菊芋悬浮细胞发生氧化胁迫,因为伴随着过氧化氢等活性氧的产生,细胞内清除活性氧的抗氧化系统也在工作,测定的过氧化氢和丙二醛含量只是体现了细胞内氧化胁迫与抗氧化系统相互作用后的平衡结果。抗坏血酸过氧化物酶(APX)、过氧化物酶(POD)活性呈现随NaCl处理浓度增加而增高的趋势(图6),对羟基苯甲酸、3-羟基肉桂酸、咖啡酸、阿魏酸、绿原酸、芥子酸、4-羟基香豆素、东莨菪内脂、槲皮素、表儿茶素等酚类化合物随NaCl处理浓度的增加也显著提高了含量(表1、图7),说明它们确实发挥了很好的抗氧化作用。
盐胁迫対植物的伤害除离子毒害效应外主要是引发渗透胁迫,作为应答植物则在细胞内合成、积累各种渗透调节物质以规避渗透胁迫的危害,脯氨酸和可溶性糖被认为是有效的有机渗透调节物质[23]。从本研究结果看,脯氨酸在菊芋悬浮细胞应对NaCl渗透胁迫的渗透调节作用中扮演着重要的角色,而可溶性糖发挥的作用不大。
