硫氧还蛋白(Trx)对糖尿病视网膜病变模型鼠血清补体Clq肿瘤坏死因子相关蛋白9(CTRP9)表达的影响
2019-03-15杨岚代海燕鞠传余
杨岚 代海燕 鞠传余
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病(diabetes mellitus,DM)最严重与最常见的眼部并发症之一,随着DM病程增加、年龄增大,DR发病率显著升高,可导致患者视力严重下降甚至失明[1]。有研究表明,脂肪因子具有调节胰岛素敏感性、能量代谢、胰岛β细胞功能、炎症反应等多种效应,是DR发病进程的重要调节因素[2]。补体Clq肿瘤坏死因子相关蛋白9(complement Clq tumor necrosis factor-related protein 9,CTRP9)是新发现的一个脂肪因子,硫氧还蛋白(thioredoxin,Trx)作为重要的抗氧化蛋白,可能也参与了细胞损伤和凋亡的发生[3]。Trx是由Trx、硫氧还蛋白还原酶(thioredoxin reductase,TR)、还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)等组成的氧化还原敏感的多功能小分子蛋白系统[4-5]。Trx作为当前氧化应激反应中的重要指标,在DM患者血清中的含量已有相关报道[6],但在DR患者血清中的含量还未见相关报道。本研究通过构建DR动物模型,探讨Trx对DR动物模型中血清CTRP9含量的影响,具体分析Trx在DR发生发展过程中的作用与机制,以期为临床防治DR提供新的途径。
1 材料与方法
1.1材料24只SPF级雄性SD大鼠,体质量300~350 g,8周龄,动物合格证编号为SCXK2016-0011,购自湖南斯莱克景达实验动物有限公司,无眼疾。链脲佐菌素(streptozocin,STZ;美国Sigma公司);生化试剂均为进口分装或国产分析纯;免疫组织化学SP检测试剂盒,兔抗大鼠多克隆抗体(北京博奥森生物技术有限公司);血糖仪(美国拜耳医药保健有限公司);凋亡检测试剂盒(美国普利莱基因技术有限公司);Trx(美国Sigma公司);ECL试剂盒(德国Pierce公司)。
1.2动物分组与模型的建立24只大鼠随机分为正常对照组(NC组)12只和高脂饮食组12只。NC组以标准大鼠饲料喂养;高脂饮食组以高脂高糖饲料(北京维通利华公司)喂养,喂养4周后经口服葡萄糖耐量实验(oral glucose tolerance test,OGTT)出现胰岛素抵抗。高脂饮食组大鼠均一次性腹腔注射STZ(60 mg·kg-1),NC组大鼠注射相同体积的PBS缓冲液。将高脂饮食组造模成功大鼠随机分为DR组6只和治疗组(DR+Trx组)6只。治疗组大鼠每天腹腔注射Trx(50 mg·kg-1),持续1周,NC组和DR组大鼠每天给予腹腔注射同等体积的PBS。
1.3观察项目(1)造模成功标准:造模3 d后采大鼠尾尖血,采用全自动生化分析仪(日立7100型)测空腹血糖≥16.7 mmol·L-1且伴有视网膜毛细血管内皮细胞增生、基底膜增厚视为DR模型造模成功。(2)CTRP9与活性氧(reactive oxygen species,ROS)测定:大鼠麻醉后摘除眼球,取静脉血,分离血清,采用酶联免疫法测定血清CTRP9含量。同时将带有新鲜视网膜的眼杯进行包埋,并用液氮速冻后制作厚10 μm的切片,PBS清洗后,用5 μmol·L-1二氢乙啶(DHE)于37 ℃孵育30 min,再次清洗后封片在荧光显微镜下观察。使用ImageJ 软件测定视网膜神经节细胞的ROS荧光强度。(3)细胞凋亡测定:将视网膜切片组织置于免疫组织化学湿盒,洗涤后加入脱氧核糖核苷酸末端转移酶(TdT)孵育10 min,再次洗涤后加入蛋白酶抑制剂Cocktail,避光反应30 min,DAPI封片剂后荧光显微镜下观察并计数,计算细胞凋亡指数。(4)CTRP9表达的免疫组织化学分析:摘取的眼球置于40 g·L-1多聚甲醛中固定与包埋1周,切5 μm厚连续切片,进行脱水等处理后4 ℃与Trx兔抗大鼠多克隆抗体(1500)孵育过夜,后续处理后采用3,3-二氨基联苯胺(DAB)显色,出现黄色或棕黄色染色为阳性反应。(5)采用Western blot方法检测脂肪细胞CTRP9、PI3K蛋白表达量,CTRP9、PI3K一抗来自美国Sigma公司(1500、11000),采用ECL进行曝光,以目的条带与β-actin条带的灰度值之比表示目的蛋白的相对表达量。
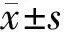
2 结果
2.1一般情况对比NC组大鼠喂养期间体质量增加显著,毛皮有光泽,动作自如,精神状态良好,反应灵敏。所有高脂饮食组大鼠都造模成功,DR组大鼠多尿、多饮、多食,精神逐渐萎靡,毛皮污秽无光泽,显著消瘦、弓背;治疗组大鼠情况有所好转,早期活动有所增加,精神逐渐好转。
2.2血清CTRP9含量对比高脂饮食组大鼠的血清CTRP9含量为(6.19±1.44)μg·L-1,低于NC组[(10.42±0.24)μg·L-1],其中高脂饮食组中的治疗组CTRP9含量[(8.02±2.11)μg·L-1]高于DR组[(3.48±2.48)μg·L-1],差异均有统计学意义(均为P<0.05)。
2.3凋亡指数对比高脂饮食组大鼠的视网膜细胞凋亡指数为(15.20±2.19)%,高于NC组[(2.14±0.24)%],其中高脂饮食组中的治疗组凋亡指数[(5.20±1.49)%]低于DR组[(22.19±3.88)%],差异均有统计学意义(均为P<0.05)。
2.4ROS对比高脂饮食组大鼠的视网膜ROS荧光强度(67.29±1.94)显著高于NC组(5.39±1.29),其中高脂饮食组中治疗组ROS荧光强度(34.20±5.11)低于DR组(78.11±6.33),差异均有统计学意义(均为P<0.05)。见图1。
2.5CTRP9表达量的免疫组织化学检测结果对比所有大鼠视网膜神经纤维层、神经节细胞层、内核层都有CTRP9表达;免疫组织化学检查显示,高脂饮食组大鼠的CTRP9表达量(34.44±3.74)低于NC组(78.20±4.55),治疗组(56.30±4.89)CTRP9表达量高于DR组(45.00±6.01),差异均有统计学意义(均为P<0.05)。见图2。
2.6CTRP9的相对表达量对比Western blot结果显示,高脂饮食组大鼠的CTRP9相对表达量低于NC组,治疗组CTRP9相对表达量高于DR组;高脂饮食组大鼠的PI3K相对表达量高于NC组,治疗组PI3K相对表达量低于DR组,差异均有统计学意义(均为P<0.05)。见图3。

图1 不同组别大鼠视网膜ROS荧光强度对比(×200)

图2 不同组别大鼠视网膜CTRP9表达量免疫组织化学对比(×200)

图3 不同组别大鼠脂肪细胞CTRP9、PI3K的相对表达量对比
3 讨论
DR的发病机制还不明确,但是已有明确的造模方法。STZ诱导的DR动物模型具有简单、经济、重复性好、成模率较高等优势,通过诱导胰腺产生大量的氧自由基而造成β细胞损伤,可模拟人类的胰岛素分泌,导致血胰岛素下降和血糖升高[7]。本研究显示,所有高脂饮食组大鼠都造模成功,不过STZ诱导的大鼠模型造模时间为 1~3 d,观察周期要维持在2周以内,长时间应用可能模型效果不佳。
目前研究认为,多元醇通路的激活、蛋白激酶C的激活、晚期糖基化终末产物的过量生成、氨基己糖途径活性增强等都与DR的发生有关[8]。脂肪组织既是胰岛素作用的重要靶器官,又通过分泌多种因子调节胰岛素及胰岛β细胞功能,成为联系高血脂与DM的重要因素[9]。CTRP9具有改善胰岛素抵抗的脂肪细胞胰岛素的效应,同时由于胰岛素信号通路与炎症信号通路之间存在着广泛的交联对话,而CTRP9具有调节脂肪组织炎症反应的效应[10]。Trx是一种小分子抗氧化蛋白,具有诸多生物学功能。多种疾病状态下Trx 表现出高表达,可能是机体细胞、组织对氧化应激产生的防御反应,借此减轻机体受氧化应激的损伤程度,从而减缓病变进程[11]。Trx具有氧化还原活性,其通过二硫键和巯基互变实现其氧化还原调节功能,是一种反映机体氧化应激反应水平的生物学指标。Trx作为重要的体内抗氧化系统,可能对DR的进程起延缓作用[12]。有研究显示,外源性的Trx可以提高人视网膜色素上皮细胞的抗氧化应激能力,Trx预处理对缺血-再灌注视网膜神经元可以起到保护作用[13]。本研究显示,高脂饮食组大鼠的血清CTRP9含量与CTRP9免疫组织化学表达量低于NC组,治疗组高于DR组,差异均有统计学意义(均为P<0.05)。有研究表明,Trx保护视网膜神经细胞免受药物诱导的氧化应激损伤,外源性Trx在DR大鼠视网膜中具有保护效应[14]。
本研究显示,高脂饮食组大鼠的视网膜ROS荧光强度显著高于NC组,治疗组低于DR组,差异均有统计学意义(均为P<0.05)。NC组视网膜仅可检测到较低水平的ROS,造模后大鼠视网膜超氧化物的水平显著升高,外源性Trx的加入可降低ROS水平。相关研究也表明,外源性Trx具有强效的内源性抗氧化、抗炎症作用[15]。高血糖是DR发病的始动因素,其通过多种机制刺激体内ROS 的产生。正常机体遭遇氧化应激时,过多的ROS 可被抗氧化防御系统清除,而DR时过多的ROS物质则导致细胞损害,表现为ROS、NO在视网膜中生成增多[16]。Trx系统也就是抗氧化防御系统,可通过对细胞内被氧化的二硫键进行还原,修复机体内的氧化损伤。外源性Trx可清除H2O2,也可以直接清除ROS,使蛋白质及酶变性、DNA损害,最终导致细胞凋亡或死亡[17]。
Trx可直接与细胞凋亡信号调节激酶-1相结合,抑制氧化应激诱导的丝裂原活化蛋白激酶的信号级联,而这一信号级联通路可直接导致细胞凋亡的发生[18]。本研究显示,高脂饮食组大鼠的视网膜细胞凋亡指数高于NC组,治疗组低于DR组,差异均有统计学意义(均为P<0.05),提示高血糖可引起视网膜神经细胞凋亡,给予外源性Trx治疗后可抑制视网膜细胞凋亡。
脂肪因子具有调节脂肪炎症反应以及胰岛素信号转导等多种效应,研究表明,CTRP9具有上调脂联素、抵抗素等脂肪因子表达的效应,下调CTRP9的表达则导致脂肪细胞单核细胞趋化蛋白1表达增多,即诱导成熟脂肪细胞转化为非成熟细胞[19]。本研究Western blot结果显示,高脂饮食组大鼠的CTRP9相对表达量低于NC组,治疗组高于DR组;高脂饮食组大鼠的PI3K相对表达量高于NC组,治疗组低于DR组,差异均有统计学意义(均为P<0.05)。有研究显示,CTRP9加入可抑制脂多糖、十二烷酸、Toll样受体配体等诱导的脂肪细胞单核细胞趋化蛋白1、IL-6等炎症因子的表达,从而阻断炎症细胞与脂肪细胞的交联,抑制脂肪组织炎症反应[20]。本研究也有一定的不足,没有对活体视网膜进行相关检验,Trx对胰岛素信号通路分子的调节效应还需进一步研究。
总之,Trx可保护DR大鼠的视网膜细胞免受ROS的损伤,抑制细胞凋亡,促进CTRP9的表达,其机制可能与CTRP9改善PI3K信号通路有关。
