脂溶性荧光染料测定微生物油脂的研究进展*
2019-03-14陈雪芳郭海军黄前霖陈新德
赵 成 ,陈雪芳 ,熊 莲 ,郭海军 ,黄前霖 ,黄 超 †,陈新德 †
(1.中国科学院广州能源研究所,广州 510640;2.中国科学院可再生能源重点实验室,广州 510640;3.广东省新能源和可再生能源研究开发与应用重点实验室,广州 510640;4.中国科学院大学,北京 100049)
0 引 言
微生物油脂[1]是微藻、酵母、真菌、细菌等微生物在体内合成的甘油酯,其组成与植物油脂类似。与植物油脂相比,微生物油脂的生产具有不受气候、季节限制,占地少,所需人力较少等优势,被认为是生产生物柴油的理想原料[2-4]。通常,高效筛选高油脂含量菌株是微生物油脂能源化利用的基础,而如何测量微生物的油脂含量是筛选高油脂含量菌株不可缺少的步骤。目前,传统氯仿/甲醇重量分析方法是测定微生物油脂含量最常用方法[5-6],具有准确性高等优点,然而其分析过程繁琐,需要消耗大量的时间,并且还需要消耗大量的有机溶剂,易造成二次污染等问题。这些缺点在一定程度上限制了该方法的应用。因此,开发快速、环保的方法用于测定微生物油脂含量对微生物油脂能源化利用具有重要意义。近年来,细胞荧光法因检测速度快、准确(精确到单个细胞)、操作简便、污染少(仅需痕量的荧光染料)等优点,在高通量筛选高油脂含量微生物上潜力巨大,备受国内外学者关注[7-9]。其中,荧光染料的选择与应用是细胞荧光法应用最为重要的部分,而在众多染料中,以尼罗红与4,4-二氟- 1,3,5,7-四甲基-4-硼-3a,4a-二氮杂-s-茚烯(4,4-difluoro- 1,3,5,7-tetramethyl-4-bora-3a,4a-diaza-s-indacene,BIODIPY 505/515)这两种脂溶性染料应用最为广泛,是目前微生物油脂定性与定量分析的理想染料。因此,本文以尼罗红与BODIPY 505/515为例,系统介绍微生物油脂的细胞荧光分析方法,包括应用范围、发展历史、影响因素、存在问题以及未来发展趋势等。
1 尼罗红及其在微生物油脂测定中的应用
1.1 尼罗红的结构及其光学性质
尼罗红是一种亲脂、疏水的非极性恶嗪类荧光染料,其化学结构如图1所示,化学式和光谱特性如表1所示。尼罗红易溶于丙酮、二甲基亚砜(dimethyl sulfoxide,DMSO)等有机溶剂,在水溶液中的溶解度比较低,同时,会与水分子发生相互作用(一般为氢键作用)而发生荧光淬灭现象[10]。此外,尼罗红分子苯环上含有羰基等极性取代基,使其对溶剂的极性环境比较敏感;在不同极性溶剂中,其最大荧光强度差别较大,由于在不同的溶剂中存在不同的化学键作用,染色剂分子会发生相互作用,从而导致激发光谱曲线发生一定的移动(红移或蓝移),荧光淬灭速率也会有所不同[11-12],会对荧光分析结果产生一定影响。同时,当溶剂的极性减弱时,尼罗红染色剂激发光谱的峰值会发生蓝移,其原因可能是:(1)在激发光照射时,尼罗红分子偶极矩发生改变,分子发生热运动,导致其光学性质发生变化;(2)尼罗红分子内电荷的转移,使得分子的刚性结构发生变化,从而导致分子表面的活性基团发生改变,进而光学性质发生变化;(3)在染色过程中,尼罗红染色剂与细胞内的一些非脂类的疏水性物质(例如蛋白质等)结合发生聚集沉降[13-15]。研究表明,在激发波长(λex)小于570 nm时,尼罗红可选择性地与细胞内的中性脂质结合,发出金黄色的荧光;激发波长(λem)在 570~590 nm 时,尼罗红能与细胞内所有脂质结合,发出橘红色荧光;而当激发波长大于590 nm时,尼罗红则失去对脂质的敏感性[16]。由此可以看出,尼罗红对细胞内中性脂质具有较强的特异性,因而在微生物中性脂质的测定时,激发波长一般选在570 nm处。
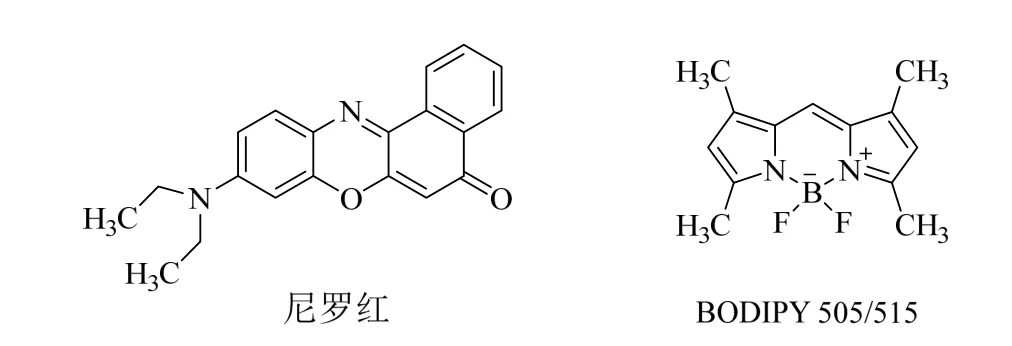
图1 尼罗红与BODIPY 505/515染色剂结构式Fig.1 Structural formula of Nile red and BODIPY 505/515

表1 中性脂质染色剂尼罗红和BODIPY 505/515的分子和光谱特性[8]Table 1 Characteristics of Nile red and BODIPY 505/515 for neutral lipid fluorescent dyeing
1.2 尼罗红荧光分析方法的发展
尼罗红荧光分析微生物油脂含量的方法由来已久。早在1985年,FOWLER等[17]从猕猴的身体上提取相应的组织细胞,使用流式细胞仪、荧光显微镜等对染色后的组织细胞脂质的形态和细胞内分布情况进行观察,结果表明尼罗红染色剂比其他疏水性染色剂具有更高的选择性,可以更清楚地观察到细胞内脂质分布情况。随后,1987年COOKSEY等[18]以Amphora coffeaeformis、Naviculasp.和Tropidoneissp.等微藻为研究对象,通过一定的方法对微藻细胞进行预处理,再经尼罗红荧光染料染色后,并在激发波长为488~525 nm、发射波长为 570~600 nm 时,能观察到较强的荧光现象,同时,还发现使用荧光分光光度计测定的荧光强度与通过传统重量法得到的脂质含量存在一定的线性关系,从而建立了相关性较好的荧光分析方法。1998年,LEE等[19]研究了微藻Botryococcus brauniiUTEX 572,经过一定方法处理后,建立了相关系数高达0.997的尼罗红荧光分析方法,这一成果为取代传统重量分析测定微生物油脂含量奠定了基础。
20世纪初,人们发现除了微藻,如真菌和酵母细胞等微生物也具有生产微生物油脂能力。因此,利用荧光分析法测量真菌和酵母细胞类微生物油脂含量得到研究人员的广泛关注。2004年,KIMURA等[20]以油脂真菌(Mortierella isabellinaIFO-7884、Mortierella nanaIFO-8794、Mortierellaramannianavar.、angulisporaIFO-8187)和油脂酵母(Lipomyces starkeyiIFO-10381、Rhodosporidium toruloidesIFO-0559、Cryptococcus curvatusIFO-1159)为研究对象,考察了预处理方法(温度处理、冷冻处理、电场处理等)和染色条件(染色时间、细胞浓度等)对测量结果的影响规律,筛选出最优操作条件,在最优条件下,建立了适用于不同真菌和酵母细胞并具有较高相关系数的荧光分析方法,从而拓展了尼罗红的荧光分析方法在微生物油脂测定中的应用范围。表2是目前以尼罗红为染料应用于测量不同微生物脂质含量的荧光分析方法。由表2可得,对于大多数微生物,建立的荧光分析方法的相关系数大都超过0.8,尤其是Chlorella vulgaris[21]微藻,其线性相关系数高达0.99,这可能是由于此类微藻的细胞壁和细胞膜的通透性比较好,染色剂比较容易进入细胞。
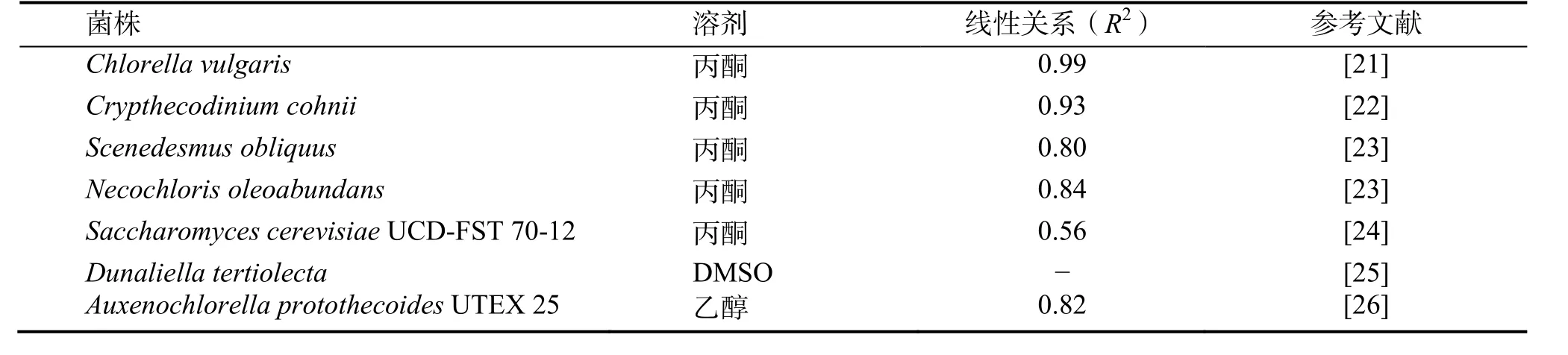
表2 不同溶剂和不同微生物中尼罗红荧光分析方法的线性关系比较Table 2 Compared with the correlation of Nile red fluorescenct method for different microbial in different solvent
1.3 尼罗红荧光分析方法存在的问题及解决方案
经过几十年的发展,尼罗红荧光分析法的开发和研究取得显著的成绩,解决了许多应用难题,并被认为是未来最具应用前景的微生物油脂测定方法。但其实际应用仍受溶剂、尼罗红染色剂特异性以及细胞通透性等因素的影响。
1.3.1 溶剂
如1.1所述,溶剂对荧光分析结果影响很大。因此,对于不同的微生物细胞,溶剂的选择对荧光分析法的可靠性尤为重要。由表2可知在尼罗红荧光分析中,一般选用丙酮作为溶剂,这是由于尼罗红较易溶于丙酮,且丙酮分子小、易挥发,有助于尼罗红进入细胞,特别是在没有细胞壁或者细胞壁、细胞膜较薄的微生物中应用较多[27],而对于那些细胞壁较厚的微生物一般使用渗透能力比较强的DMSO作为染色剂溶剂。CHEN等[23]在微藻Dunaliella tertiolecta的油脂含量测定中使用DMSO溶剂增加细胞的通透性,加快染色剂进入细胞。然而,DMSO分子在细胞悬浮液中对细胞的完整性破坏要比丙酮大,当DMSO的浓度过高时,细胞的荧光强度会显著降低,这是由于悬浮液中细胞碎片会显著增多,使得染色剂无法与细胞脂质结合。因此,在尼罗红荧光分析法过程中,一般先确定细胞壁的厚度和细胞膜通透性,对于没有细胞壁或者细胞壁比较薄的微生物,采用丙酮作为溶剂;而对拥有较厚细胞壁的微生物则采用DMSO作为染色剂溶剂。
1.3.2 尼罗红染色剂的特异性
尼罗红染色剂在细胞内部这个疏水性的环境中,除了可以与脂质液滴结合发出荧光之外,还有可能与疏水环境中的特定蛋白质或其他疏水性物质(例如叶绿素等非油脂成分)结合,同样可以产生荧光现象[28];同时,某些微藻中含有较多色素,在一定的激发光照射下也会产生一定的荧光强度,使尼罗红的荧光分析过程中细胞的背景荧光值增加,影响荧光分析方法的准确性和灵敏性。
1.3.3 增强细胞通透性的措施
在尼罗红荧光分析方法建立中,荧光淬灭和染色剂的渗透等问题严重阻碍了其进一步发展。对于荧光淬灭问题,一般考虑寻找性能更加稳定的染色剂或对染色剂进行改性;而对于染色剂渗透问题,一般使用化学或物理方法对细胞进行处理,从而增加细胞通透性,加快染色剂进入细胞。
(1)化学方法
化学方法主要是指使用一定百分比的有机试剂对细胞进行悬浮处理,其目的是增加细胞的通透性,加快染色剂进入细胞;同时,加入一定量的有机试剂可以增加溶液的疏水性,使染色剂更加稳定。目前比较常见的有机试剂有DMSO、丙酮、乙醇、甘油及乙二胺四乙酸(EDTA)等[26,29]。
DMSO是一种常见的极性有机溶剂,其对细胞膜具有较强的亲和性,使用一定百分比的DMSO溶液对细胞进行悬浮,不仅可以一定程度上增强细胞的通透性,加快染色剂进入细胞,而且可以改变悬浮液的极性,使染色剂在染色过程中淬灭速率减慢,更加有利于细胞染色。同时,DMSO属于体积较小的极性分子,而细胞膜一般是由磷脂双分子层组成的,具有流动性,根据渗透原理,DMSO分子可以比较容易进入细胞内部,染色剂分子可以随着DMSO分子一起进入细胞达到对细胞内物质染色的目的[30]。因此,在一些较厚细胞壁或者细胞通透性比较差的细胞中,使用一定百分比的DMSO对其进行悬浮,可以在一定程度上增强染色剂的荧光强度,提高荧光分析方法的准确性。
丙三醇(甘油),与 DMSO相比其细胞毒性比较小,与细胞膜的磷脂双分子层等成份相似,根据相似相溶原理,其可以比较容易渗透进入细胞。PICK等[27]报道了使用不同百分比的甘油作为细胞悬浮液,发现甘油可以显著增加细胞的荧光强度,其效果甚至比DMSO悬浮的效果好。但甘油与细胞内脂质结构相似,在染色过程中,染色剂可能会与甘油结合,导致荧光背景值增强,会降低荧光分析方法的灵敏度和准确性。
化学处理方法可以一定程度上增加细胞通透性,增强细胞荧光强度,但也存在增强染色背景值、不利于细胞长期保存等问题。
(2)物理方法
物理处理方法一般是通过改变外界条件,对细胞进行预处理来增加细胞的通透性,使染色剂更加容易进入细胞。主要包括热处理法、冻干法、微波法、电场法、超声法等。
①热处理法是在一定的温度范围内(30~70℃)对细胞悬浮液进行水浴加热处理,使得悬浮液中细胞的活性降低,细胞运动减缓,从而使染色剂与细胞的接触时间更长,更加容易进入细胞,所得荧光强度也随之增强[31]。但由于不同细胞的耐温性不同,因此,对于不同的细胞,在保证细胞不失活的前提下,最大限度地加快染色剂进入细胞,选择合适的温度进行处理对荧光分析方法的建立至关重要。
②冷冻干燥法,即先对细胞进行冻干,然后磨碎,测定其荧光强度的一种方法。由于测定过程中不存在细胞悬浮,可以在一定程度上减少环境中荧光产生的负面效应[21],此外,也有人在液氮保护下进行研磨,这种方法得到的微生物菌体,避免了在研磨过程中菌体结构和内部脂质液滴的破环,对测定菌体粉末中的脂质含量具有一定的意义。冷冻干燥处理主要应用于一些需要长期保存的细胞样品中。
③微波处理方法。微波具有较强的穿透能力,可以改变细胞膜的孔通透性,从而加快染色剂进入细胞。微波处理后,分子内的热运动加快,染色剂迅速进入细胞,从而增加染色效果。但微波处理也很容易导致细胞被击穿而失活,实验的重复性比较差等问题[32]。
④电场处理。细胞在电场力的作用下会加速自我旋转,增加细胞与染色剂的接触机会;同时,在电场作用下,染色剂分子在溶液中的扩散更快,更加容易进入细胞[33]。
与化学方法相比,物理处理方法条件比较容易控制,相对比较稳定,操作比较简单,同时,使用物理方法对环境的污染比较小,有利于可持续发展。但在使用物理方法处理细胞悬浮液时,也存在其处理强度难以控制,容易导致细胞大量死亡等问题。
2 BODIPY 505/515及其在微生物油脂测定中的应用
2.1 BODIPY 505/515的结构及其光学性质
BODIPY 505/515结构式与分子式分别如图1和表1所示。与尼罗红相比,BODIPY 505/515具有较高的荧光量子产率和较好的摩尔消光系数,同时,对 pH和极性环境的变化不敏感,荧光强度比较稳定,也具有相对较强的发射峰,在不同的激发/发射波长下,其荧光基团对蛋白质、DNA等具有一定的荧光最大值,通常应用于细胞脂质分析中。在荧光分析细胞脂质中,BODIPY 505/515具有较强的特异性,一般不与细胞间质内的脂质液滴结合,细胞内色素等物质对其干扰也比较小,可用于细胞内的脂质液滴可视化观察(图2)[28,34]。由图2可以清楚地看出BODIPY 505/515荧光探针进入微藻细胞后与细胞内的脂质结合,在一定的激发光照射下,产生较强的绿色荧光,同时与尼罗红染色剂相比,在可视化观察细胞脂质发现,绿色荧光更加明显地分布在细胞的某些位置,说明BODIPY 505/515染色剂对细胞内脂质具有较强的选择性。

图2 不同微藻C.vulgaris和D. primolecta在尼罗红和BODIPY染色下的荧光显微照片:C. vulgaris微藻在BODIPY(a)和尼罗红(b)染色剂染色; D. primolecta微藻在BODIPY(c)和尼罗红(d)染色剂染色[5]Fig.2 Differential interference contrast (DIC) images of C.vulgaris, D. primolecta,respectively stained with BODIPY and Nile red: C. vulgaris stained with BODIPY (a) and Nile red (b);D. primolecta stained with BODIPY (c) and Nile red (d)
2.2 BODIPY 505/515荧光分析方法的发展和应用
BODIPY 505/515分子量较小,化学结构和光学性质比尼罗红稳定,容易与细胞膜、细胞质相融合,对细胞的渗透能力较强,更容易进入细胞。如表3所示,在微生物荧光分析方法中,BODIPY 505/515一般溶解在DMSO中,对不同的微生物细胞进行荧光分析时,其激发波长存在一定差异。BODIPY 505/515荧光染色剂虽然发展历史不长,但已有许多关于其在不同微生物中应用的报道。2012年,GOVENDER等[28]和BRENNAN等[34]几乎同时提出了BODIPY 505/515荧光染料在微生物油脂测定方面的应用。GOVENDER以微藻ChlorellavulgarisCCAP 211/1113和Dunaliella primolecta11/34为研究对象,比较了尼罗红和BODIPY 505/515染色剂对细胞的可视化观察,发现BODIPY 505/515染色剂在细胞中的荧光更加稳定,选择性更强,可以更加清楚的观察细胞内脂质液滴。随后,BRENNAN等研究了Nanno chloropsis oculata等微藻,主要探究了不同溶剂对BODIPY 505/515荧光探针的染色效果,发现BODIOY 505/515在DMSO中的效果最好,该结果对后续的研究具有重要借鉴意义。2010年,COOPER等[35]研究一些较大体积的微藻,例如储油微藻Ophiocytiummaius Naegeli Xanthophyceae、细长的单细胞微藻Chrysochromulinasp. Haptophyceae、MallomonassplendensSynurophyceae等,发现BODIPY 505/515荧光探针可以轻易地渗透进入各种不同微藻细胞,与细胞内脂质液滴结合,产生较稳定的荧光强度,在荧光显微镜下,可以清楚地观察到微藻细胞内脂质液滴的分布。目前,BODIPY 505/515染色剂一般应用于微藻细胞的研究,在酵母细胞、真菌等其他微生物中的研究还比较少,有待进一步探究。
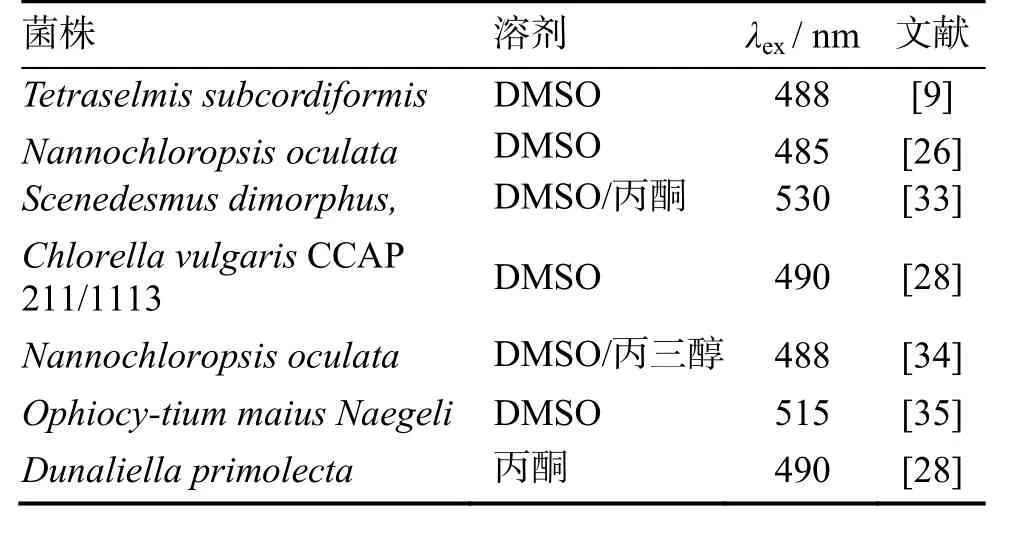
表3 BODIPY 505/515荧光探针的溶剂种类和激发波长Table 3 The solvent and excitation wavelength of fluorescence dye BODIPY505/515
2.3 BODIPY 505/515荧光分析方法存在问题
与尼罗红相比,BODIPY 505/515主要应用于细胞内脂质等其他疏水性物质的可视化观察,在荧光分析方法建立方面应用较少。这是由于BODIPY 505/515荧光染色剂在溶液中比较稳定,进入细胞后其荧光淬灭比较慢,可以比较方便地应用于细胞内脂质分布的观察,但其在溶液中的荧光背景值比较强,建立的荧光分析方法的灵敏性比较差。除此之外,BODIPY 505/515还存在染色剂渗透问题、细胞内荧光淬灭问题、溶剂选择问题等。
(1)荧光背景问题。随着对 BODIPY 505/515荧光探针研究的深入,研究者发现其溶解在有机溶剂中时,虽然可以较快速地进入细胞、比较清晰地观察细胞内脂质,但在荧光分析方法的线性建立过程中,细胞的脂质含量与荧光强度的线性关系比较弱(低于尼罗红染色剂的线性关系),主要原因是BODIPY 505/515荧光探针对溶剂的极性变化不敏感,导致在细胞悬浮液中其荧光背景值比较强[8]。
(2)渗透问题。BODIPY 505/515的分子量比尼罗红的分子量小(表1),分子结构更加对称(图1),同时,其分子较高的油/水分配系数导致染色剂分子可以很轻松地通过细胞膜和细胞器膜进入细胞内部[34]。一些细胞壁结构比较简单的微藻细胞(例如Chrysochromulinasp、Mallomonas splendens[35]等)有较快的渗透性,在荧光显微镜中可以较清楚地看出染色剂进入细胞。但在一些细胞壁较厚或细胞壁结构较复杂的微藻Nannochloropsisoculata[34]观察时,BODIPY 505/515则比较难进入微藻细胞,同时渗透率也比较低,因此,采用相应的方法提高细胞通透性是必要的。
(3)细胞染色过程中荧光强度衰退问题。荧光衰退现象是荧光探针分析方法普遍存在的问题。在染色的过程中,由于荧光染色剂分子在一定的激发光照射下,分子内部发生相互作用,分子的能量发生转移,导致其荧光强度衰退;同时,荧光探针与脂质特异性结合,分子间发生一定的键反应,生成相应的聚集体,导致染色剂荧光强度衰退[27]。
(4)溶剂问题。DMSO、丙酮等有机溶剂可以增大 BODIPY 505/515的荧光强度,但这些有机试剂对细胞的生长具有一定的毒性,在实验过程中,有机试剂的浓度过高会导致测定细胞死亡[9]。因此,已有的研究中,一般选用低浓度的DMSO作为BODIPY 505/515的溶剂(表3)。
(5)培养液中其他成分的干扰。在分析样品的预处理过程中,由于一些微生物如微藻等,其培养液中可能存在其他一些未知的生长习性相似的微生物,在染色过程中,这些未知的微生物也可能会被一起染色,从而影响 BODIPY 505/515荧光探针的可视化观察和荧光分析方法的准确性。这是由于在可视化观察中,所有染色的微生物都可以被观察到,从而无法分辨目标微生物,不利于其结果分析;同时,在荧光定量分析中,由于每次微藻液中的未知微生物的含量不确定,从而导致建立的荧光分析方法的准确性降低。但微藻培养液中的其他有机物对荧光分析结果影响较小,这些有机物在水溶液中浓度比较低,荧光探针一般都是疏水性的,其在水溶液中会迅速发生荧光淬灭现象,故不会与水溶液中的有机物结合产生荧光,因而对荧光分析结果影响较小[8]。
3 尼罗红和 BODIPY 505/515荧光分析方法的比较
在目前的研究中,尼罗红荧光分析方法主要应用于细胞的中性脂质的定性定量测定,其对磷脂、胆固醇等类型的脂质响应值比较低,应用较少[18]。尼罗红探针的荧光分析方法研究已经比较成熟,不少研究者建立了线性比较好的荧光分析方法应用于不同种类的微藻、酵母、真菌等微生物[22];然而,BODIPY 505/515作为一种相对新型的荧光探针,由于其光学性质比较稳定且具有一些与尼罗红探针相似的性质,有研究者尝试用其来取代尼罗红荧光探针进行细胞脂质的定性定量测定[28]。研究发现,在细胞脂质液滴的观察方面,BODIPY 505/515具有稳定性强、荧光强度高、可视化效果比较好等优势,但在细胞脂质含量定量测定的进一步研究发现,其建立的荧光分析方法线性较差,不利于其对脂质的定量分析[28]。随后,有研究者采用流式细胞仪来减弱其荧光背景,增强其线性关系,对一些微藻类细胞建立了一定线性关系的荧光分析方法,但也还有许多问题有待解决,例如荧光探针与脂质液滴结合的机理、BODIPY 505/515在溶液中荧光背景值较强的原因等[36]。总的来说,BODIPY 505/515作为一种近年发展起来的新型荧光探针,比尼罗红荧光探针的应用范围更加广泛。
4 结论与展望
微生物油脂是一种极具发展前景的生物柴油原料,高效筛选高油脂含量菌株是实现微生物油脂能源化利用的关键。荧光分析方法可以解决目前微生物油脂含量测定方法效率低、周期长、污染大等问题。本文以典型的脂溶性荧光染料尼罗红和BODIPY 505/515为例,介绍了荧光探针在微生物油脂测定中的应用。对两种荧光分析方法的准确性、适用性进行比较,并对其细胞前处理、染色条件的优化和存在的一些问题进行总结。
与传统的油脂分析方法相比,荧光分析方法具有绿色、环保、高效等优势,但在实际应用中,还存在一些问题,例如荧光探针在水溶液中的稳定性、有机溶剂使用等,这些问题也是未来荧光探针的研究方向和重点。其中,采用一定的方法增加荧光探针在水溶液中的稳定性是未来的一个重要研究方向。荧光探针尼罗红和BODIPY 505/515染色剂由于其疏水性,一般很难在水溶液存在;同时,染色剂分子在水溶液中会迅速发生褪色反应,然后失去其特有的光学特性,因此一般采用有机试剂作为溶剂,这不利于可持续发展。为了保证染色剂的光学性能,不少研究者考虑从染色剂结构、吸附性能入手增大其水溶性。KURNIASIH等[37]以十二烷基磺酸钠(SDS)等表面活性剂为溶剂,对尼罗红染色剂进行吸附改性,发现尼罗红染色剂在表面活性剂溶液中有较强的溶解性,发现其具有较好的光学性质性能。FELBECK等[38]采用CTAB表面活性剂对水滑石进行改性后,增加其吸附性,然后对染色剂进行吸附处理,可以增大染色剂的溶解性。因此,对于未来荧光分析方法的发展,一方面可以考虑对染色剂本身进行相应的改性,例如在染色剂分子上引入一些亲水性的官能团,在增大荧光探针水溶性的同时不改变其光学性质,同时减少荧光淬灭;另一方面可以考虑寻找荧光探针更好的附载体,其不但可以负载染色剂,使染色剂能溶解在水溶液中,而且可以产生较强的、稳定的荧光,这是未来一个重要的研究方向。
