骨髓间充质干细胞对大鼠膀胱癌的治疗效果
2019-03-13温英武
温英武 李 强
(开滦总医院泌尿外科,唐山063000)
膀胱癌是我国泌尿系统疾病中最常见的恶性肿瘤之一,近年来在全世界范围内发病率持续升高[1,2]。目前对于膀胱癌的病因以及发病机制尚未完全清楚,但其致病因素可以涉及遗传、基因异常、环境、化学物质暴露、慢性刺激等因素,严重威胁着人类健康[3]。膀胱癌的发病率与年龄呈正相关,随年龄的增长,发病率也会有所增加,并且男性的发病率要远高于女性[4,5]。在基因角度上分析,包括 c-myc、Survivin、Ras 等癌基因受到激活,p53、Rb、p16、p21 等抑癌基因发生了失活,细胞周期调节蛋白如 cyclins、ATM 等的表达或功能异常均与膀胱癌的发生有直接关系[6,7]。目前临床上手术治疗是膀胱癌的主要治疗手段,在手术治疗的同时结合放化疗以及生物治疗同时进行,但是手术治疗的复发率很髙,总体的生存率不是十分理想。因此,寻求一种新的治疗手段是切实需要解决的关键性课题,对膀胱癌的治疗具有重大的现实意义。
在对果蝇进行的实验研究中,学者们发现了一条存在于细胞间起相互作用的信号通路:Notch信号途径。Notch信号通路主要有3部分组成:Notch受体、Notch配体和CSL DNA结合蛋白。Notch受体基有4种,分别是:Notch1~Notch4;以及5种配体基因,包括:Jagged1、Jagged2、DELL1、DELL3以及DELL4。有学术研究已经证实,Notch信号通路的相关因子在肿瘤的形成以及发展过程当中起重要作用,而Notch1和Jagged1作为Notch信号通路的代表性因子,在肿瘤的形成以及肿瘤的转移之中都发挥了不可替代的作用,所以本实验选取Notch1和Jagged1作为检测肿瘤相关指标的因子。
1 材料与方法
1.1实验动物 BMSCs的供体动物:SPF级幼年雄性SD大鼠6只,3~5周龄,体重90~110 g。BMSCs的受体动物:SPF级成年雌性SD大鼠60只,体重180~220 g,均购自北京维通利华动物公司。
1.2方法
1.2.1BMSCs的分离及培养 使用乙醚麻醉大鼠,然后脱颈处死大鼠,在无菌条件下将股骨和胫骨分离,暴露骨髓腔。用DMEM高糖培养基冲洗骨髓腔,并收集冲洗液,1 000 r/min低温离心10 min后弃去上清液,用10%胎牛血清的DMEM高糖培养基重悬细胞。计数后按1×106cm2密度接种于培养瓶中,置于37℃、5%CO2孵箱中培养,48 h后进行第1次换液,第2次以后间隔2~3 d换液1次。待细胞95%融合时,使用0.25%胰酶消化,按1∶2 的比例进行传代,细胞传至第3代用于实验。
1.2.2实验动物及分组 SPF级健康成年雌性SD大鼠60只,体重180~220 g。在实验前让大鼠自由进食饮水,适应性饲养1周。将60只SD雌性大鼠随机分为3组,每组20只:对照组,模型组,BMSCs治疗组。模型组使用MNU(4 mg/ml)膀胱灌注,2 mg/次,14 d/次,共4次。治疗组在模型建立成功后的第28天经尾静脉注射BMSCs与DMEM悬液1.0 ml,对照组、模型组给予等剂量的生理盐水。
1.2.3动物模型制备 MNU溶液的配制,按照每只大鼠2 mg的剂量称取MNU,使用生理盐水将溶液配成终浓度为4 mg/ml;大鼠采取腹腔麻醉法,使用10%水合氯醛,按照0.3 ml/100 g的剂量对大鼠进行麻醉;对大鼠的尿道口进行常规消毒;将软化的硬膜外导管从大鼠的尿道口后唇插入膀胱,插进3~5 cm,将大鼠膀胱内的尿液抽出;抽出尿液后缓慢注入已配制好的MNU溶液0.5 ml;操作完毕,未苏醒的大鼠取仰卧位,模型组使用MNT(4 mg/ml)膀胱灌注,2 mg/次,14 d/次,共4次;对照组同法行等量的PBS灌注。第10周用脱臼法处死所有大鼠,将膀胱整个切除,肉眼观察膀胱变化,在病变明显处取材。
1.2.4RT-PCR检测Notch1和Jagged1的基因表达 组织总RNA的提取:取膀胱组织约100 mg,将组织剪碎后放入匀浆器内,加入1 ml预冷的Trizol,将组织打碎,装入1.5 ml EP管中;加入300 μl的氯仿,充分混匀,12 000 r/min,4℃离心15 min;抽取上层水样400 μl转移到清洁的EP管中,加入400 μl异丙醇,12 000 r/min,4℃离15 min,离心结束后缓慢将上清倒掉,留取沉淀物;使用预冷的75%酒精,清洗1次,然后7 000 r/min,离心5 min;使用无酶枪头,将75%酒精吸净,室温状态下静置5~7 min,使酒精充分挥发,剩余的沉淀加入25 μl RNase-free水进行溶解。
PCR扩增:PCR反应体系体积为50 μl,反应体系内容含有:反应缓冲液、Taq DNA聚合酶、dNTPs、上下游引物及逆转录反应产物cDNA等,其中上下游引物各1 μl,模板cDNA为3 μl。加样完成后振动混匀,瞬间离心后,置于PCR仪扩增。反应条件为:94℃变性20 s,55℃退火30 s,72℃延伸30 s,循环30 s,72℃延伸30 s。
扩增产物琼脂糖凝胶电泳:使用1%琼脂糖凝胶,用Gelstain染料和凝胶成像系统显色并采集图片。使用IPP图像分析软件进行半定量分析测定,测量条带灰度值,目的条带与GAPDH条带灰度值比值即为该目的基因的相对表达水平(相关引物见表1)。
1.2.5免疫印迹法检测Notch1和Jagged1的表达量 将所获取的大鼠膀胱组织从-80℃超低温冰箱中取出,然后将脑组织剪碎,按照100 mg/ml的比例加入裂解液,12 000 r/min低温离心15 min,然后凝胶电泳分离后,转移至 PVDF膜上。5% 脱脂奶粉 37℃ 封闭1.5 h,Ⅰ抗孵育,并在4℃环境下过夜,第二日Ⅱ抗孵育2 h。用ECL显色液进行曝光,使用Image J软件进行分析,以β-actin作为内参进行半定量分析。

2 结果
2.1BMSCs的形态学观察 原代BMSCs在48 h之内贴壁,以分散的克隆聚集方式增殖,细胞形态基本为均匀星形或梭形,核居中,偶有宽大扁平的多边形细胞。经过BMSCs纯化,其他非贴壁细胞,通过换液逐渐减少。2周后原代细胞95% 融合,进行传代。传代后细胞呈现漩涡状和放射状集落生长倾向,随着传代次数增加,细胞形态更为均一,为梭形成纤维细胞样(见图1)。
表1合成PCR引物序列
Tab.1SynthesisofPCRprimersequences
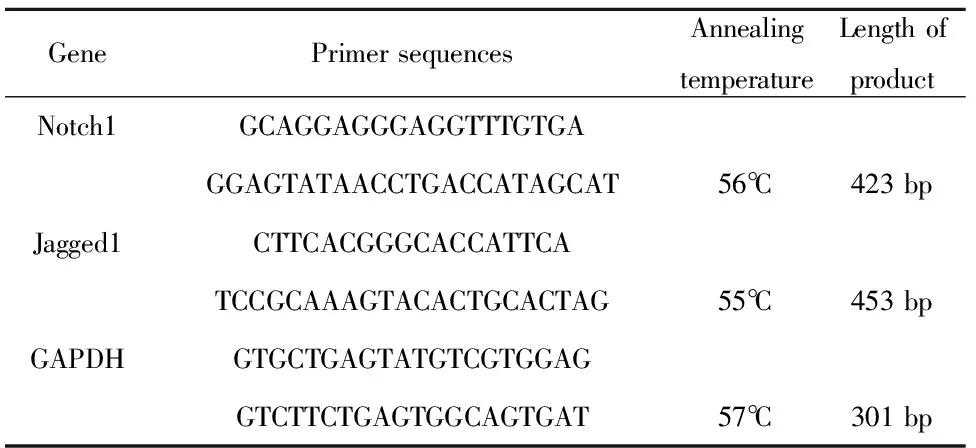
GenePrimer sequencesAnnealingtemperatureLength ofproductNotch1GCAGGAGGGAGGTTTGTGAGGAGTATAACCTGACCATAGCAT56℃423 bpJagged1CTTCACGGGCACCATTCATCCGCAAAGTACACTGCACTAG55℃453 bpGAPDHGTGCTGAGTATGTCGTGGAGGTCTTCTGAGTGGCAGTGAT57℃301 bp

图1 BMSCs的形态学观察(×100)

图2 大鼠膀胱形态学观察

图3 RT-PCR检测各组Notch1、Jagged1的表达
2.2大鼠膀胱形态学观察 模型组有15只大鼠膀胱可见明显肿物,其中11只大鼠膀胱肿瘤为菜花样,局部呈褐色,4只大鼠膀胱黏膜部分突起呈结节样,边界模糊,触之较硬,与直肠前壁有黏连情况发生,2只大鼠可见较小乳头状肿物,未形成肿瘤的2只大鼠可见局部黏膜变厚,6只大鼠并发膀胱结石。
表2RT-PCR检测Notch1和Jagged1在各组中的表达
Tab.2ExpressionofNotch1andJagged1ineachgroupdetectedbyRT-PCR

ControlModelDMSCs groupNotch10.433 2±0.0130.964 4±0.0180.717 9±0.0141)Jagged10.458 3±0.0120.988 7±0.0160.698 9±0.0131)
Note:Compared with model group,1)P<0.05.

图4 Western blot检测各组Notch 1、Jagged 1的表达
表3Westernblot检测Notch1和Jagged1在各组中的表达
Tab.3ExpressionofNotch1andJagged1ineachgroupdetectedbyWesternblot

ControlModelBMSCsNotch10.523 6±0.0161.789 6±0.0261.129 6±0.0221)Jagged10.657 8±0.0181.645 8±0.0231.068 5±0.0201)
Note:Compared with model group,1)P<0.05.
对照组的10只大鼠膀胱标本呈粉红色,有光泽,未见肿物(见图2)。
2.3Notch 1和Jagged 1的RT-PCR检测结果 RT-PCR检测结果显示,对照组中,Notch1和Jagged1基因仅有微量的基础表达。与对照组相比,模型组的表达明显增高,同模型组相比较,治疗组表达明显下降(P<0.05),但仍高于对照组(见图3,表2)。
2.4Notch1和Jagged1的Western blot检测结果 Western blot检测结果显示,在对照组中,Notch1和Jagged1蛋白仅有微量的基础表达,与对照组相比,模型组蛋白表达显著升高,与模型组相比,治疗组蛋白表达水平有所下调,但是仍高于对照组(见图4,表3)。
3 讨论
BMSCs是一种来源于骨髓的多功能细胞,拥有很强的自我更新以及多方向分化的能力,可以在内环境的作用下迁移到受损组织,对组织的结构以及功能进行修复[8,9];还具有较强的免疫调节功能,在进行异体移植时能够有效避免免疫排斥反应的发生[10]。所以,BMSCs在临床许多疾病的治疗中都发挥关键性作用。研究证实,BMSCs在治疗心脏、肝脏、肺、肾脏等器官损伤中发挥重要作用[11]。在脑损伤、肾性疾病等损伤模型中,BMSCs可以有效促进损伤的修复[12]。因此,本实验选用BMSCs对膀胱癌进行治疗性实验研究,探讨BMSCs在膀胱癌中的作用机制。
本研究采用经尿道膀胱灌注MNU的方法制备大鼠膀胱癌模型。因为MNU所引起的大鼠膀胱发生肿瘤的过程和人类病变的过程相类似,都是因尿中的化学物质刺激膀胱上皮进而引发的膀胱癌。所以,利用MNU制备的大鼠膀胱癌模型,能够更好地对膀胱癌的病因及其病理过程有所了解和掌握,为膀胱癌的预防及治疗提供更好的帮助。
在实验过程中模型组中有15只大鼠膀胱可见明显肿物,说明应用经尿道膀胱灌注MNU法构建的大鼠膀胱癌模型是成功的,有利于我们进一步实验的开展;RT-PCR结果显示,在对照组中,Notch1和Jagged1基因的表达都相对比较微弱,模型组的表达明显增高,而治疗组的表达相比模型组有所降低,但仍高于对照组的表达。说明因为癌症病变的出现,模型组的基因表达出现了增高,而治疗组表达降低,说明在一定程度上,BMSCs对于膀胱癌的治疗起到了积极作用;我们又通过Western blot检测相关蛋白的表达水平,实验结果显示,Notch1和Jagged1蛋白的表达,在对照组中,Notch1和Jagged1蛋白的表达都相对较弱,模型组的表达则明显增高,而治疗组的表达相比模型组有所降低,但仍高于对照组。这也能够说明, BMSCs参与了对膀胱癌的治疗,并达到了积极的效果。进一步证实了BMSCs的及时应用能够给治疗带来积极的作用。本研究能够充分表明,Notch1和Jagged1因子的表达直接反映了肿瘤的病变程度,BMSCs能够影响Notch1和Jagged1的表达,说明了BMSCs在膀胱癌的治疗中起到了积极的作用。
综上所述,本研究应用经尿道膀胱灌注MNU法成功构建了大鼠膀胱癌模型,并且利用BMSCs对大鼠膀胱癌进行干预治疗,初步证实了BMSCs对大鼠膀胱癌的治疗起到了一定的积极作用,为BMSCs的临床应用提供了有力的理论和实验依据。
