泡球蚴感染小鼠中Tim-3对Th1/Th2细胞因子平衡的影响作用研究①
2019-03-13张峰波朱玥洁庞楠楠安梦婷丁剑冰
张峰波 员 静 朱玥洁 庞楠楠 安梦婷 闫 芳 丁剑冰
(新疆医科大学基础医学院,乌鲁木齐830011)
棘球蚴病(echinococcosis) 是一种经消化道感染棘球绦虫的虫卵以及幼虫后导致的一种慢性寄生虫病[1-3]。泡球蚴(E.multilocularis)主要寄生在人体的肝脏,其对肝组织的损害主要是机械性挤压、毒素刺激反应以及对肝的直接侵蚀,对肝组织有严重的破坏性,且对肝组织的破坏范围广[4]。泡球蚴感染晚期可引起宿主肝衰竭、肝昏迷、门静脉高压并发消化道大出血甚至导致宿主死亡,对宿主危害极大[5]。E.multilocularis幼虫在肝内像肿瘤一样,以多泡性出芽方式浸润生长,感染者出现症状已是晚期,常常无法手术治疗,感染者病死率高达95%,因此泡球蚴病(Alveolar echinococcosis,AE)被认为是最致命的蠕虫感染之一,又被称为“虫癌”[6]。
泡球蚴在感染人或动物后,在宿主体内长期生存,造成一系列免疫应答改变[7,8]。这需要主动的对宿主免疫系统进行调节,以逃避不利于其生存的免疫应答反应[9,10]。泡球蚴和宿主之间能够互相识别对方的免疫调节信号。一方面宿主会针对泡球蚴释出的大量蛋白产生免疫应答,来限制泡球蚴的生长。另一方面泡球蚴也会通过一系列的调节机制来逃避宿主对其有效的免疫应答,使之既不被宿主免疫系统清除,又能让宿主的免疫病理反应降到最低的程度,在这些调节机制中免疫调节占据重要地位[11]。
Tim-3(T cell immunoglobulin and mucin domain containing molecule 3,Tim-3)是Tim家族激活诱导的抑制性受体,主要表达在分化成熟的Th1细胞上[12]。近期发现在血吸虫感染中,Tim-3高表达于Th1细胞,可导致Th1细胞凋亡,负性调节Th1/Th2细胞,导致血吸虫长期寄生于宿主[13,14]。近年来,研究人员同样发现,疟疾的慢性化也与Tim-3密切相关[15]。
本课题组前期研究发现,Tim-3在细粒棘球蚴感染患者中高表达[16,17],但是Tim-3在泡球蚴感染免疫中的作用还不是太清楚,在泡球蚴感染中尚未见相关报道。因此本研究建立了泡球蚴感染动物模型,检测Tim-3 与Th1、Th2相关细胞因子为泡球蚴感染后机体的免疫状态及相关机制研究提供一定的理论基础。
1 材料与方法
1.1材料
1.1.1实验动物 选取30只SPF级BALB/c小鼠,所有小鼠均为6周龄雌性小鼠、体重约(20±2)g,购于新疆医科大学动物中心,动物模型制作及饲养在新疆医科大学第一附属医院实验动物科学研究部。本研究所涉及的所有实验内容均已通过新疆医科大学第一附属医院伦理委员会审查(20160222-11)。
1.1.2试剂 流式抗体抗鼠CD3-PE-Cy7、抗鼠CD4-PE-Cy5和抗鼠Tim-3-PE抗体、淋巴细胞分离液购自Solarbio公司。RPMI1640培养液购自Thermo Fishers公司。CBA试剂盒购自BD公司。
1.2方法
1.2.1泡球蚴感染动物模型的建立 泡球蚴感染的长爪沙鼠感染90 d后,颈椎脱臼处死小鼠,用无菌镊子剪刀开腹,分离泡球蚴组织,将泡球蚴组织剪碎,经筛网研磨过滤,用生理盐水反复漂洗,直到洗液清亮,弃去上清取原头蚴沉淀物,加入含双抗的生理盐水,显微镜下计数,调整原头蚴悬液浓度至2 000个原头蚴/ml悬液,用于注射动物。实验组小鼠左下腹腔注射200 μl原头蚴悬液,对照组小鼠相同部位注射等量生理盐水,接种后普通饲养。
1.2.2脾脏淋巴细胞分离 在无菌培养皿中加入RPMI1640约4 ml,将小鼠脾脏取出后用研磨棒充分研磨,用200目滤网过滤混悬液并收集到15 ml的离心管中;另一15 ml的离心管中加入3~4 ml淋巴细胞分离液(Ficoll),将上一15 ml离心管中的脾细胞悬液缓慢叠加于Ficoll上;水平离心机室温离心,2 500 r/min,10 min;取出离心管观察分层,用移液器缓慢吸出中间呈现白色云雾状的淋巴细胞层(旋转吸取)至新15 ml试管中,然后用无菌PBS液或RPMI1640稀释至10 ml,将细胞悬起,洗涤,3 000 r/min,5 min,弃上清;加入1 ml PBS,重悬细胞后移至1.5 ml Ep管中;混匀后吸取2 μl细胞悬液加入98 μl PBS,计数仪计数,调整细胞浓度至1×107个/ml。
1.2.3流式细胞技术检测Tim-3的表达水平 取100 μl 细胞悬液放入流式管中,加入抗CD3-PE-Cy7、抗CD4-PE-Cy5和抗Tim-3-PE抗体各5 μl,4℃避光 20 min;然后,加入2 ml PBS洗涤,1 000 r/min,5 min,弃上清;加入400 μl PBS重悬细胞,上机检测。首先用前向角散射(Forward Scatter, FS)和侧向角散射(Side Scatter,SS)分选淋巴细胞,然后用SS和CD3-PE-Cy7分选T淋巴细胞,最后标记CD4-PE-Cy5和Tim-3-PE选出CD4+Tim-3+T细胞,加入破膜剂,室温下避光孵育15 min。加入Mouse-IFN-γ-APC抗体,Mouse-IL-4-FIFC抗体,并且设立Mouse-IgG-PE抗体作为同型对照管,用Flowjo软件分析数据。
1.2.4CBA试剂盒血清样本中细胞因子水平的检测 制备细胞因子标准品:将标准品小球移到15 ml离心管中,并标记该管为最高浓度标准品;用2 ml实验稀释液重悬标准品,重悬后的标准品溶液需室温下平衡15 min;取9根12×75 mm流式上样管,梯度稀释的倍数1∶2、1∶4、1∶8、1∶16、1∶32、1∶64、1∶128、1∶256;每管各加300 μl实验稀释液,从最高浓度标准品管取300 μl液体到1∶2 管吹打混匀,从1∶2 管取300 μl液体到1∶4管,依此类推,直到1∶256 管;仅可用枪吹打混匀,不可涡旋;混合捕获微球,充分涡旋混匀,每个实验管都加入50 μl;稀释样本,样本管中每管加入50 μl待测样本;标准品管中每管加入50 μl梯度稀释好的标准品;所有实验管中都加入50 μl人细胞因子PE检测试剂,室温避光孵育3 h;加入1 ml洗液,200 r/min离心5 min,小心吸去上清;加300 μl洗液,重悬微球,上机检测。
1.3统计学处理 实验数据采用SPSS17.0软件进行统计学处理,以均数P表示,采用独立样本t检验、单因素方差分析和相关性分析对实验数据进行比较分析,P<0.05表示差异有统计学意义。
2 结果
2.1泡球蚴感染小鼠血清IFN-γ和IL-4水平 为研究不同时期正常小鼠和泡球蚴感染小鼠血清IFN-γ水平的变化,本实验通过制备细胞因子标准品,检测小鼠样本IFN-γ的浓度。结果显示感染小鼠血清IFN-γ水平(9.81±2.17)pg/ml, 明显高于正常对照组(2.51±0.76)pg/ml,差异具有统计学意义(P<0.01)。

图1 各组血清中IFN-γ和IL-4水平及IFN-γ/IL-4比值

图2 各组小鼠脾细胞CD4+Tim-3+T细胞的水平
同样的方法检测泡球蚴感染小鼠血清中IL-4水平,正常对照组IL-4水平为(2.27±0.81)pg/ml,泡球蚴感染小鼠血清IL-4水平为(28.44±7.45)pg/ml。泡球蚴感染小鼠血清中IL-4水平高于对照组,差异具有统计学意义(P<0.01),见图1。
2.2FCM检测Tim-3在泡球蚴感染小鼠脾脏中表达 脾细胞悬液经匀浆,密度梯度法分离出单个核细胞,用FCM检测,先在FS、SS设门选出淋巴细胞,再以SS和CD3阳性设门选出T淋巴细胞,进一步选择CD4+Tim-3+T细胞,分析CD4+Tim-3+T细胞百分率。FCM结果显示:泡球蚴感染小鼠脾CD4+Tim-3+T细胞水平为(40.19±6.31)%,对照组为(2.52±0.77)%。泡球蚴感染小鼠脾CD4+Tim-3+T细胞水平明显高于对照组,差异具有统计学意义,见图2。泡球蚴感染小鼠脾中Th1细胞Tim-3的表达水平高于正常对照组,差异具有统计学意义,与正常对照组相比,泡球蚴感染小鼠脾中Th2细胞Tim-3的表达水平差异无统计学意义,见图3。

图3 各组小鼠脾细胞Tim-3+Th1、Tim-3+Th2细胞的水平
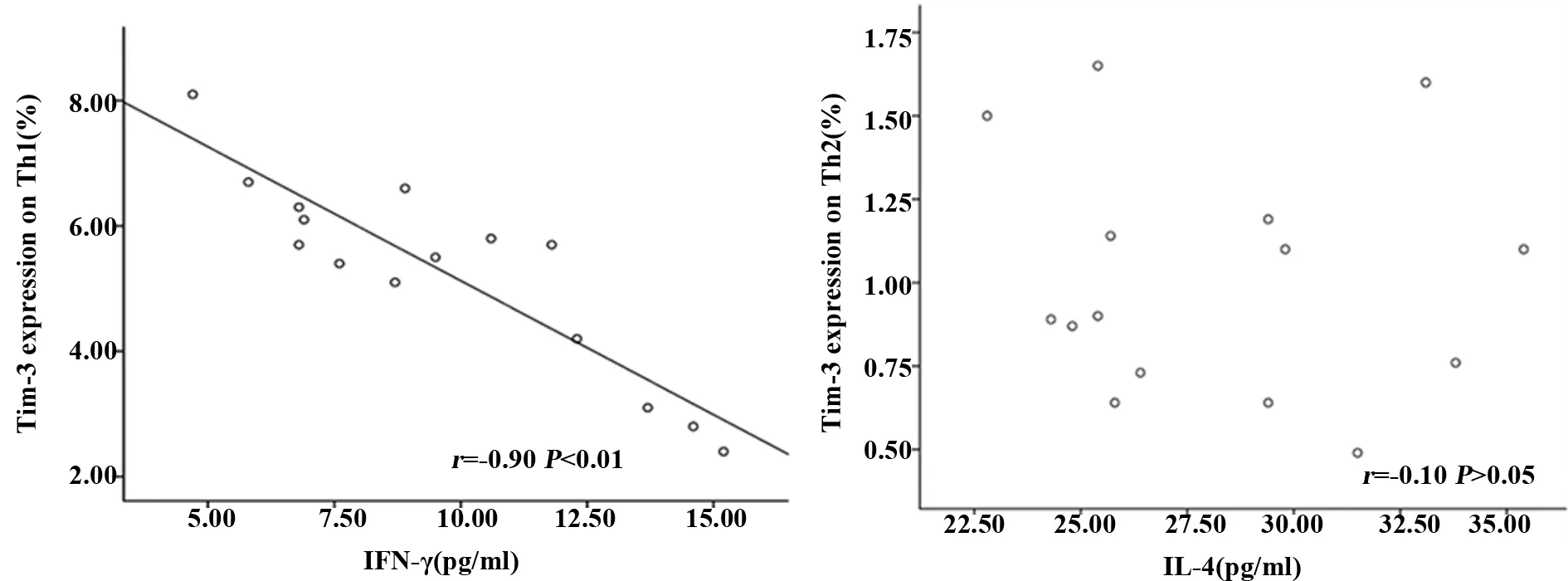
图4 Th1和Th2细胞上表达Tim-3在与IFN-γ和IL-4相关性分析
2.3泡球蚴感染小鼠脾脏Tim-3对Th1和Th2细胞功能的影响 为了发现Th1和Th2细胞上Tim-3对Th1和Th2细胞功能的关系,本研究进一步对Th1和Th2细胞上Tim-3与IFN-γ、IL-4进行了相关分析。研究发现,Th1细胞上Tim-3与IL-4呈负相关,而Th2细胞上Tim-3表达量极低,并且与IL-4不相关。见图5。
3 讨论
泡球蚴在宿主体内的发育、繁殖和长期生存均有赖于有效的免疫逃避机制[18]。本研究发现泡球蚴感染小鼠IL-4水平明显增加。泡球蚴感染小鼠脾脏淋巴细胞Tim-3水平明显增高,并与IFN-γ呈现负相关,与IL-4成正相关。
泡球蚴感染小鼠IL-4水平明显增加,IFN-γ轻度增加。IL-4对于B细胞、T细胞、肥大细胞、巨噬细胞和造血细胞都有免疫调节作用[19]。IL-4是T细胞自身分泌的生长因子,如HT-2细胞系是一种IL-2依赖细胞系,IL-4可单独维持Th2细胞的增殖,同时伴有CTL、NK和LAK功能的降低。可抑制IFN-γ mRNA的转录和抑制IFN-γ诱导B细胞产生IgG2a[20]。本研究发现泡球蚴感染小鼠IFN-γ/IL-4下降,表明泡球蚴感染导致了Th1/Th2免疫平衡的改变,而Th1/Th2平衡改变可能与泡球蚴的免疫逃避有关。
泡球蚴感染小鼠脾脏淋巴细胞Tim-3水平明显增高。最近在MS患者的研究中发现[21],通过体外实验用Tim-3 siRNA来降低CD4+T细胞Tim-3的表达,可以促使IFN-γ产生,表明Tim-3的表达可以下调IFN-γ的水平,证实了人Th细胞Tim-3的表达可以调控IFN-γ的分泌。近年来一些寄生虫感染的研究发现Tim-3/Galectin-9参与其中的免疫调控。血吸虫感染的小鼠中检测到大量的Tim-3+T细胞,且Tim-3+T细胞的数量与疟原虫在宿主体内的虫荷呈正相关。随着体内寄生虫的清除,Tim-3+T细胞的数量出现相应减少,提示Tim-3在血吸虫感染引起的宿主病理改变中有很重要的作用。为了探讨Tim-3蛋白是否与泡球蚴病发病相关,本研究检测了Tim-3蛋白在正常小鼠和泡球蚴感染小鼠脾脏淋巴细胞的表达,发现泡球蚴感染组Tim-3表达水平明显增高,提示Tim-3在泡球蚴感染的发生发展中起着至关重要的作用。
为了探讨Tim-3 与Th1和Th2的关系,本研究检测了Th1和Th2细胞表面Tim-3的表达,同时检测小鼠外周血IFN-γ和IL-4水平,同时进行了Th1、Th2细胞表面Tim-3表达分别与IFN-γ和IL-4的Pearson相关分析。开展Th1和Th2细胞表面Tim-3的表达与相关细胞因子分析,发现Th1上Tim-3表达与IFN-γ具有更好的负性相关性,而Th2细胞表面Tim-3与IL-4不相关。据此推测,在泡球蚴感染过程中,Tim-3可能参与了Th1/Th2平衡改变,这种平衡的改变可能是通过下调Th1免疫应答,影响Th1/Th2免疫应答平衡,抑制免疫应答,促使泡球蚴的免疫逃避。
综上所述,本研究发现泡球蚴感染小鼠脾脏淋巴细胞Tim-3以及外周血IL-4水平增高,IFN-γ增高不明显,可能是Tim-3参与Th1/Th2免疫失衡,促进了泡球蚴感染的发展,有效地控制Tim-3的水平可能成为治疗泡球蚴感染的一个新靶点。
