非小细胞肺癌组织中抑癌基因RUNX3启动子甲基化与肿瘤侵袭相关基因E-Cad、MMP-7和TIMP-1蛋白表达的关系①
2019-03-13张乐
张 乐
(承德医学院附属医院胸外科,承德067000)
非小细胞肺癌(Non-small cell lung cancer,NSCLC)占肺癌发生的85%[1,2],发病率和死亡率逐年增加,给患者家庭和社会带来了沉重的负担。尽管伴随着小分子靶向治疗药物的问世,耐药现象的出现[3,4],NSCLC患者的五年生存率未得到明显的提高,因此对NSCLC发生发展机制的探索迫在眉睫。既往研究表明[5,6],有些抑癌基因因自身CpG岛甲基化而被沉默进而诱发肿瘤的发生,因此对于该抑癌基因甲基化的测定对肿瘤的临床诊疗尤为关键。人类Runt相关转录因子3(Human Runt relationed transcription factor 3,RUNX3)是近年来被确定的一个抑癌基因[7]。新近研究报道称[7-10],RUNX3基因启动子在肺癌、结直肠腺癌、胃癌及乳腺癌等组织中甲基化水平明显增加,进而导致RUNX3基因沉默而失去活性,在肿瘤的发生发展过程中扮演者重要的角色。本研究拟采用巢氏甲基化特异性PCR(nMSP)法检测RUNX3启动子甲基化情况;链霉菌素-生物素过氧化物酶(S-P)染色法检测肿瘤侵袭相关基因E-Cad、MMP-7和TIMP-1蛋白表达并计数,并回顾性分析RUNX3启动子甲基化状态与临床病理特征、肿瘤侵袭相关基因表达的关系。
1 资料与方法
1.1资料
1.1.1临床资料 以我院2017年1月至2018年1月期间收治入院的65例非小细胞肺癌患为研究对象,采集病理组织样本和临床资料。其中,男性患者44例,女性患者21例,年龄41~75岁,平均年龄58.2岁。所有组织标本均以病理学诊断为金标准,其中鳞癌26例,腺癌39例,均未进行放化疗。临床分期结果显示,Ⅰ期6例,Ⅱ期7例,Ⅲ期23例,Ⅳ期29例。所有实验均在我院伦理委员会审核后进行。
1.1.2试剂及引物 DNA纯化试剂盒购于美国Promrga公司,EZ DNA甲基化试剂盒(EZ DNA methylation-gold kitTM)购于美国Zymo Research 生物科技公司,CpG甲基化酶购于美国NEB公司,2×Tag PCR MasterMix 购买于北京天根生化科技公司,RUNX3用于nMSP的引物由Invitrogen公司合成,3对引物序列如表1所示。兔抗人E-Cad、MMP-7和TIMP-1蛋白单克隆抗体,S-P免疫组织化学染色试剂盒均购买于美国SantaCruz生物科技公司。
1.2方法
1.2.1组织总DNA提取和nMSP 将组织标本未解冻时迅速用眼科剪剪碎,然后研磨碎,按照DNA纯化试剂盒说明提取组织DNA。由于普通MSP提取甲醛固定石蜡包埋后的肿瘤组织的DNA量太少,因此采用nMSP方法以扩增出清晰的目的基因条带。nMSP操作步骤严格按照试剂盒说明书要求执行。
表1nMSP引物序列
Tab.1SequenceofnMSPprimer

PrimerSequenceFragment size(bp)Peripheral primers5′-ATTTTTTAGAATTAAGTGG-3′2335′-AACCCTAAACTATAACACTAAA-3′M primer5′-GCGTCGTATAGTTAATCGGC-3′1235′-CTCCTCCGCGAAATAACG-3′U primer5′-GTGTTGTATAGTTAATTGGT-3′1235′-CTCCTCCACAAAATAACA-3′
1.2.2S-P染色法 S-P染色主要步骤如下:①切片经二甲苯脱去包裹的蜡并进行梯度乙醇水化;②3%双氧水常温封闭15 min;③ddH2O冲洗,磷酸缓冲液(PBS,pH 7.2~7.4)振动洗涤3次,每次5 min;④滴加0.5%胰蛋白酶消化20 min,并用PBS振动洗涤3次,每次5 min;⑤滴加孵育用胎牛血清,室温封闭30 min,缓慢引出封闭液,勿洗,滴加相应的兔抗人E-Cad、MMP-7和TIMP-1蛋白单克隆抗体,4℃过夜后并用PBS振动洗涤3次,每次5 min;⑥滴加通用型生物素标记的羊抗兔IgG,室温孵育30 min后PBS振动洗涤3次,每次5 min;⑦DAB显色2~5 min,蒸馏水冲洗后苏木素复染1 min;⑧自来水充分冲洗,蒸馏水一过性洗涤,梯度酒精常规脱水后二甲苯透明;⑨中性树胶封片,并以PBS作为一抗设置为阴性对照组。
1.2.3细胞计数 在相同拍照条件下使用光镜摄片,观察免疫组织化学染色结果。采用Image J软件对阳性细胞进行计数。阳性细胞数<10%记为阴性(-),10~25%为弱阳性(+),26~50为中度阳性(++),≥51为强阳性(+++)。
1.3统计学分析 采用SPSS16.0主程序进行数据分析,计数资料以%表示,采用χ2检验,P<0.05表示差异具有统计学意义。
2 结果
2.1NSCLC组织RUNX3基因启动子区甲基化与临床病理特征的关系 65例NSCLC患者中有27例NSCLC组织RUNX3基因启动子区CpG岛出现异常的过度甲基化,检出率为41.54%。并且NSCLC组织RUNX3基因启动子区CpG岛异常甲基化与病理类型有关,腺癌(81.48%)高于鳞癌(18.52%,P=0.003);且与临床分期也有关(P=0.03),主要分布于Ⅲ期(55.56%)和Ⅳ期(33.33%)。其余临床病例特征差异均未见统计学意义(P>0.05,见表2)。RUNX3启动子甲基化状态电泳图如图1所示。
2.2RUNX3基因启动子区甲基化与E-Cad蛋白表达的关系 E-Cad蛋白的阳性表达率为56.92%(见表3)。RUNX3基因启动子区甲基化组E-Cad蛋白的阳性表达率为39.47%,RUNX3基因启动子区未甲基化组E-Cad蛋白的阳性表达率为81.48%,差异有显著统计学意义(P<0.05,见表4)。
2.3RUNX3基因启动子区甲基化与MMP7蛋白表达的关系 MMP7蛋白的阳性表达率为46.15%(见表5)。RUNX3基因启动子区甲基化组MMP7蛋白的阳性表达率为55.26%,RUNX3基因启动子区未甲基化组MMP7蛋白的阳性表达率为33.33%,差异有显著统计学意义(P<0.05,见表6)。
表2RUNX3基因启动子甲基化状态与NSCLC患者临床病理特征的关系
Tab.2RelationshipbetweenmethylationstatusofRUNX3geneandclinic-pathologicalfeaturesinNSCLCpatients
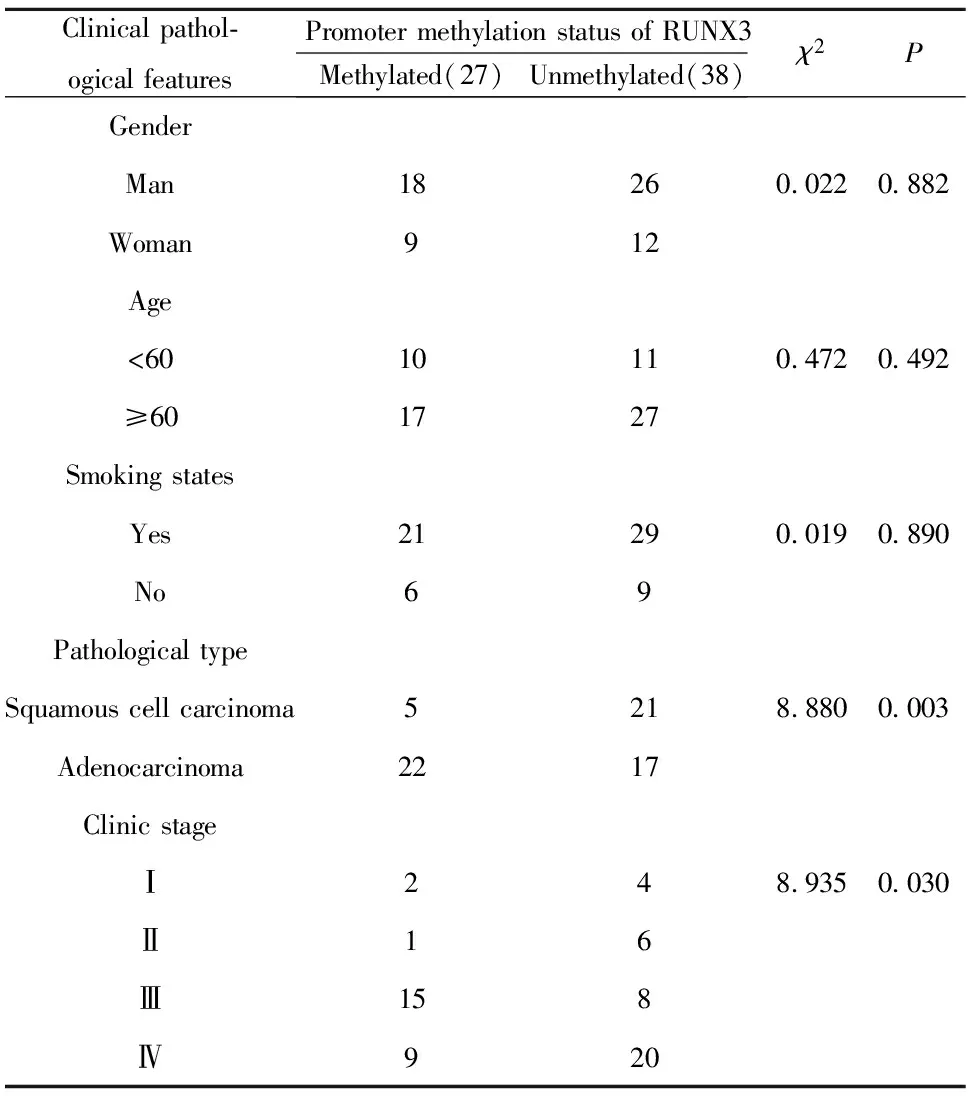
Clinical pathol-ogical featuresPromoter methylation status of RUNX3Methylated(27)Unmethylated(38)χ2PGenderMan18260.0220.882Woman912Age<6010110.4720.492≥601727Smoking statesYes21290.0190.890No69Pathological typeSquamous cell carcinoma5218.8800.003Adenocarcinoma2217Clinic stageⅠ248.9350.030Ⅱ16Ⅲ158Ⅳ920

图1 RUNX3启动子甲基化状态电泳图
2.4RUNX3基因启动子区甲基化与TIMP1蛋白表达的关系 TIMP1蛋白的阳性表达率为52.31%(见表7)。RUNX3基因启动子区甲基化组TIMP1蛋白的阳性表达率为34.21%,RUNX3基因启动子区为甲基化组TIMP1蛋白的阳性表达率为77.78%,差异具有显著统计学意义(P<0.05,见表8)。
表3E-Cad蛋白在NSCLC组织中的表达情况
Tab.3ExpressionlevelofE-CadproteinintissueofNSCLC

nE-Cad protein expression-++++++PositivenPositive rate(%)NSCLC65281113133756.92
表4RUNX3基因启动子甲基化状态与E-Cad蛋白表达的关系
Tab.4RelationshipbetweenmethylationstatusofRUNX3genepromoterandexpressionofE-Cad
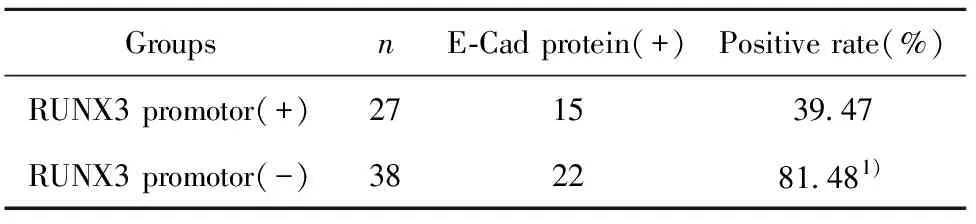
Groups nE-Cad protein(+)Positive rate(%)RUNX3 promotor(+)271539.47RUNX3 promotor(-)382281.481)
Note:1)P<0.05,vs RUNX3 promoter(+) group.
表5MMP7蛋白在NSCLC组织中的表达情况
Tab.5TheexpressionlevelofMMP7proteinintissueofNSCLC

nMMP7 protein expression-++++++positivenPositive rate(%)NSCLC6535511143046.15
表6RUNX3基因启动子甲基化状态与MMP7蛋白表达的关系
Tab.6RelationshipbetweenmethylationstatusofRUNX3genepromoterandexpressionofMMP7
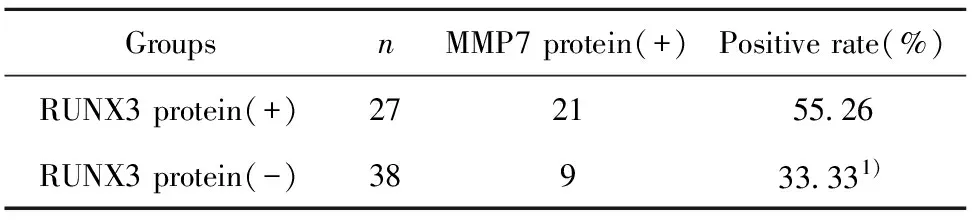
GroupsnMMP7 protein(+)Positive rate(%)RUNX3 protein(+)272155.26RUNX3 protein(-)38933.331)
Note:1)P<0.05,vs RUNX3 protein(+) group.
表7TIMP1蛋白在NSCLC组织中的表达情况
Tab.7ExpressionlevelofTIMP1proteinintissueofNSCLC

nTIMP1 protein expression-++++++PositivenPositive rate(%)NSCLC6531810163452.31
表8RUNX3基因启动子甲基化状态与TIMP1蛋白表达的关系
Tab.8RelationshipbetweenmethylationstatusofRUNX3genepromoterandexpressionofTIMP1
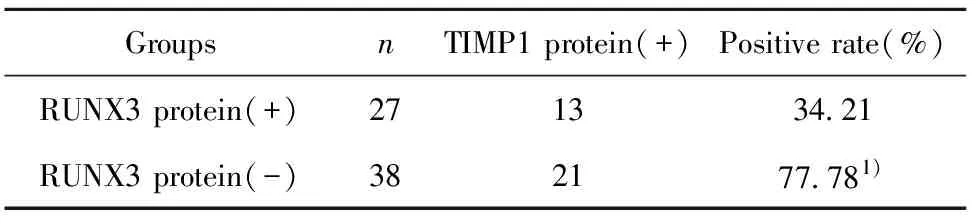
Groups nTIMP1 protein(+)Positive rate(%)RUNX3 protein(+)271334.21RUNX3 protein(-)382177.781)
Note:1)P<0.05,vs RUNX3 protein(+) group.
3 讨论
浸润和转移是肿瘤细胞重要的生物学特征及行为,也是引起肿瘤高死亡率的主要原因[11]。本研究主要分析了65例NSCLC组织中抑癌基因RUNX3启动子CpG岛区域甲基化状态与患者临床病理特征的关系,并在此基础上,通过免疫组织化学染色进一步分析了RUNX3启动子CpG岛区域甲基化与肿瘤侵袭相关基因E-Cad、MMP-7和TIMP-1蛋白表达之间的关系。研究结果表明,NSCLC组织RUNX3基因启动子区CpG岛异常甲基化与病理类型有关,且腺癌(81.48%)高于鳞癌(18.52%,P=0.003),这与临床上NSCLC中腺癌患者多于鳞癌患者的分布比例较为一致,与之前的报道结果相似[12];并且NSCLC组织RUNX3基因启动子区CpG岛异常甲基化与临床分期也有关(P=0.03),而且主要分布于Ⅲ期(55.56%)和Ⅳ期(33.33%),这与以往的报道结果较为相符[13]。
既往研究表明,肿瘤细胞可以脱离原发灶,黏附于细胞外基质,通过降解基质实现他处侵袭和转移[14,15]。因此,细胞间黏附作用的破坏有利于肿瘤细胞实现侵袭和转移。研究结果显示,上皮钙黏附(E-Cad)蛋白的阳性表达率为56.92%(见表3)。RUNX3基因启动子区甲基化组E-Cad蛋白的阳性表达率为39.47%,RUNX3基因启动子区未甲基化组E-Cad蛋白的阳性表达率为81.48%,差异具有显著统计学意义,提示RUNX3基因启动子区甲基化后,抑癌基因RUNX3沉默,E-Cad的表达也会降低,因此RUNX3基因可能促进E-Cad的表达,增强肿瘤细胞与细胞的黏附性,从而防止肿瘤细胞从癌巢扩散。
亦有研究表明,基质金属蛋白酶7(MMP7)是其家族最小的分子,可以降解细胞外间质,为肿瘤的侵袭和转移提供合适的路径[16,17]。新近研究表明,MMP7在多种肿瘤细胞中过度表达。我们的研究结果显示,MMP7蛋白的阳性表达率为46.15%(见表5)。RUNX3基因启动子区甲基化组MMP7蛋白的阳性表达率为55.26%,RUNX3基因启动子区未甲基化组MMP7蛋白的阳性表达率为33.33%,差异有显著统计学意义。提示MMP7与肿瘤的浸润转移密切相关,这与既往报道较为一致[18,19]。
TIMP1基因表达的蛋白是一种MMPs的天然抑制剂,已有报道称,给予TIMP1蛋白可以显著减少肿瘤高表达的MMPs对细胞外基质的降解[20,21]。因此,TIMP1也成为肿瘤治疗的热点分子。本研究结果显示NSCLC组织中TIMP1蛋白的阳性表达率为52.31%(见表7)。RUNX3基因启动子区甲基化组TIMP1蛋白的阳性表达率为34.21%,RUNX3基因启动子区为甲基化组TIMP1蛋白的阳性表达率为77.78%,差异有显著统计学意义。进一步说明RUNX3基因启动子区甲基化可以抑制TIMP1蛋白的表达,进而促进肿瘤的侵袭和转移。
综上所述,在NSCLC组织中,首先RUNX3基因启动子区甲基化在鳞癌的发生率高于腺癌,并且集中与临床分期中的Ⅲ、Ⅳ期。其次,RUNX3基因启动子区甲基化可以抑制E-Cad的表达,降低肿瘤细胞与细胞的黏附性,从而促进肿瘤细胞从癌巢扩散;并且,MMP7的表达会进一步加速肿瘤细胞外基质的降解,TIMP1表达降低,MMP7亦会表达增加,更加促进了肿瘤细胞的侵袭和转移。因此,临床上监测RUNX3基因启动子区甲基化的程度有望为NSCLC患者的诊疗带来福音。
