药品分析方法转移类型与程序
2019-03-10孙一平刘戈李春刚
孙一平 刘戈 李春刚

摘 要 本文从分析方法转移与方法验证和确认的概念着手,介绍其区别与不同适用范围。着重论述分析方法转移的方式和程序,并探讨了分析方法转移中的实验设计与接收标准。
关键词 分析方法转移类型 对比试验 分析方法转移程序 实验设计 接收标准
中图分类号:R917 文献标志码:C 文章编号:1006-1533(2019)03-0074-04
Types and procedures of the transfer of drug analytical methods
SUN Yiping1*, LIU Ge1, LI Chungang2**(1. Shanghai Shyndec Pharmaceutical Co., Ltd., Shanghai 200137, China; 2. Shanghai Shyndec Pharmaceutical(Haimen) Co., Ltd., Jiangsu Haimen 226133, China )
ABSTRACT This article started with the concept of transfer, validation and confirmation of analytical methods and introduced its differences and different scopes of application. Meanwhile, the methods and procedures for the transfer of analytical methods were focused on and the experimental design and acceptance criteria in the transfer of analytical methods were also explored.
KEy WORDS types of transfer of analytical methods; comparative test; transfer of analytical method; experimental design; acceptance criteria
当一个实验室建立了分析方法并经过验证后,当其方法接收实验室在使用这个方法进行检验检测时,就涉及到方法在两个不同实验室之间的转移问题:确认接收实验室有能力运用该方法,其检验结果与方法建立实验室一致。作为产品转移的一个部分,包括所有如成品、起始物料、包装材料和清洁验证样品等的检验方法的有关分析测试要求要符合其预先设定的质量标准。
自建分析方法由公司的研发实验室转移到质控实验室,是常见的分析方法转移情况。此种情况又常常与分析方法验证、确认的概念相混淆,并且做法不尽一致。
分析方法验证的建立者必须要证明所建立的方法能够满足期望的检测用途,并遵循分析方法指导原则中要求的验证参数,证明所建立的方法能够满足期望的检测,最终形成一个产品质量控制方法。方法确认必须是对药典或者法定分析方法进行确认,证明药典或法定分析方法适用于被测样品,证明方法使用人员有能力成功地操作药典分析方法或者法定分析方法[1-2]。方法转移则侧重于考察接收方实验室的检测能力。本文着重论述分析方法转移的主要类型与程序。
1 分析方法转移的类型
1.1 对比实验
对于公司内部进行实施分析方法转移,通常进行对比实验,常用做法有:转出方与接收方按照既定的方案对同一批次的样品进行检验;方案中规定的程序的具体细节,使用的样品,和预先规定的标准,包括可接受的变异性;检验结果符合标准规定,并且将转出方和接收方所得的结果进行比较,可以保证双方都能进行检验,能力相当[3-4]。
1.2 共同验证和再验证
生产企业可让接收方参与共同验证工作,接收方作为验证小组的成员,需要进行重现性的评估并获得相关数据。分析和评估如不同仪器、不同检验人员、不同经验和检验能力实验人员等的检验情况。
进行再验证即接收实验室重复部分或所有的方法学验证试验,虽然对于接收方方法使用更为稳妥,但是这种方法较为耗费时间,有时可能造成重复劳动,资源浪费。
1.3 免除试验
接收方已经检验过这个样品或者类似样品;新产品的活性成分与已掌握检验方法类似或为通用的检验方法;接收方检验人员与转出方检验人员的技术水平相当;负责方法开发、验证或产品日常检验的人员由转出方调到接收方,故而可以免除正式的方法转移程序,但是需要有充分说明[2]。
2 分析方法转移程序
方法开发者应制定方法转移的程序,明确方法转移的职责和技术要求,使用的仪器、试剂及分析方法、试验的设计和转移中使用的检验方法的可接受的标准等。并对于方法转移方案的起草、审核、批准、实施、报告以及验证文件的管理明确具体的规定。
2.1 分析方法转移方案
2.1.1 方案内容
在方法转移方案批准前可执行预验证,通过预验证检查整个方案的可执行性。如果预验证显示方案的执行不符合预期的要求,需要查找原因,必要时适当调整方案。预验证的过程应完整地进行记录并存档。
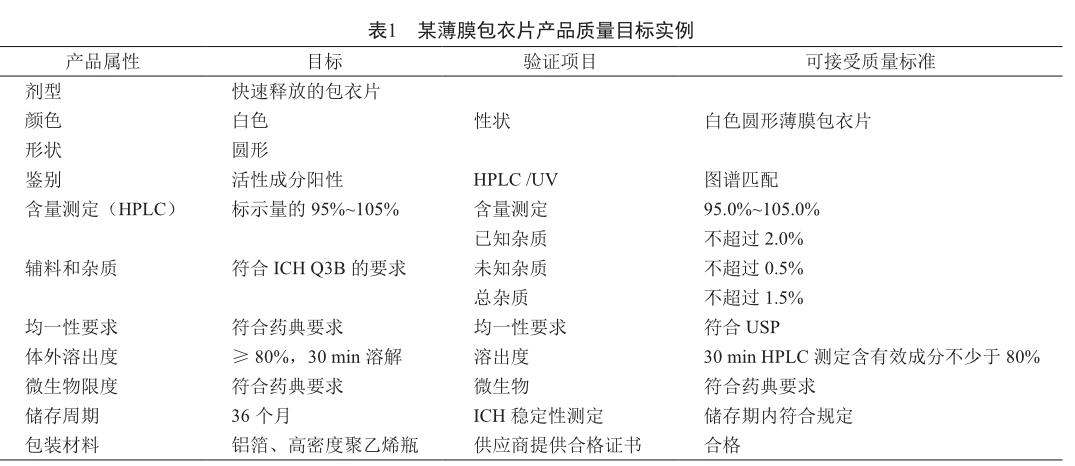
方法轉移必须遵循经过批准的方案。转移方案必须至少包括下列信息[5-7]: ①方法的名称、方法描述、方法使用目的和范围; ②需要验证的项目以及接受质量标准,以某薄膜包衣片为例,说明产品质量目标与验证项目的关系与实现方式(表1);③物料、试验样品(批号、计量、产品号、储存条件)和标准品(批号、储存条件、含量、有效期等);④验证实验中用到的仪器设备、标准品和测试样品的可接受标准;⑤实验结果的评估,异常数据的调查;⑥方案起草和审批流程。

2.1.2 实验设计与接受标准
1)鉴别 鉴别实验方法种类多样,无论是HPLC/ GC的相对保留时间、红外光谱、紫外光谱还是化学法滴定与显色反应,一次检测即可证明双方等价性。
2)含量 双方实验室至少两名分析员对3批物料的3份样品进行不同分析仪器独立配制供试品溶液进行测试,测试体系必须满足系统适用性要求。一共获得18组检测数据。检验接收标准要根据平均值与误差分析设定。两实验室检验结果均满足质量标准。单边t检验于95%置信度下场内差异≤2%。
3)含量均匀度 如果含量均一度的检测方法与含量相同,则不需要单独的含量方法转移。如果二者不同,则分别进行方法转移。建议至少每个实验室两名分析员测试一个样品批号的含量均匀度,每名实验员需使用不同仪器独立配制供试品溶液,测试体系必须满足系统适用性要求。接收标准可以规定两实验室检验结果单边t检验分析95%置信度,场内差异≤3%或者接收方实验室检验平均值在转出方±3%内。每个实验室的相对标准偏差应当在可接受范围内。
4)杂质/降解产物/残留溶剂 建议双方实验室至少两名分析员对3批物料2份样品在不同日期使用不同仪器进行测试。需满足分析方法要求的系统适用性要求,接收实验室的定量限要与转出方相一致;双方杂质谱应当相同(相对保留时间;报告限以上已知和未知杂质的响应值)。值得注意的是双方实验室进行测试的样品应当具有批内的代表性:包括样品是否均一、包装与储存条件是否一致、在预定时间内得到检验等。接受标准应当根据杂质检出量的差异设定:较大杂质两实验室检验结果单边t检验分析95%置信度,差异≤10%;报告限左右杂质两实验室检验结果平均值相差不超過±0.05%。
5)溶出度 对于速释制剂需测定6个单元;对于缓控释制剂,接收方建议测试12个单元。溶出度结果应当满足质量标准要求。双方实验室应当比较二者释放行为:例如f2因子与释放量(Q)比较。接收方实验室检验平均数值在转出方±5%内。
6)清洁验证 转出方与接收方使用相同的擦拭材料,加样回收率应当在90%~110%范围内。
7)微生物 转出方与接收方应进行微生物试验转移时应当使用相同的方法与试剂。试验中各种试验菌的回收率应当符合转移方案中规定。建议每个实验室使用不同批号进行三次实验[6]。在样品中接种一定数量的试验菌(接种量应在定量限以上),采用药典方法和替代方法,分别由不同人员、在不同时间、使用不同的试剂(或仪器)进行检验,对检验结果进行统计分析,以相对标准偏差(RSD)来评价两种方法的重现性差异。
原料药与制剂需要转移的实验项目见表2。
2.2 转移方案的执行
转移的执行必须符合下列要求:①执行验证/确认工作的分析人员必须具有资质并且得到了适当的培训;②测试进行前分析仪器必须完成确认和校准并在有效期内;③必须按照批准的转移方案进行测试,系统适用性试验必须符合标准(如果适用);④对照品、样品和试剂耗材的来源和质量符合要求并在有效期内。
在转移试验中的任何测试失败、过程中的偏差或异常都应该进行纪录和评估并找到原因,任何的重新测试必须得到质量部门的批准。
2.3 转移报告
在转移工作完成后,接收实验室人员应当及时汇总分析获得的数据和结果,起草验证报告并应经过管理部门的批准。转移报告必须包括以下信息:①方法的名称、描述、目的以及使用范围;②转移实验中用到的仪器设备、标准品和测试样品的信息;③转移实验数据以及结果评估应考虑的关键方面包括接收部门产生的数据是否符合目的、接收部门的分析方法操作是否建立在多批之上并可靠、接收部门的分析方法操作是否有效等;④偏差的总结;⑤包含有转移是否成功的正式声明的结论;⑥转移原始数据及附件;⑦报告起草和审批流程。
2.4 方法转移文件的保存
转移验证的方案、原始记录、相关的元数据和转移报告应遵守优良数据和记录管理规范原则应该进行存档管理并长期保存,具有良好的完整和可追溯性。
3 总结
药品分析方法验证、转移和确认有相互联系,做法又不尽相同。本文从概念与分类入手,进而着重介绍了分析方法转移的类型与程序,并对实验设计与接受标准进行了详细论述。希望对具体实际工作有所借鉴。
参考文献
[1] 许明哲, 黄宝斌, 杨青云, 等. 分析方法验证、转移和确认概念解析[J]. 药物分析杂志, 2015, 35(1): 169-175.
[2] 许明哲, 黄宝斌, 杨青云, 等. 分析方法转移内容介绍[J].药物分析杂志, 2015, 35(1): 176-182.
[3] USP36-NF31[M/OL]. [2018-05-07]. https://max.book118. com/html/2017/0826/130224027.shtm.
[4] Quattrocchi O, Martin G, Runser D, et al. Transfer of analytical procedures: a proposal for a new general information chapter[EB/OL]. [2018-05-25]. https://www. researchgate.net/publication/253451431_Transfer_of_ Analytical_Procedures_A_Proposal_for_a_New_General_ Information_Chapter.
[5] 国家食品药品监督管理局药品认证管理中心. 药品GMP实施指南——质量控制实验室与物料系统[M]. 北京: 中国医药科技出版社, 2011: 143-145.
[6] ISPE. ISPE Good Practice Guide — Technology Transfer[M]. Belgium: ISPE Headquarters, 2003: 23-34.
[7] PDA Technical Report No. 65 (TR 65), Technology Transfer[EB/OL]. [2018-05-07]. https://wenku.baidu.com/ view/f6af6b26b0717fd5360cdcdc.html.
