紫铆花素对黑色素瘤细胞与角质形成细胞共培养体系中黑色素合成的影响*
2019-03-06高莉霍仕霞谭雪彭晓明闫明
高莉,霍仕霞,谭雪,彭晓明,闫明
(新疆维吾尔自治区维吾尔医药研究所,新疆维吾尔医方剂学重点实验室,乌鲁木齐 830049)
驱虫斑鸠菊(VernoniaanthelminticaWilld.)是维吾尔医治疗白癜风方剂中最常采用的药材,维吾尔医认为驱虫斑鸠菊可以通过清除患者体内过盛黏液质,促进色素沉着,恢复皮肤颜色,从而治疗白癜风[1]。有研究表明[2-4],紫铆花素是驱虫斑鸠菊的主要有效成分之一,对体外培养的黑色素瘤细胞的黑色素合成和黑色素合成相关的酪氨酸酶(tyrosinase,TYR)活性有调节作用,提示其可能对白癜风等色素性疾病具有一定应用开发前景。然而,人体内黑色素合成是一个极为复杂的过程,它由黑色素细胞内合成,通过黑色素细胞树枝状突起被传递到邻近角质形成细胞内,并随角质形成细胞向表皮上层移动,从而影响皮肤颜色[5-6]。因此,笔者在文献[4]基础上,采用A375细胞和Hacat细胞共培养体系进一步考察紫铆花素对黑色素合成功能的作用,以期深入研究紫铆花素治疗白癜风的机制。
1 材料与方法
1.1实验细胞 人黑色素瘤细胞A375,中国科学院上海细胞库提供;人永生化角质形成细胞HaCaT,武汉大学细胞库提供。
1.2药品与试剂 紫铆花素(新疆维吾尔自治区维吾尔医药研究所自制,批号:20151208,含量≥95%);Dulbecco’s Modified Eagle’s Medium-High glucose(DMEM)干粉培养基(美国Gibco公司,批号:1645780);胎牛血清(美国HycLone公司,批号:NZJ1221);噻唑蓝(thiazolyl blue tetrazolium bromide,MTT,美国Amresco公司,批号:YY11351);左旋多巴(L-DOPA,美国Sigma公司,批号:LC0922B5011J); Trizol(Invitrogen,批号:149101);M-MLV First Strand Kit(Invitrogen,批号:8212007);SYBR Green qPCR SuperMix(Invitrogen,批号:8212113);TYR1 F:GCTTTCCTGTCCTACCC,R:GCTTTCCTGTCCTACCC;β-actin F:CCTAGACTTCGAGCAAGAGA,R:GGAAGGAAGGCTGGAAGA;常规生化试剂购自天津市永大化学试剂有限公司。
1.3实验仪器 电子分析天平(德国Sartorius公司,型号:SQP,感量:0.01 mg);生物安全柜(上海苏净公司,型号:YJ-875);倒置显微镜(上海光学六厂,型号:37XB);二氧化碳(CO2)培养箱(日本Sanyo公司,型号:MCO-18AIC);生化培养箱(上海博远实业有限公司,型号:SPX-150B-Z);酶标仪(德国Thermo公司,型号:Go 1510);荧光定量PCR仪(Bio-Rad 公司,型号:CFX96)。
1.4方法
1.4.1紫铆花素母液的配制 精密称取紫铆花素样品0.1 g,以二甲亚砜(DMSO)溶解,配制成100 g·L-1母液,-80 ℃保存备用。
1.4.2共培养细胞体系的建立 取对数生长期角质形成细胞HaCaT,每个培养瓶中加入0.25%胰酶1 mL消化,计数细胞浓度为5×105·mL-1密度,接种到需要规格的细胞培养板中,5%CO2、37 ℃培养6 h使细胞充分贴壁;取对数生长期黑色素瘤细胞A375,每个培养瓶加入0.25%胰酶1 mL消化,计数细胞浓度为2.5×105·mL-1密度,接种于已有角质形成HaCaT细胞贴壁生长的细胞培养板中,使角质形成细胞HaCaT和黑色素瘤细胞A375接种比例为2:1,置于5%CO2、37 ℃培养箱中24 h。
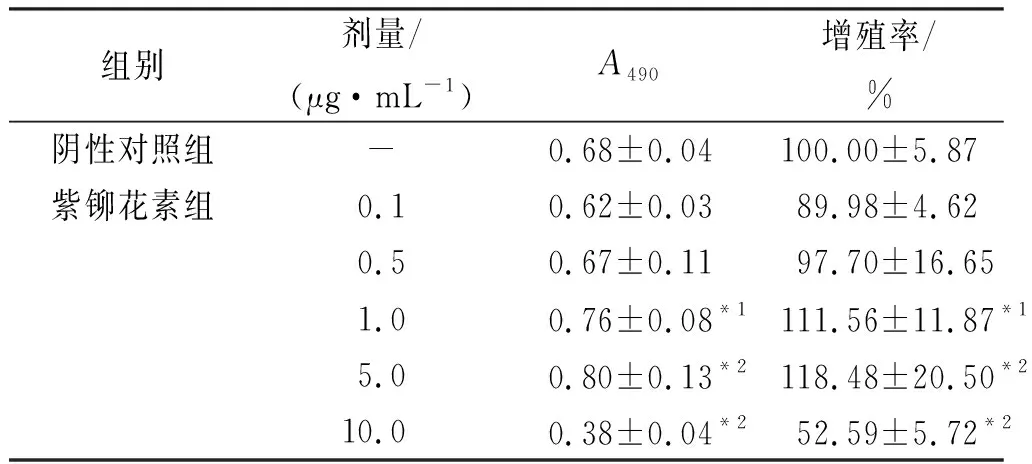
1.4.3MTT法检测细胞增殖率[7]建立共培养细胞体系,培养24 h后弃去培养基,分别加入终浓度0.1,0.5,1.0,5.0,10.0 μg·mL-1含紫铆花素培养液,另设不加药物的阴性对照组,即黑色素瘤细胞与角质形成细胞共培养体系,空白对照组(不含细胞,仅加入相同体积培养液,用于计算细胞增殖率时消除溶液本底误差)。每组设10个复孔。继续培养48 h,阴性对照组和空白对照组以及紫铆花素各给药组每孔均加入5 g·L-1MTT溶液,继续培养4 h后弃去培养液,上述每孔加入DMSO200 μL,震荡10 min,使结晶完全溶解,立即于酶标仪490 nm波长处测定吸光度值(A值),计算各组细胞增殖率。细胞增殖率(%)=[(加药组A值-空白对照组A值) /(阴性对照组A值-空白对照组A值)]×100%。
1.4.4酶学方法测定TYR活性 建立共培养细胞体系,培养24 h后,设不同浓度(0.1,0.5,1.0,5.0,10.0 μg·mL-1)紫铆花素组,另设不加药物的阴性对照组即黑色素瘤细胞与角质形成细胞共培养体系和不接种细胞仅加入相同体积培养液的空白对照组(本组不含细胞,仅用于计算TYR活性时消除溶液本底误差)。每组设8个复孔。给药48 h后,采用多巴氧化速率法测定每组的TYR活性,酶标仪测定490 nm处A值,测定各组的TYR活性[5]。TYR活性(%)=(加药组A值-空白对照组A值)/(阴性对照组A值-空白对照组A值)×100%。
1.4.5氢氧化钠(NaOH)裂解法测定黑色素合成 建立共培养细胞体系,培养24 h后,设不同浓度(0.1,0.5,1.0,5.0,10.0 μg·mL-1)紫铆花素组,另设不加药物的阴性对照组即黑色素瘤细胞与角质形成细胞共培养体系)和不接种细胞仅加入相同体积培养液的空白对照组(不含细胞,仅用于计算黑色素合成率时消除溶液本底误差)。每组设8个复孔。给药48 h后采用NaOH裂解法测定细胞黑色素含量,酶标仪测定460 nm波长处A值。黑色素合成率(%)=(加药组A值-空白对照组A值)/(阴性对照组A值-空白对照组A值)×100%。
1.4.6酪氨酸相关蛋白1(tyrosine-related protein-1,TRP-1)、酪氨酸相关蛋白2(tyrosine-related protein -2,TRP-2)基因表达的检测 建立共培养细胞体系,培养24 h,设阴性对照组和不同浓度(0.1,0.5,1.0,5.0,10.0 μg·mL-1)紫铆花素组,每组设3个重复。给药48 h后收集细胞,Trizol提取各组细胞总RNA,取RNA 5 μL,用1%琼脂糖凝胶电泳,以检测RNA完整性,然后使用反转录酶按40 μL体系进行反转录合成cDNA,进行cDNA纯化、RNA电泳并检测RNA浓度,进行实时荧光聚合酶链反应(Real-time PCR)检测。

2 结果
2.1紫铆花素对黑色素瘤细胞A375和角质形成细胞HaCaT共培养细胞体系细胞增殖率的影响 MTT结果显示,与阴性对照组比较,A375细胞和HaCaT细胞共培养体系与不同浓度紫铆花素共孵育48 h后,1.0,5.0 μg·mL-1紫铆花素组细胞增殖率显著增高(P<0.05或P<0.01),10.0 μg·mL-1紫铆花素组细胞存活率则被明显抑制(P<0.01)。见表1。
表16组细胞增殖率测定结果
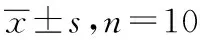
组别剂量/(μg·mL-1)A490增殖率/%阴性对照组-0.68±0.04100.00±5.87紫铆花素组0.10.62±0.0389.98±4.620.50.67±0.1197.70±16.651.00.76±0.08*1111.56±11.87*15.00.80±0.13*2118.48±20.50*210.00.38±0.04*252.59±5.72*2
与阴性对照组比较,*1P<0.05,*2P<0.01
Compared with negative control group,*1P<0.05,*2P<0.01
2.2紫铆花素对人黑色素瘤细胞A375和角质形成细胞HaCaT共培养体系TYR含量的影响L-Dopa氧化速率法测定TYR活性,结果显示,与阴性对照组比较,1.0,5.0 μg·mL-1紫铆花素能明显上调黑色素瘤细胞A375和角质形成细胞HaCaT共培养体系中A375细胞TYR活性(P<0.05 或P<0.01)。5.0 μg·mL-1紫铆花素促进作用最强(P<0.01),见表2。
表26组细胞TYR活性测定结果
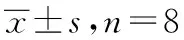

组别剂量/(μg·mL-1)A490TYR活性/%阴性对照组-0.12±0.01106.05±17.75紫铆花素组0.10.13±0.02118.45±28.800.50.12±0.01104.26±17.831.00.14±0.03*1142.13±39.83*15.00.18±0.01*2199.85±11.45*210.00.11±0.1496.50±22.38
与阴性对照组比较,*1P<0.05,*2P<0.01
Compared with negative control group,*1P<0.05,*2P<0.01
2.3紫铆花素对黑色素瘤细胞A375和角质形成细胞HaCaT共培养体系黑色素合成的影响 NaOH裂解法结果显示,与阴性对照组比较,在0.5~5.0 μg·mL-1浓度范围,各剂量紫铆花素组黑色素合成率均明显提高(P<0.05 或P<0.01),紫铆花素5.0 μg·mL-1时,促黑色素合成作用最强(P<0.01)。见表3。
表36组细胞中黑色素合成率测定结果
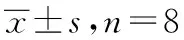
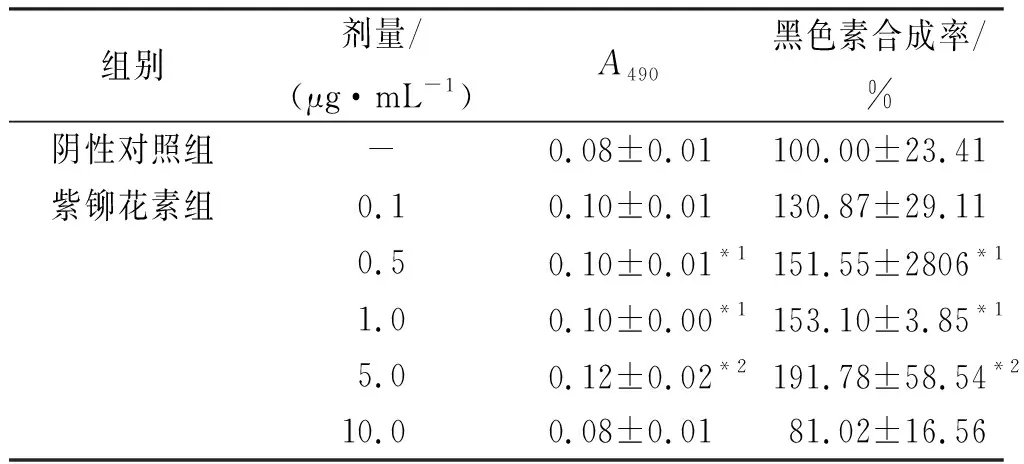
组别剂量/(μg·mL-1)A490黑色素合成率/%阴性对照组-0.08±0.01100.00±23.41紫铆花素组0.10.10±0.01130.87±29.110.50.10±0.01*1151.55±2806*11.00.10±0.00*1153.10±3.85*15.00.12±0.02*2191.78±58.54*210.00.08±0.0181.02±16.56
与阴性对照组比较,*1P<0.05,*2P<0.01.
Compared with negative control group,*1P<0.05,*2P<0.01
2.4紫铆花素对黑色素瘤细胞A375 和角质形成细胞HaCaT共培养体系中TYR活性相关基因TRP-1、TRP-2 mRNA表达的影响 Realtime PCR检测结果显示,与阴性对照组比较,在0.1~5.0 μg·mL-1浓度范围,紫铆花素各剂量组黑色素细胞TRP-1表达水平显著升高(P<0.05,P<0.01)、在0.5~5.0 μg·mL-1浓度范围、紫铆花素各剂量组黑色素细胞TRP-2 mRNA表达水平均显著升高(P<0.01),且紫铆花素为1.0 μg·mL-1时作用最强。见表4。
表46组细胞中TRP-1、TRP-2mRNA表达测定结果
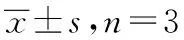
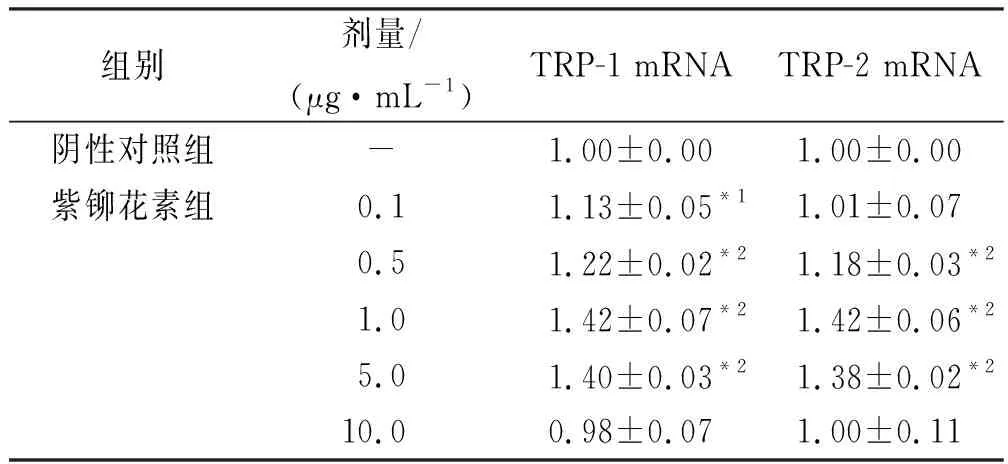
组别剂量/(μg·mL-1)TRP-1 mRNATRP-2 mRNA阴性对照组-1.00±0.001.00±0.00紫铆花素组0.11.13±0.05*11.01±0.070.51.22±0.02*21.18±0.03*21.01.42±0.07*21.42±0.06*25.01.40±0.03*21.38±0.02*210.00.98±0.071.00±0.11
与阴性对照组比较,*1P<0.05,*2P<0.01
Compared with negative control group,*1P<0.05,*2P<0.01
3 讨论
白癜风是一种由于黑色素细胞选择性破坏所致的皮肤获得性慢性色素脱失病[8]。表现为皮肤或毛发中黑色素细胞功能丧失,或两者兼而有之,导致皮肤产生白斑[9]。研究认为,该病主要由黑色素细胞的破坏和黑色素合成途径阻塞造成。黑色素由黑色素细胞内合成,传递到邻近的角质形成细胞,并随角质形成细胞向表皮上层移动,影响皮肤颜色[10]。黑色素在黑色素小体中由多巴醌合成,其合成受酶级联调节,TYR是黑色素生成的限速酶,酪氨酸家族基因TRP-1、TRP-2负责色素沉着的转录调控[8]。
紫铆花素是驱虫斑鸠菊有效成分,对体外单独培养的黑色素瘤细胞A375的黑色素合成和TYR活性的调节作用已经得到证明[11]。笔者在本实验考察不同浓度紫铆花素作用于A375细胞和Hacat细胞共培养体系,发现0.5,1.0,5.0 μg·mL-1紫铆花素可明显促进共培养细胞增殖及黑色素细胞TYR活性和黑色素合成,显著提高TRP-1、TRP-2 mRNA表达,但紫铆花素在10.0 μg·mL-1时表现出明显抑制共培养体系细胞增殖率以及黑色素合成的作用,提示紫铆花素促进共培养体系细胞增殖与浓度有关,超过一定浓度能够对细胞增殖形成抑制,该药可能存在一定的细胞毒性。本实验结果显示,紫铆花素促进共培养体系细胞TYR活性和黑色素合成的浓度与体外单独培养的黑色素瘤细胞A375一致,但其促进作用明显增强,提示紫铆花素可以通过作用于Hacat细胞促进黑色素细胞黑色素形成,该结果与文献[12]报道一致,说明紫铆花素促进黑色素合成的作用机制不仅与A375细胞和Hacat细胞相关,还与上述两种细胞间相互作用有关。
A375细胞和Hacat细胞共培养能较好地模拟表皮微环境,笔者在本实验中观察到紫铆花素明显促进共培养细胞的黑色素合成以及提高TRP-1、TRP-2 mRNA表达,说明调节TRP-1、TRP-2基因表达以及影响A375细胞和Hacat细胞之间的相互作用,可能是紫铆花素治疗白癜风的作用机制之一,但其是否能促进黑色素小体的转运及其转运机制尚不明确,需要继续研究。
