X射线致人骨髓间充质干细胞放射损伤细胞模型的建立
2019-03-01孔祥波钟婉珍房思炼
孔祥波,尹 萍,任 婕,钟婉珍,刘 仰,李 洁,房思炼
(1.中山大学孙逸仙纪念医院口腔科,广东广州510120;2.中山大学附属第六医院口腔颌面外科,广东广州510655)
放射性颌骨坏死(osteoradionecrosis of the jaws,ORNJ)是头颈颌面部肿瘤放射治疗后所导致的严重并发症,发病率约为5%~15%[1-2]。ORNJ的发生和发展相对缓慢,往往在放疗后数年乃至10余年才出现如软硬组织坏死糜烂、瘘管形成和病理性骨折等结局,严重影响患者的生存质量,其发病机制至今尚未完全明确[3]。骨髓是对放射线较为敏感的组织器官之一,骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMMSC)来源于骨髓,是一类具有自我更新和多向分化潜能的前体细胞,在不同条件的诱导下可向成骨细胞、软骨细胞和脂肪细胞等成体细胞分化[4-5]。BMMSC是骨组织中对放射线较为敏感的细胞之一,同时也是骨组织放射损伤的主要靶细胞之一。有研究表明,高剂量的放射线可导致BMMSC染色体受损,细胞增殖率降低,并破坏细胞的基因稳定性[6]。目前,细胞模型由于影响因素少、实验条件可控性强等优点而被广泛应用于某一类疾病的体外研究中。因此,本研究拟通过采用X射线照射建立人骨髓间充质干细胞(human bone marrow mesenchymal stem cells,hBMMSC)放射损伤的细胞模型,并利用该模型评价X射线对hBMMSC自噬、凋亡、克隆形成、多潜能干性和成骨分化能力的影响,以期将其应用于ORNJ的相关研究中。所检测指标中Beclin1是一种自噬相关蛋白,也是控制自噬途径的关键分子;克隆形成反映了细胞群体依赖性和增殖能力的性状;Sox2和Nanog是代表干细胞多分化潜能特性的细胞因子;RUNX2和OGN是骨代谢相关因子。经多方面证实hBMMSC放射损伤的细胞模型的成功建立。
1 材料与方法
1.1 试剂和仪器
人骨髓间充质干细胞(hBMMSC)和成骨诱导分化培养基购自赛业生物科技有限公司,胎牛血清(FBS)、高糖达尔伯克改良伊格尔培养基(DMEM)购自美国Gibco公司,Annexin V/PI双染试剂盒购自凯基生物,龙胆紫染液购自美国Sigma公司,碱性磷酸酶检测试剂盒购自南京建成,兔抗人Beclin1、Sox2、Nanog单克隆抗体和鼠抗人GAPDH单克隆抗体购自美国Proteintech公司,山羊抗兔二抗、山羊抗鼠二抗购自联科生物,兔抗人RUNX2多克隆抗体购自美国Cell Signaling Technology公司,鼠抗人OGN单克隆抗体购自美国Santa Cruz公司,PCR引物购自上海生工,逆转录和实时荧光定量PCR试剂盒购自日本TaKaRa公司;二氧化碳培养箱、生物安全柜、酶标仪购自美国Thermo公司,倒置显微镜购自日本Nikon公司,电泳槽、转印槽、超高灵敏度化学发光成像系统购自美国BIO-RAD公司,实时荧光定量PCR仪购自瑞士Roche公司,流式细胞仪购自美国Becton Dickinson公司,X射线辐照仪购自美国Rad Source公司。
1.2 hBMMSC细胞的培养
使用含体积分数10%胎牛血清、1%青-链霉素的DMEM培养基,置于37℃、体积分数为5%的CO2培养箱中培养,观察并记录细胞的生长状态。每3天换液一次,待细胞汇合度达到80%~90%时按1∶3进行传代,取第4代细胞进行实验。
1.3 细胞照射
细胞处于对数生长期时进行X射线照射,采用中山大学医学实验中心RAD SOURCE RS 2000型X-ray生物学辐照仪进行照射,工作电压160 kV,电流25 mA,剂量率1.24 Gy/min(加反射体),照射剂量分别为0、2、4、8 Gy剂量,所有样品照射均在室温下进行,照射完成后细胞重新放回培养箱继续培养。
1.4 Western blotting
将对数生长期的hBMMSC接种于6孔板中,用RIPA裂解液裂解各组细胞提取总蛋白,用蛋白浓度测定试剂盒测定样品的蛋白浓度,配平。取20 μg蛋白样品上样,经SDS-PAGE电泳分离后,将待测蛋白转移至PVDF膜上,用5%脱脂奶粉溶液于室温下封闭1 h,加入一抗于4℃孵育过夜。次日用TBST洗膜3次,加入二抗室温下孵育1 h。TBST洗膜3次后,化学发光法显影采集目的条带图像。
1.5 RT-qPCR
将对数生长期的hBMMSC接种于6孔板中,采用Trizol提取细胞总RNA,定量后将细胞RNA逆转录为cDNA,使用实时荧光定量PCR分析各组mRNA的表达水平,配制20 μL的反应体系:上、下游引物(10 μmol/L)各 0.8 μL、SYBR Green 10 μL,DNA 模板 2 μL、dH2O 6.4 μL。反应条件为:95 ℃ 30 s,1个循环;95 ℃ 5 s、60 ℃ 30 s,40个循环。每组样品设置3个复孔。采用2-ΔΔCt相对定量法进行分析,使用GAPDH进行校正,计算目的基因的相对表达量,所使用的引物序列见表1。

表1 引物序列Table 1 The sequences of the primers
1.6 细胞凋亡
将对数生长期的hBMMSC接种于6孔板中,加入不含EDTA的胰酶1 mL,消化后收集细胞,PBS重悬,再次离心。去上清,500 μL Binding Buffer重悬细胞,调整细胞浓度为1×106个/mL。分别加入5 μL Annexin-V和5 μL PI,室温下避光孵育15 min,上流式细胞仪检测,采用Flowjo软件进行分析。
1.7 克隆形成
将对数生长期的hBMMSC接种于6 cm培养皿中,培养2周后吸走细胞培养基,PBS洗涤2次,加入40 g/L的多聚甲醛溶液固定20 min,吸走多聚甲醛,ddH2O洗涤2次,0.1%结晶紫染色15 min,漂洗后烘干水渍,拍照观察。
1.8 成骨诱导分化
当hBMMSC汇合度达到70%时,将完全培养基更换为成骨诱导分化培养基(DMEM+10%胎牛血清,10 mmol/L β-甘油磷酸钠,50 mg/L抗坏血酸,1 μmol/L地塞米松,100 U/mL青-链霉素),每3天进行换液。
1.9 碱性磷酸酶活性测定
将对数生长期的hBMMSC接种于12孔板中,每孔加入200 μL TritonX-100裂解液,4℃裂解过夜。完成后取30 μL裂解液,按照试剂盒说明书进行操作,使用酶标仪于520 nm波长处测定吸光度A520nm。另取10 μL裂解液用BCA法测定蛋白浓度,计算每克蛋白所含有的碱性磷酸酶活性。
1.1 0 统计学分析
采用SPSS 20.0软件进行分析,结果以均数±标准差(mean±SD)表示,所有实验独立重复3次。两组间采用两独立样本t检验,多组间采用单因素方差分析,组间两两比较采用Dunnett-t检验法,双侧检验,以P<0.05代表差异有统计学意义。
2 结果
2.1 X射线对hBMMSC Beclin1蛋白和mRNA表达的影响
与0 Gy对照组相比,hBMMSC经2、4、8 Gy X射线照射后,Beclin1的蛋白水平表达呈剂量依赖性上调,多组间根据单因素方差分析,差异具有统计学意义(F=128.40,P<0.001),Dunnett-t检验法两两比较显示不同剂量照射组与0 Gy对照组相比,差异均有统计学意义(P=0.025 vs 2 Gy;P=0.009 vs 4 Gy,P=0.005 vs 8 Gy;图 1);Beclin1 的mRNA水平表达亦呈剂量依赖性升高,多组间根据单因素方差分析,差异具有统计学意义(F=79.31,P<0.01),Dunnett-t检验法两两比较显示不同剂量照射组与0 Gy对照组相比,差异均有统计学意义(P=0.010 vs 2 Gy;P<0.001 vs 4 Gy,P<0.001 vs 8 Gy;图2)。
2.2 X射线对hBMMSC凋亡率的影响
与0 Gy对照组相比,hBMMSC经2、4、8 Gy X射线照射后,细胞凋亡率随着照射剂量的增加而逐渐升高,依次为(1.96±0.91)%、(4.28±0.83)%、(5.65±0.64)%、(14.64±1.57)%。根据单因素方差分析,差异具有统计学意义(F=84.34,P<0.001),Dunnett-t检验法两两比较显示不同剂量照射组与0 Gy对照组相比,2、4 Gy照射组的差异均无统计学意义,8 Gy照射组与0 Gy对照组相比,差异具有统计学意义(P<0.001;图3)。

图1 不同剂量X射线对hBMMSC Beclin1蛋白表达的影响Fig.1 Effect of different doses of X-ray on Beclin1 protein expression in hBMMSC
2.3 X射线对hBMMSC克隆形成率的影响
克隆形成实验结果显示,hBMMSC经8 Gy X射线照射后克隆形成率为(11.32±2.08)%,空白对照组克隆形成率为(31.25±2.97)%,照射后细胞克隆形成率显著下降,差异具有统计学意义(P<0.001;图4)。
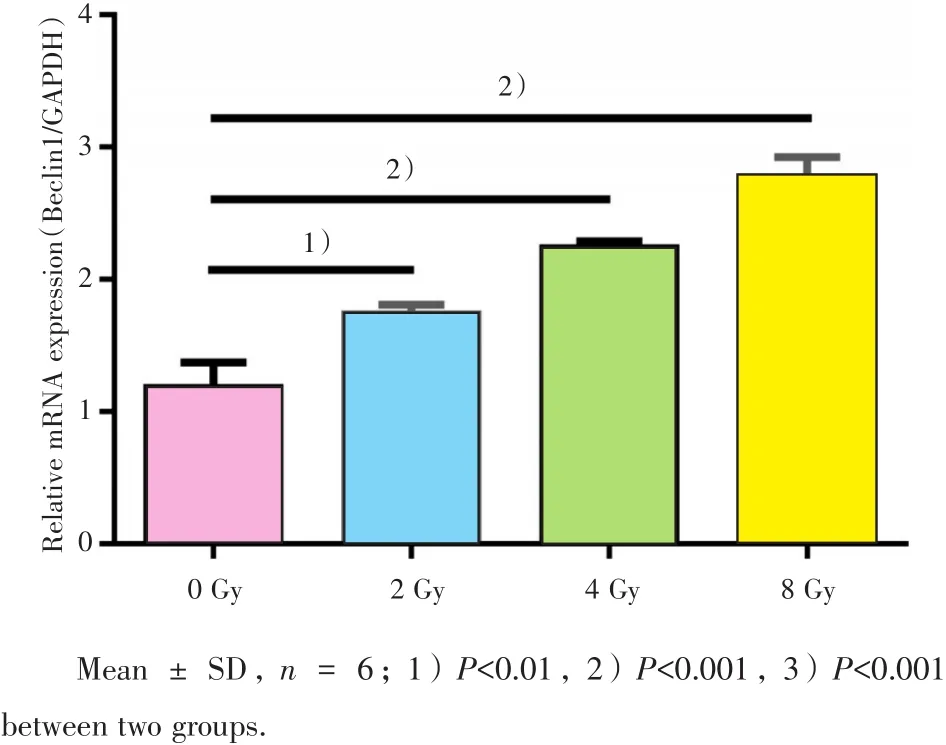
图2 不同剂量X射线对hBMMSC Beclin1 mRNA表达的影响Fig.2 Effect of different doses of X-ray on Beclin1 mRNA expression in hBMMSC
2.4 X射线对hBMMSC Sox2、Nanog蛋白和mRNA表达的影响
与0 Gy对照组相比,hBMMSC经8 Gy X射线照射后,Sox2和Nanog的蛋白水平表达下调(Sox2:P=0.009;Nanog:P<0.001;图5);同时Sox2和Nanog的mRNA水平表达亦降低,差异均具有统计学意义(Sox2:P<0.001;Nanog:P<0.001;图6)。

图3 不同剂量X射线对hBMMSC凋亡率的影响Fig.3 Effect of different doses of X-ray on apoptosis rate in hBMMSC
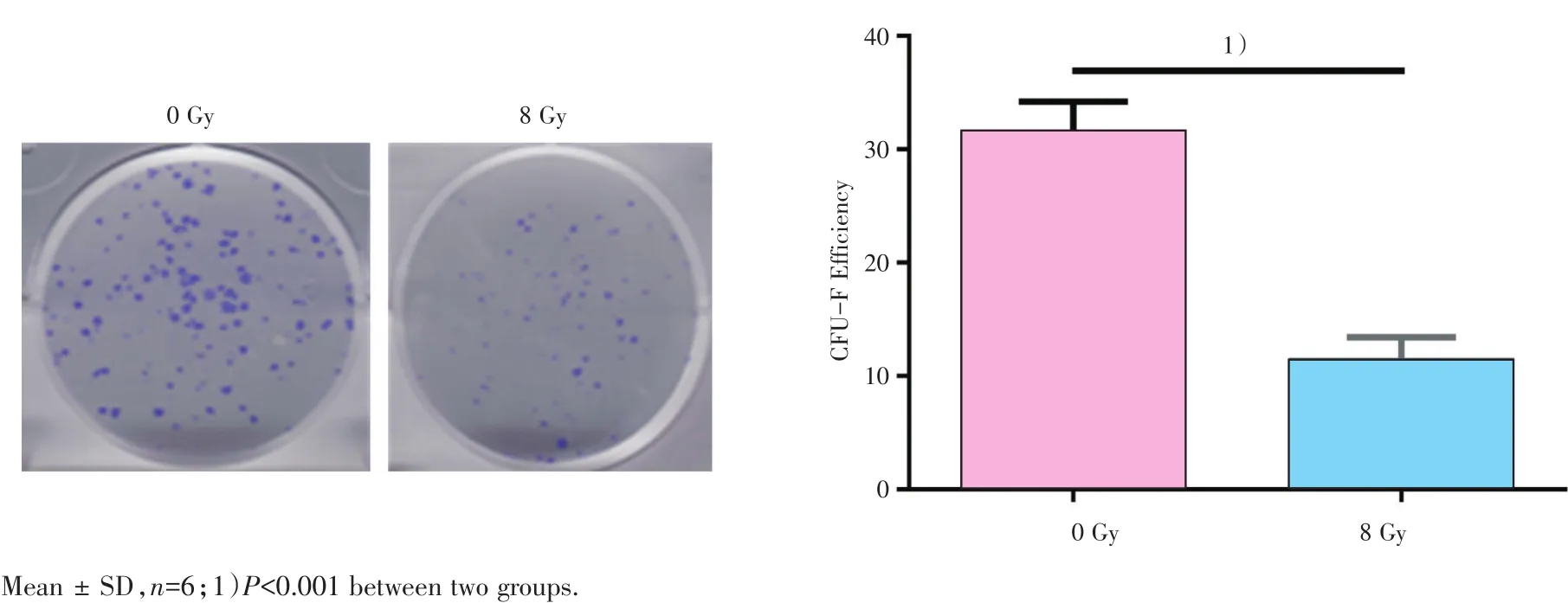
图4 不同剂量X射线对hBMMSC克隆形成率的影响Fig.4 Effect of different doses of X-ray on CFU-F efficiency in hBMMSC

图5 不同剂量X射线对hBMMSC Sox2和Nanog蛋白表达的影响Fig.5 Effect of different doses of X-ray on Sox2 and Nanog protein expression in hBMMSC
2.5 X射线对hBMMSC成骨诱导分化后RUNX2、OGN蛋白和mRNA表达的影响
与0 Gy对照组相比,hBMMSC经2、4、8 Gy X射线照射后,成骨诱导分化第7天RUNX2和第14天OGN的蛋白水平表达均呈剂量依赖性下调,分别对各组进行单因素方差分析,差异具有统计学意义(RUNX2:F=70.4,P<0.001;OGN:F=64.07,P<0.001),利用Dunnett-t检验两两比较显示:与0 Gy对照组相比,2 Gy照射组的RUNX2和OGN蛋白水平表达差异无统计学意义外(RUNX2:P=0.059,OGN:P=0.067),4 Gy和8 Gy照射组差异均有统计学意义(RUNX2:P=0.002 vs 4 Gy,P=0.002 vs 8 Gy ;OGN:P=0.025 vs 4 Gy,P=0.009 vs 8 Gy;图7);RUNX2和OGN的mRNA水平表达亦呈剂量依赖性降低,根据单因素方差分析,差异具有统计学意义(RUNX2:F=51.92,P<0.01;OGN:F=58.16,P<0.01),Dunnett-t检验两两比较显示与0 Gy对照组相比,除2 Gy照射组的RUNX2水平表达差异无统计学意义外(P=0.075),其余各组差异均有统计学意义(RUNX2:P=0.002 vs 4 Gy,P=0.0002 vs 8 Gy;OGN:P=0.003 vs 2 Gy,P=0.001 vs 4 Gy,P=0.0004 vs 8 Gy;图8)。
2.6 X射线对hBMMSC成骨诱导分化后碱性磷酸酶活性的影响
与0 Gy对照组相比,hBMMSC经2、4、8 Gy X射线照射后,成骨诱导分化第7天碱性磷酸酶活性呈剂量依赖性降低,根据单因素方差分析,差异具有统计学意义(F=47.97,P<0.001),Dunnett-t检验法两两比较显示不同剂量照射组与0 Gy对照组相比,2 Gy照射组的差异无统计学意义(P=0.068),4、8 Gy照射组差异具有统计学意义(P=0.011 vs 4 Gy,P=0.0004 vs 4 Gy;图9)。
3 讨论

图6 不同剂量X射线对hBMMSC Sox2和Nanog mRNA表达的影响Fig.6 Effect of different doses of X-ray on Sox2 and Nanog mRNA expression in hBMMSC

图7 不同剂量X射线对hBMMSC RUNX2和OGN蛋白表达的影响Fig.7 Effect of different doses of X-ray on RUNX2 and OGN protein expression in hBMMSC

图8 不同剂量X射线对hBMMSC RUNX2和OGN mRNA表达的影响Fig.8 Effect of different doses of X-ray on RUNX2 and OGN mRNA expression in hBMMSC

图9 不同剂量X射线对hBMMSC碱性磷酸酶活性的影响Fig.9 Effect of different doses of X-ray on alkaline phosphatase activity in hBMMSC
放射治疗是目前头颈部恶性肿瘤的主要治疗手段之一,但放疗所致颌面部组织的损伤却给患者带来严重的并发症,其中以ORNJ最为严重[7]。ORNJ的发病机制至今尚未能完全明确,其病理学转归大多表现为放射区域的组织细胞受到破坏,同时氧自由基大量形成,引起细胞外基质堆积和微血管血栓,最终骨重塑平衡被打破造成骨坏死[8]。颌骨组织的形成主要包括hBMMSC定向分化为成骨祖细胞和后续向成熟成骨细胞分化的过程,hBMMSC是存在于骨髓中一类具有多向分化潜能和自我更新能力的干细胞,是髓腔内的“种子细胞群”,同时也是骨组织中对放射线敏感的细胞之一。本研究通过采用辐照仪对细胞进行不同剂量X射线照射,从而建立hBMMSC放射损伤的细胞模型。
hBMMSC在缺氧、细胞毒药物以及放射等应激状态之下,会激发自噬从而维持细胞内环境的稳定。有研究显示,当细胞经各类射线照射后,细胞中最主要的反应为生物膜、细胞器和细胞核等在结构或者功能上受到损伤,细胞死亡是其中最为严重的结局,自噬与凋亡是细胞对损伤剌激的适应反应[9]。Beclin1作为参与自噬形成的重要基因,其表达水平在一定程度上能反应细胞的自噬情况[10]。细胞凋亡则是维持正常组织形态和一定功能的主动自杀过程,是在基因控制下按照一定程序进行的细胞死亡[11-12]。我们在研究中分别给予单次照射剂量0、2、4、8 Gy,照射后Western blot与RT-qPCR检测结果均显示,正常hBMMSC中Beclinl呈弱表达,而在照射后表达则呈剂量依赖性升高,其中在8 Gy时表达最高;此外,我们在0、2、4、8 Gy的X射线照射剂量下检测hBMMSC的凋亡率,结果显示照射组的凋亡率与空白对照组相比均有升高,经8 Gy单次照射后hBMMSC的凋亡率与空白对照组凋亡率差异最为显著。
细胞克隆形成率即细胞接种存活率,表示细胞接种后贴壁细胞成活并形成克隆的数量,反映了细胞群体依赖性和增殖能力两个重要性状[13]。根据本实验中克隆形成结果显示,hBMMSC经8 Gy X射线照射后克隆形成率为(11.32±2.08)%,未照射空白对照组克隆形成率为(31.25±2.97)%,表明照射后细胞克隆形成率显著下降。
Sox2和Nanog是代表干细胞多分化潜能特性的细胞因子,对于维持干细胞的功能起关键作用[14-15]。当这些细胞因子处于受损状态下,干细胞的多潜能分化特性就会受到影响。RUNX2是调控成骨分化早期阶段的重要转录因子[16];OGN称为骨诱导因子,是骨组织的一种分泌蛋白[17];碱性磷酸酶是成骨细胞的早期标志性物质[18]。我们的研究表明,8 Gy X射线照射后hBMMSC Sox2和Nanog的表达降低,这提示干细胞的多潜能特性受到损伤,后续有望继续开展相应X射线照射后体外诱导hBMMSC成骨诱导,成脂诱导及成软骨诱导的细胞实验,以及在临床ORNJ样本中检测成骨相关基因的表达变化差异。此外,不同剂量X射线照射后hBMMSC成骨分化基因RUNX2和OGN的表达下调,碱性磷酸酶活性降低,其中以8 Gy照射组最为明显,这说明X射线能抑制hBMMSC的成骨分化能力,影响新生骨组织形成,打破放射后骨组织内平衡以及体内骨髓微环境的稳定性,从而增进破骨细胞介导的骨吸收过程,导致了骨缺损的形成。
综上所述,本研究建立的hBMMSC放射损伤细胞模型分别从细胞的自噬、凋亡、克隆形成、多潜能干性和成骨分化能力等方面验证了X射线对hBMMSC的放射性损伤,充分说明该细胞模型的构建是成功的,并为ORNJ发病机制等的实验研究提供新的研究对象,也对开展抗辐射药物对hBMMSC的保护作用的验证以及药物通过信号通路发挥作用的深入探讨具有重要意义。
