α-硫辛酸对UVB诱导的角质形成细胞氧化应激的影响
2019-02-19吴敏智
黄 丹 鞠 梅 陈 崑 吴敏智 顾 恒
近年来研究发现,外源因素诱导的氧化应激在致皮肤毒性过程中起着关键作用,导致多种皮肤疾病的发生,比如衰老、皮肤肿瘤、免疫性皮肤病等[1]。LA是类似于维生素B族的一种抗氧化剂,存在于线粒体,具有脂溶性和水溶性,外界补充的LA可到达细胞的任何一个部位,有极强的抗炎以及自由基清除能力,有较好的应用前景[2]。近年来已经广泛应用于糖代谢、糖尿病及其并发症、心脑血管和其他多种疾病,但在皮肤科疾病中应用较少,为了解该抗氧化剂能否对人皮肤光损伤产生保护作用而设计了该研究。本研究用UVB制造氧化应激模型,探讨LA对紫外线诱导的角质形成细胞氧化应激状态的影响。本研究采用过氧化氢来诱导氧化应激反应[3,4],建立人皮肤细胞的氧化应激阳性对照。
1 材料与方法
1.1 材料与仪器
1.1.1 主要试剂 细胞标本:原代角质形成细胞取自健康成人包皮环切术后的包皮。主要试剂:单丹(磺)酰戊二胺(Monodansylcadaverine, MDC)、MTT、LA、3%过氧化氢溶液、DCFH-DA荧光探针(美国Sigma-Aldrich公司)。胎牛血清(Gibico公司,乌拉圭),角质形成细胞无血清培养基(KSFM,美国Gibco公司),MDA、TAOC试剂盒(南京建成生物工程研究所),RPMI裂解液(碧云天生物公司)。其他试剂均为国产分析纯。
1.1.2 仪器设备 UVB辐照仪(上海希格玛高技术有限公司),UVB荧光灯管(UVB Broadband PL-S 9W/12,美国飞利浦公司),全波长酶标仪(美国Thermo公司),流式细胞仪(BD FACSVerseTM Flow Cytometer,美国Bio-Rad公司),微量高速冷冻离心机(5810R,德国Eppendorf公司),超声细胞破碎仪(Vcx-130,美国Soics公司),PK-SB型电热恒温水槽(上海精宏实验设备有限公司)。
1.2 方法
1.2.1 细胞培养 原代KC培养于KSFM培养基中,置于37℃、5% CO2、饱和湿度的孵箱中孵育。取第3~8代对数生长期细胞按(5~8)×104/mL密度接种到相应的培养皿。
1.2.2 实验分组及处理 预实验中UVB照射分5、10、20、40和80 mJ/cm25个剂量梯度,H2O2分为0、0.5、1.0和10.0 mmol/L四个浓度梯度,根据细胞状态及生长活力,选取UVB 40 mJ/cm2作为照射组,H2O210.0 mmol/L作为阳性对照组,以及阴性对照组,共三个组别。照射组又分为两个亚组:一组在照射结束后加入正常培养基,一组加入含LA终浓度0.5 mmol/L的培养基孵育,分别在4 h、12 h收集细胞进行相应检测。阳性对照组H2O2孵育4 h、12 h后进行相应检测。
1.2.3 制作UVB光损伤细胞模型 细胞接种在6孔板上,每孔1.5 mL细胞悬液,摇晃均匀,置于5% CO2孵箱37℃下孵育,约12 h后细胞贴壁,待细胞增殖铺满80%~90%培养皿底时进行UVB照射处理。照射前用枪头吸去上清,预热的PBS缓冲液冲洗一遍,每孔加入适量PBS,使薄层液体覆盖细胞。使用本课题组定制的UVB细胞照射装置,光源选用平行布置的9支飞利浦宽波UVB荧光灯管(Philips UVB Broadband PL-S 9W/12)。照射前打开光源预热10 min,使输出光源能量稳定,经UVB辐照仪测量校订,选取辐照强度相对最为均衡的照射平面(距荧光灯管16 cm处),平均辐照强度通常在1.50 mW/cm2左右。根据需要的照射量计算出照射时间,设置时间,开始照光,照射结束后吸去PBS。照射时周围的孔用遮光纸完全遮盖。阴性对照孔除不照光,其他处理同照射组。
1.2.4 H2O2制作阳性对照:细胞铺满培养皿底80%~90%时加入含10 mmol/L H2O2的培养基,分别在重新孵育后4、12 h终止孵育,PBS清洗两遍,进行下一步处理。
1.2.5 LA干预 LA干粉加入无水乙醇配成0.5 mol/L的母液,分装4℃保存,使用时按照1∶1000直接用培养基稀释成终浓度500 μmol/L的试验用终浓度。
1.2.6 2’7’-二氯荧光乙酰乙酸钠(DCFH-DA)染色测定活性氧自由基(ROS) 去除培养基,加入稀释好的DCFH-DA探针,使其终浓度为10 μmmol/L,37℃孵箱里孵育30 min,用无血清培养基洗涤细胞3次,用胰酶将细胞消化下来。DCFH被细胞内的ROS氧化成高荧光强度的DCF(2’,7’-dichlorodihydrofluorescein),流式细胞仪检测该荧光强度,激发波长为488 nm,发射波长为525 nm。倒置荧光显微镜下观察荧光强度的变化,并用流式细胞术对绿色荧光进行定量。
1.2.7 化学法检测细胞内脂质过氧化物MDA和TAOC 预冷PBS洗涤细胞两次,RPMI裂解液于冰上裂解细胞,10000 rpm离心10 min,取上清液,-20℃保存待测,严格按照试剂盒说明书操作。
1.2.8 数据分析
1.2.8.1 观察指标 倒置荧光显微镜下动态观察各组细胞形态以及DCFH-DA染色后荧光强度变化,并用配套的成像拍照设备拍摄图片。绿色荧光定量、MDA和TAOC浓度均以计量资料体现。
2 结果
2.1 UVB照射后角质形成细胞形态变化
2.1.1 UVB照射 原代角质形成细胞经照射后,较阴性对照组细胞,漂浮死亡的细胞逐渐增多,贴壁的细胞部分失去正常的膜结构,折光度变差。总体上照射后12 h的细胞形态较4 h有所恢复。见图1a~1c。
2.1.2 H2O2孵育 经10 mmol/L H2O2作用4 h后细胞间隙增宽、死亡的细胞增多,作用到12 h细胞密度又恢复正常,但细胞轮廓欠清,有较多漂浮死亡的细胞。见图1d~1f。
2.2 DCF-DA染色法及流式细胞术检测ROS产生水平 40 mJ/cm2UVB照射后4 h细胞绿色荧光强度较对照组增强,提示ROS产生增多,照射后即刻加LA孵育4 h后肉眼见荧光强度有所减弱,但仍较对照组强。见图2。流式细胞术检测绿色荧光强度,照射后4 h,细胞的荧光强度与H2O2阳性对照相当[(35311±3072.3) vs. (37075±2049.8)],均较阴性对照组明显升高(24465±2085.3,P<0.001),加LA干预后荧光强度下降至接近阴性对照组水平(26926±3502.7,P>0.05),提示ROS产生减少。
从图3看出,UVB照射后12 h,即使未使用LA干预,荧光强度较照射后4 h也有较显著的下降(P=0.006),加抗氧化剂LA孵育后荧光值较未加抗氧化剂差别仍有统计学意义[(28253.33±2288.0)vs. (24500±2203.20),P=0.002]。单因素方差分析显示除阳性对照组与阴性对照组有显著差异外(P<0.001),其余组与阴性对照组均无显著性差异。见表1。
2.3 MDA检测结果 各组及各时间点MDA的趋势与ROS的变化趋势相当, 40 mJ/cm2UVB照射后4 h,与阴性对照组之间差别有显著性差别[(11.61±0.68) vs (8.25±1.21) nmoL/mg·prot,P=0.004 )],照射后12 h,MDA有所下降[(9.95±1.17)nmoL/mg·prot],但仍较阴性对照组高;无论是照射后4 h还是12 h,经过LA干预后MDA值均得到下降,以40 mJ照射后LA孵育4 h后MDA下降更为明显(P=0.019)。见图4,表1。
2.4 TAOC检测结果 根据标准曲线和测得的A值计算出各组TAOC浓度,单因素方差分析,F=0.518,LSD检验两两比较均P>0.05,各组之间均无统计学差异。见表1,图5。提示各组总抗氧化能力无显著差异。
MDA单因素方差分析F=4.695,对照组和H2O2之间、对照组和40 mJ/cm2UVB照射后4 h之间差异有显著统计学意义(P<0.05),40 mJ/cm2UVB照射后4 h与12 h之间P=0.031,照射后4 h、12 h后加LA与未加LA 孵育两组间均有显著统计学意义(P<0.05),其余各组两两之间均显著无统计意义。TAOC统计分析各组之间均无显著统计学意义(P>0.05)。
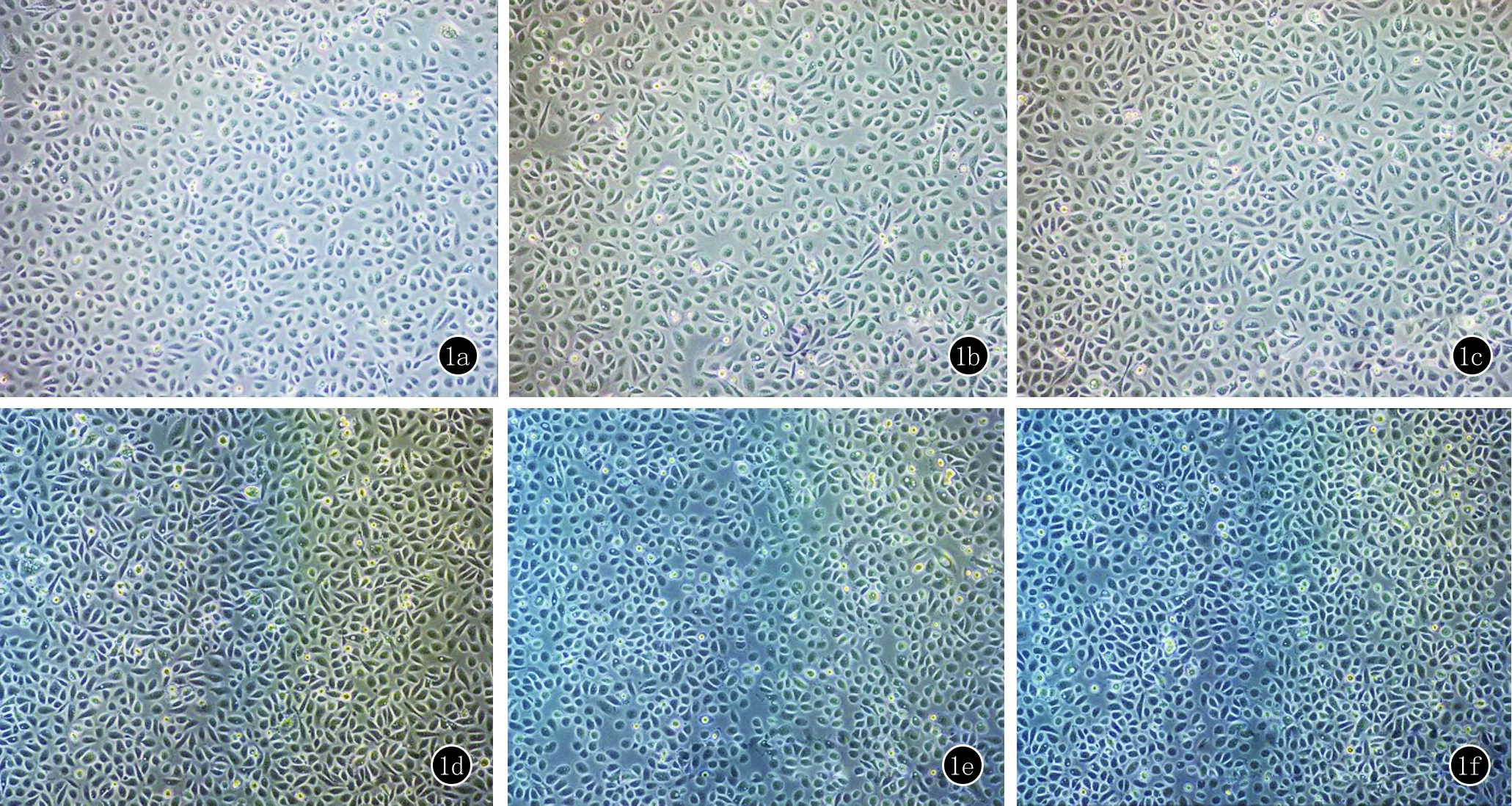
图1 UVB照射或者H2O2孵育后细胞的形态变化 a:原代角质形成细胞;b,c:40 mJ/cm2UVB照射原代角质形成细胞后4、12 h后部分贴壁的细胞部分失去正常的膜结构,折光度变差;d:原代角质形成细胞;e,f:10 mmol/L H2O2溶液作用4 h后细胞间隙增宽、死亡的细胞增多,作用到12 h细胞密度又恢复正常,但细胞轮廓欠清,有较多漂浮死亡的细胞
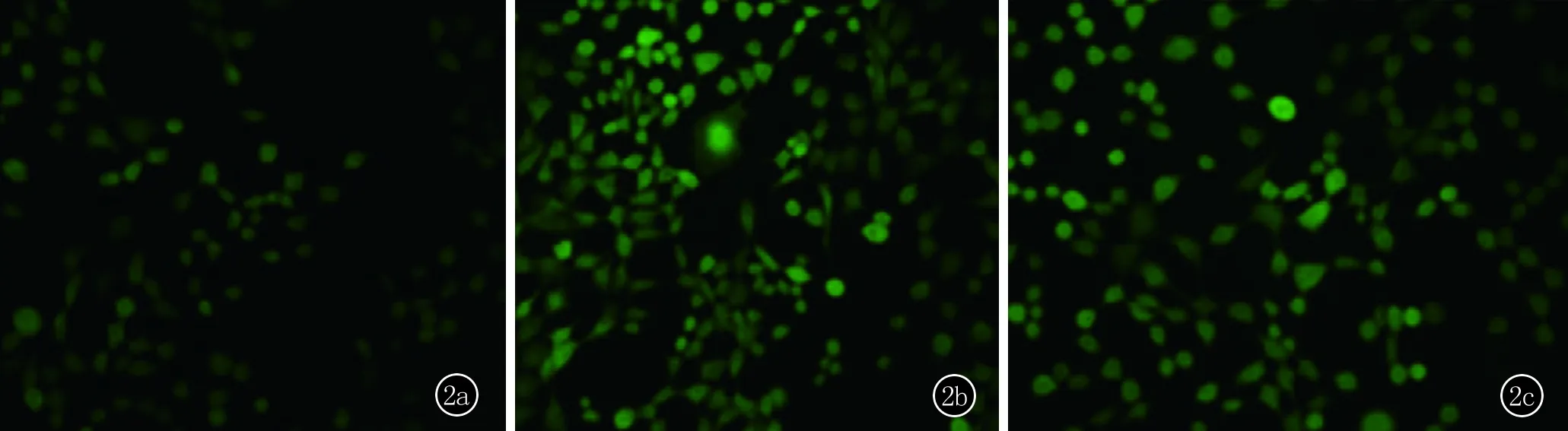
图2 DCF-DA染色效果图 a、b、c图依次为对照组、UVB照射组、UVB照射+LA治疗组,可见后两组绿色荧光强度较对照组明显增强,提示ROS产生增多,c组荧光较b组有所减弱
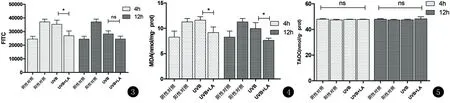
图3 UVB照射后4、12 h原代角质形成细胞DCFH-DA染色显示ROS荧光强度的对比图4 UVB照射后4、12 h,LA孵育4、12 h原代角质形成细胞MDA浓度对比图5 UVB照射后4、12 h,LA孵育4、12 h原代角质形成细胞总抗氧化能力,各组之间均无统计学差异
表1 原代角质形成细胞DCFH-DA染色后DCF荧光强度、化学法检测MDA和TAOC浓度
注:n=3。流式细胞仪检测原代角质形成细胞DCFH-DA染色后DCF荧光强度,单因素方差分析,F=13.352,阳性对照组、照射后4 h组ROS强度与阴性对照组均有显著差异(P<0.001),照射后12 h组较4 h组ROS下降有显著差异(P=0.006);照射后加抗氧化剂LA孵育4 h ROS下降较未加抗氧化剂组有统计学意义(P=0.002)
3 讨论
正常的皮肤细胞由于新陈代谢产生少量的O2-、H2O2,UVA和UVB照射后通过直接作用和间接作用产生大量的ROS,包括超氧阴离子、单线态氧、过氧化氢和羟自由基。细胞内存在固有的抗氧化防御系统,有清除ROS的作用,包括超氧化歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽还原酶和谷胱甘肽过氧化物酶等酶类;以及谷胱甘肽(GSH)、尿酸、辅酶Q和泛醌等活性物质[3]。如果ROS不能被抗氧化系统及时拮抗,则会通过循环系统至其他组织和细胞发生脂质过氧化,从而诱导DNA-蛋白质交联物和嘧啶二聚体等的产生,引起ERK1/2、p38 MAPK、JNK和NF-kappaB等信号通路的异常激活[5],这些异常激活的信号通路将造成对组织分化增殖和损伤炎症过程的异常调控,参与UVB介导的凋亡、光诱导肿瘤、光敏感性皮肤病和光老化的发生。要降低自由基对人体的危害,除了依靠体内自由基清除系统外还要寻找和发掘外源性自由基清除剂。
临床常用的抗氧化剂如维生素C为水溶性,抑制细胞释放氧自由基,清除细胞周围氧自由基、提高过氧化氢酶谷胱甘肽还原酶活性,主要在生物水溶性腔隙中发挥较强的抗氧化作用;维生素E为脂溶性,主要保护细胞膜受到脂质过氧化损伤,需要在其他抗氧化剂如维生素C的协同下再循环利用[2]。而LA同时具有脂溶性和水溶性,是线粒体a-酮酸氧化脱氢酶的一个辅助因子,LA能够还原内源性抗氧化剂如维生素C、维生素E和谷胱甘肽,螯合铁、铜和其他金属,与这些金属离子稳定结合,抑制这些金属催化的脂质过氧化。LA的还原态二硫辛酸(DHLA)通过清除体内的氧自由基和动员机体内源性的抗氧化剂如维生素C、维生素E和谷胱甘肽的生成发挥抗氧化作用[6,7],作为新一代的抗氧化剂LA和DHLA一起被誉为“万能抗氧化剂”,有广泛的应用前景。近年来有数个小规模的临床研究报道局部外用5%的LA制剂有效改善面部的光老化现象,包括皮肤粗糙、细纹、暗沉,并抑制UV导致的皮肤晒伤,减少角质形成细胞凋亡[8,9]。但在皮肤角质形成细胞LA抗氧化应激的的机理研究仍非常少。
本研究设置了外源性H2O2孵育组作为阳性对照组,运用UVB照射诱导角质形成细胞产生氧化应激压力,从氧化损伤水平和抗氧化水平检测了细胞内氧化-抗氧化体系,结果证实40 mJ/cm2UVB能诱导氧化应激反应的发生,相当于10 mmol/L H2O2的氧化效果。流式细胞仪技术将染色后激发的绿色荧光准确定量,表明40 mJ/cm2的UVB照射后4 h细胞内的ROS 水平较阴性对照组升高约30%~40%,与既往研究结果相一致[10],随着时间的推移ROS有自行下降的趋势。照射后经过抗氧化剂LA的处理,ROS下降的更为迅速。(见图2和表1)。MDA是细胞膜脂质被活性氧氧化的产物,是评价氧化应激损伤程度的重要标志物,过度累计可直接反应受氧化应激损伤的程度。本研究结果显示MDA的变化趋势与ROS一致,抗氧化剂LA干预后MDA下降的更为显著,体现了UVB诱导的急性光损伤以及LA的抗氧化应激以及对抗光氧化损伤效应。研究时发现,LA与正常的角质形成细胞共培养4 h、12 h,ROS和MDA含量较阴性对照组并没有发生明显变化(数据未列出),可能LA没有改变内环境正常细胞的氧化应激状态,在氧化压力增高时才发挥抗氧化作用。
在抗氧化体系检测方面,结果显示UVB照射后各组细胞的总抗氧化能力均未发生显著变化(见图5和表1)。分析原因,可能是角质形成细胞抗氧化酶整体水平表达低下,难以出现统计学上的差异,提示我们今后需要进一步的研究,更准确的对抗氧化系统进行定量。
综上所述,本部分研究证实了UVB照射能够引起原代角质形成细胞氧化应激损伤,与10 mmol/L的过氧化氢诱导的氧化应激的阳性对照结果一致,LA通过降低ROS和MDA含量能够有效的减轻UVB照射引起的氧化应激损伤。实际上LA作为一种天然抗氧化剂,其广谱抗氧化能力能够对抗多种氧化损伤带来的病理生理损伤,值得深入研究。
