P-糖蛋白过表达对INS-1和大鼠胰岛β细胞分化的影响
2019-02-14陈亚高雅莉李代清
陈亚,高雅莉,李代清
P-糖蛋白(P-glycoprotein,P-gp)又称为多重耐药蛋白1(multidrug resistance1,MDR1),是一个分子质量约170 ku,利用三磷酸腺苷(ATP)水解产生的能量将外来物质排出细胞外的膜蛋白[1]。人类P-gp由abcb1单基因调控,啮齿类动物由abcb1a和abcb1b双基因调控[2]。本研究前期实验表明大鼠胰岛P-gp的表达主要是由abcb1b调控[3]。多数研究者认为2型糖尿病的主要病理机制是胰岛β细胞数量的减少和功能的衰竭,而美国Accili团队提出糖尿病中β细胞的衰竭与其去分化有关[4]。虽然P-gp研究的热点主要是与其外排泵相关的肿瘤耐药机制,但也有文献报道P-gp的表达影响细胞的分化[5]。P-gp与胰岛β细胞的分化有无联系尚不清楚。本研究通过构建INS-1细胞和SD大鼠P-gp过表达模型,探究P-gp过表达后对β细胞分化的影响。
1 材料与方法
1.1 实验材料
1.1.1 细胞、腺病毒及动物 大鼠胰岛β细胞系INS-1购于中国科学院北京协和细胞库。重组腺病毒颗粒由上海凯基基因构建。野生型SD大鼠购自北京华阜康生物科技股份有限公司。转基因大鼠(Ins2-abcb1b)由南京生物医药研究院造模,所有动物均为雄性,10~12周,体质量250~300 g。
1.1.2 试剂 RPMI-1640购于美国GIBCO公司;澳洲胎牛血清购于依科赛生物公司;胶原酶Ⅴ、β巯基乙醇、青链霉素混合液购于美国Sigma公司;E.Z.N.A.总RNA分离试剂盒购于美国OMEGA公司;逆转录试剂盒购自美国Thermo Fisher公司;定量PCR试剂盒(FAST SYBR Mixture)购自生工生物工程(上海)有限公司。引物由上海英潍捷基(Invitrogen)公司合成,序列见表1。

Tab.1 Sequences of primers for qPCR表1 定量PCR引物序列
1.2 方法
1.2.1 INS-1细胞的培养 RPMI-1640含10%胎牛血清,β巯基乙醇(50µmol/L),青霉素100 U/L,链霉素100 mg/L,置于37℃、95%O2、5%CO2的细胞培养箱中。将细胞接种于6孔板,培养约24 h后,将Ad-abcb1b腺病毒和阴性对照病毒以浓度50×106/L感染INS-1细胞,4 h后换成正常培养基继续孵育44 h,预冷PBS洗2遍后收集细胞于1.5 mL EP管中,备用。
1.2.2 大鼠胰岛的摘取 取野生型和转基因SD大鼠各5只,腹腔注射10%水合氯醛1.5~2 mL麻醉大鼠后,取仰卧位将其四肢固定于手术台上。75%乙醇消毒皮肤后,取正中切口,暴露腹腔脏器。找到胆总管,分别在十二指肠乳头端及近肝门处予1号丝线结扎。股动脉放血处死大鼠,于胆总管近肝门处0.45 mm头皮针穿刺,向胰腺内灌注浓度为1 g/L胶原酶Ⅴ约10 mL,至胰腺完全膨胀,迅速分离胰腺,置于50 mL离心管中,37℃水浴20~25 min后,预冷Hank's液约35~40 mL终止消化,用力摇晃离心管,使胰腺组织成泥沙状,静置5 min(冰浴),待其分层后弃上层液体,加入35~40 mL预冷Hank's液,洗涤2次。混匀后取3~5 mL消化物于平皿中,体式镜下手工挑拣胰岛,置于装有Hank's液的1.5 mL EP管中,备用。
1.2.3 细胞、胰岛RNA萃取及基因水平测定 将收集的细胞和胰岛按E.Z.N.A.总RNA分离试剂盒说明书萃取总RNA,逆转录试剂盒逆转录成cDNA。逆转录条件:25℃5 min,42℃1 h,72℃5 min。定量PCR试剂盒扩增,扩增条件:95℃预变性3 min;95 ℃扩增30 s,55 ℃ 15 s,72 ℃ 15 s,共40个循环。熔解曲线分析:95℃ 5 s,65℃ 60 s,95℃1 s。根据qPCR得出的荧光曲线的Ct值,以 β-actin为内参,用2-ΔΔCt计结果,ΔCt=目的基因Ct值-β-actin Ct值,ΔΔCt=P-gp过表达组ΔCt值-对照组ΔCt值。实验结果以对照组的倍数表示。
1.3 统计学方法 统计分析采用GraphPad Prism 5进行数据分析。符合正态分布的计量资料以均数±标准差(±s)表示,2组之间均数比较采用两独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 P-gp过表达对INS-1细胞分化的影响 腺病毒感染48 h后,qPCR结果显示,与阴性对照组相比,P-gp过表达组Ngn3、Mafb表达量增加,而Mafa表达量明显减低,差异有统计学意义(P<0.01),见图1。
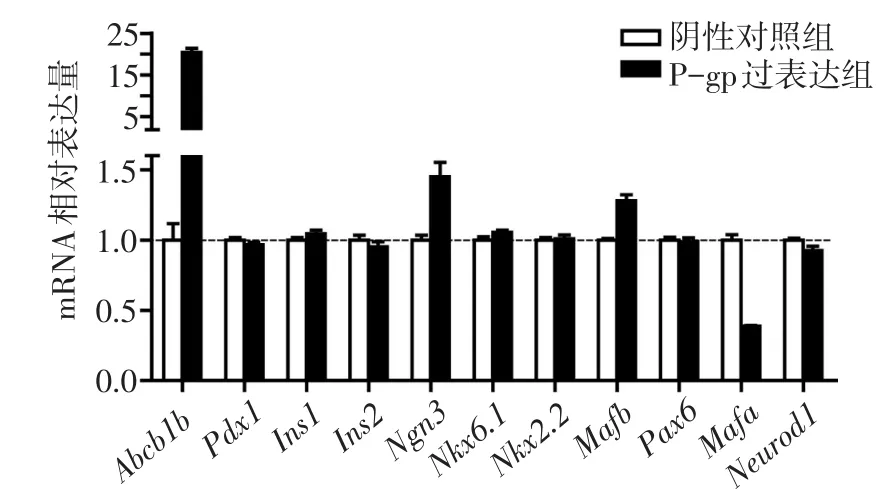
Fig.1 Effects of overexpression of P-gp on the differentiation of INS-1 cells图1 P-gp过表达对INS-1细胞分化的影响
2.2 P-gp过表达对胰岛β细胞分化的影响 qPCR结果显示,与野生型大鼠相比,P-gp过表达后,转基因大鼠胰岛组织中与胰岛β细胞分化相关的转录因子的mRNA表达量均无明显变化(P>0.05),见图2。
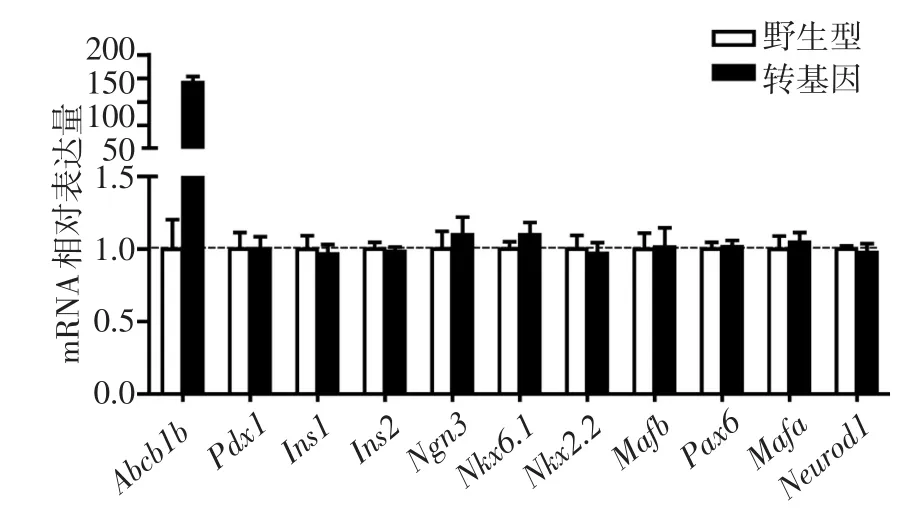
Fig.2 Effects of overexpression of P-gp on the differentiation of rat pancreatic β cells图2 P-gp过表达对胰岛β细胞分化的影响
3 讨论
3.1 P-gp过表达可能导致INS-1细胞去分化 胰腺的发生发展受多种因子的共同调控,Ngn3主要是在发育中的胰腺内表达,在其下游因子Pax-4、Mafa等的作用下,表达Ngn3的阳性细胞分化为成熟β细胞。Mafa和Mafb是分别特异存在于β细胞和α细胞的转录因子,有研究发现,Mafa基因敲除的小鼠表现为β细胞与α细胞的比率降低,谱系追踪发现一部分α细胞是由β细胞转化而来,并且发现基因敲除鼠胰岛内的Mafb、Ngn3的表达增多[6]。这一研究说明Mafa、Mafb、Ngn3对维持成熟β细胞的功能有重要作用。本研究结果显示,P-gp过表达后,INS-1细胞的Ngn3、Mafb表达增加,而Mafa表达减少,说明P-gp过表达可能导致INS-1细胞去分化;这与之前Samant等[7]的结果相似,他们认为抑制MDR1的表达可以促进前列腺上皮细胞的分化,即P-gp有抑制分化的作用。
3.2 体内P-gp过表达对大鼠胰岛β细胞的分化无影响 本研究表明,P-gp过表达后,大鼠胰岛组织内各基因表达水平无明显差异,推测是由于大鼠体内胰高血糖素肽-1(GLP-1)、胃泌素以及胰岛内α细胞等的作用,阻止了胰岛β细胞去分化,从而维持β细胞的正常表型和功能。有人将基因改造后能分泌GLP-1的人共生菌喂养糖尿病大鼠,发现GLP-1组糖尿病大鼠的血糖明显改善,小肠上皮细胞中出现分泌胰岛素的细胞,并且Mafa、Pdx1的表达增加[8]。说明GLP-1能促进肠上皮细胞转化为胰岛素样细胞。另一研究发现,糖尿病小鼠给予GLP-1干预后,与胰岛β细胞分化的有关基因,如Pdx1、Neurod等的表达升高[9]。这些结果均表明GLP-1能促进β细胞的分化。近年研究表明,GLP-1与胃泌素协同作用,共同促进、维持β细胞的功能和增殖。Suarez-Pinzon等[10]对糖尿病小鼠分别给予GLP-1、胃泌素、GLP-1+胃泌素后发现,与另外两组相比,GLP-1+胃泌素组能显著降低小鼠血糖,且β细胞质量增加,同时检测到胰腺导管来源的胰岛素阳性细胞,这一结果也被日本科学家证实[11]。有学者认为β细胞是由α前体细胞分化而来[12]。当β细胞受到损伤时,体内反馈系统激活,α细胞可以转分化成为β细胞,导致β细胞再生增加。有研究显示,在β细胞几乎被破坏5个月后,实验小鼠可以不再依赖胰岛素而存活,并且一部分小鼠血糖得到明显改善,同时β细胞质量较破坏初期增加数十倍,进一步溯源发现这些再生的细胞并不是仅存的β细胞的复制,而是由之前存在的α细胞转分化形成[13]。最近有一项研究证明分泌生长抑素的胰岛δ细胞与β细胞之间的旁分泌作用对维持血糖的稳定有重要作用,消除了δ细胞的新生小鼠发生了严重的低血糖并很快死亡[14]。
综上,笔者认为INS-1细胞内P-gp过表达可能使其去分化,而大鼠胰岛β细胞中P-gp过表达对其分化无明显影响。转基因大鼠胰岛内Mafa、Mafb、Ngn3等因子表达水平与对照组相比无明显差异,笔者认为可能是由于体内各种激素、体液因子、旁分泌以及细胞之间复杂的关系所导致的,其具体的机制有待进一步研究。
