Aurora-B介导NPM1蛋白磷酸化促进骨肉瘤细胞恶性表型的体外研究
2019-02-14皮闻森刘家明黄山虎刘志礼
皮闻森,刘家明,黄山虎,刘志礼
骨肉瘤(OS)是最常见的原发性恶性骨肿瘤,多发于儿童和青少年。虽然新辅助化疗的出现使得原发患者的生存率有所提高(55%~80%),但发生肺部转移的患者5年生存率仍低于20%,其中肺转移是OS患者的主要死亡原因[1]。因此,阐明OS转移的分子机制,可为OS转移的防治提供有效的策略甚至靶点,对提高患者生存率非常必要。激光激酶-B(Aurora-B,又称AURKB),是一种在多种恶性肿瘤中高表达的癌基因,与肿瘤发生、发展及转移密切相关[2]。本研究采用骨肉瘤143B、U2-OS细胞株,结合生物信息学探讨沉默Aurora-B介导NPM1蛋白磷酸化水平改变对骨肉瘤细胞迁移、侵袭和增殖能力的影响。
1 资料与方法
1.1 一般资料 人骨肉瘤细胞143B购自中国科学院上海细胞库,Aurora-B沉默慢病毒(LV/ShAurora-B)、NPM1过表达慢病毒(LV/NPM1)和阴性对照慢病毒(LV/negative)购自上海吉凯基因。DMEM培养液和胎牛血清购自美国Gibco公司。总蛋白提取试剂盒(BB-3101)购自BestBio公司。凝胶制备试剂盒(AR018)购自于BOSTER公司。Aurora-B、NPM1(nucleophosmin1)和磷酸化NPM1ser125单克隆抗体(兔抗人)购自美国Abcam公司。β-actin单克隆抗体(鼠抗人)、辣根过氧化物酶(HRP)标记山羊抗兔多克隆抗体和HRP标记山羊抗鼠多克隆抗体购自北京中杉金桥公司。
1.2 方法
1.2.1 生物信息学预测 通过癌症基因组图谱(TCGA)数据库(https://cancergenome.nih.gov/)查找NPM1在肉瘤中的表达水平以及预后情况;通过KinasePhos数据库(http://kinasephos.mbc.nctu.edu.tw/)预测NPM1的磷酸化情况,预测AURKB与NPM1之间的关系。
1.2.2 细胞培养和慢病毒转染 人骨肉瘤U2-OS细胞和143B细胞株用含15%胎牛血清的DMEM完全培养液培养,置于37℃、5%CO2的培养箱中培养。细胞分为LV/ShAurora-B组、NC(LV/negative)组、LV/ShAurora-B与LV/NPM1共转染组。依据吉凯公司提供的转染指南,分别转染143B与U2-OS细胞,继续培养72 h以后,用于后续实验。
1.2.3 Western blot检测Aurora-B、NPM1和pNPM1ser125蛋白表达 转染后消化、收集Lv/ShAurora-B组和NC组的细胞,提取细胞蛋白后应用BCA蛋白定量法测定蛋白含量。SDSPAGE分离蛋白,于冰上湿转,转膜后置于含5%BSA的TBST中封闭2 h,加入Aurora-B(1∶5 000),NPM1(1∶2 000),磷酸化NPM1ser125(1∶2 000)和β-actin(1∶2 000)一抗,4℃孵育过夜,TBST振荡洗膜10 min×3次,以封闭液稀释的HRP标记的山羊抗小鼠及山羊抗兔IgG二抗(1∶5 000)室温孵育1 h,TBST洗膜10 min×3次。于暗室中加入ECL显色液曝光,采用Image J进行灰度分析。
1.2.4 Wound healing法检测细胞迁移能力 取对数生长期的各组细胞,胰蛋白酶消化,以5×105个/mL细胞密度接种于6孔培养板,500µL/孔,常规孵育,直至细胞铺满,形成细胞单层。用200µL/移液器枪头沿培养板底部呈“一”字型划痕单层培养细胞,显微镜下(×200)观察初始划痕区并照相。吸取原有培养液,PBS清洗2次,去除被刮除的悬浮细胞,更换无血清的DMEM培养液,继续培养24 h并拍照(×200)。Image J 1.47 H软件计算细胞迁徙率[迁移率=(0 h的平均宽度-24 h的平均宽度)/0 h的平均宽度]。实验平行做3次。
1.2.5 CCK-8法检测细胞增殖能力 将转染后的U2-OS和143B细胞(3 000个/孔)分别接种在96孔培养板中培养。48 h后每孔加入10µL的CCK-8溶液,并在37℃下再温育2 h。用酶标仪测量在450 nm处光密度(OD)值。实验平行做3次。
1.2.6 Transwell invasion法检测细胞侵袭能力 将转染48 h的各组U2-OS、143B细胞消化,用无血清培养基重悬,调整细胞密度为1×105个/mL,分别取150µL细胞悬液接种于小室内,将小室放入含10%FBS的培养液(600µL/孔)中继续培养24 h。取出小室,吸弃上室液体,PBS漂洗2次,95%乙醇固定10 min,用棉签擦净小室膜上侧未迁移的细胞。4 g/L结晶紫染色20 min,PBS漂洗2次。倒置显微镜下(×200)随机读取10个视野,观察细胞穿膜情况并拍照。Image J 1.47 H软件计算穿膜细胞数。
1.3 统计学方法 采用SPSS 17.0统计软件对数据进行分析。符合正态分布的计量数据以均数±标准差(±s)表示,2组间比较采用t检验,多组间比较采用单因素方差分析,组间多重比较用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 生物信息学结果 通过TCGA数据库发现,NPM1在肉瘤中高表达(图1A),NPM1高表达的骨肉瘤患者预后较差(图1B);通过KinasePhos数据库库发现,NPM1存在丝氨酸和苏氨酸磷酸化位点(图1C),而Aurora-B是丝氨酸和苏氨酸激酶,因此Aurora-B与NPM1之间可能存在相互作用。
2.2 下调Aurora-B后检测Aurora-B、NPM1和pNPM1ser125蛋白的表达情况 2种细胞中,与NC组相比,LV/ShAurora-B组Aurora-B和pNPM1ser125蛋白水平降低(P<0.05),而NPM1蛋白的变化差异无统计学意义,见表1、图2。
Tab.1 Expressions of Aurora-B,NPM1 and pNPM1ser125 detected by Western blot assay表1 Western blot检测Aurora-B、NPM1和pNPM1ser125蛋白的表达 (n=3,±s)
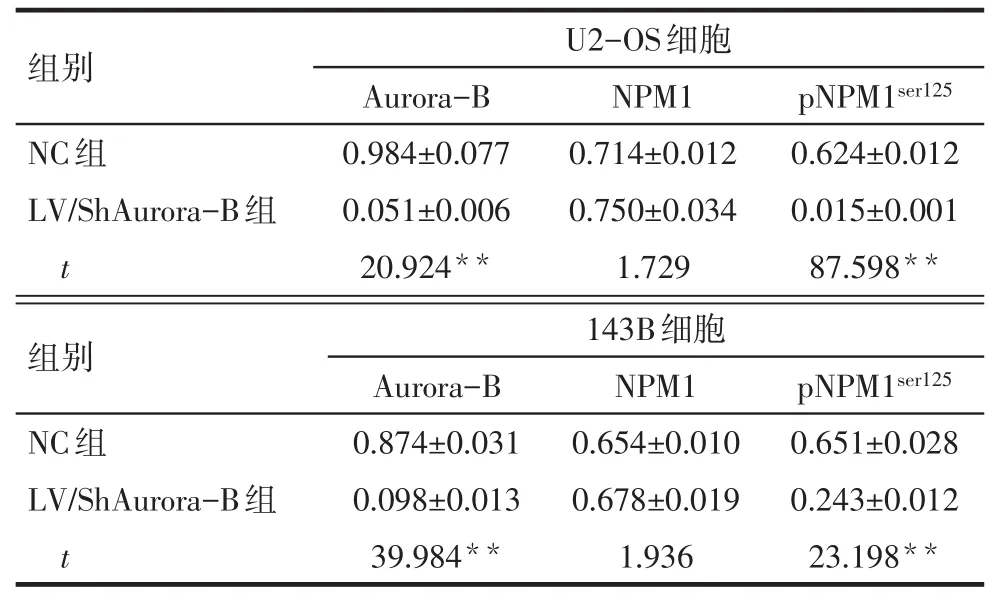
Tab.1 Expressions of Aurora-B,NPM1 and pNPM1ser125 detected by Western blot assay表1 Western blot检测Aurora-B、NPM1和pNPM1ser125蛋白的表达 (n=3,±s)
**P<0.01
组别U2-OS细胞Aurora-B NPM1pNPM1ser125 NC组LV/ShAurora-B组t 0.984±0.077 0.051±0.006 20.924**0.714±0.012 0.750±0.034 1.729 0.624±0.012 0.015±0.001 87.598**组别NC组LV/ShAurora-B组t 143B细胞Aurora-B 0.874±0.031 0.098±0.013 39.984**NPM1 0.654±0.010 0.678±0.019 1.936 pNPM1ser125 0.651±0.028 0.243±0.012 23.198**
2.3 各组骨肉瘤细胞的迁移情况比较 LV/ShAurora-B组迁移率均低于NC组(P<0.05),且共转染组中下调Aurora-B的迁移抑制被部分恢复(P<0.05),见表2。

Fig.1 The results of bioinformatics analysis图1 生物信息学分析结果
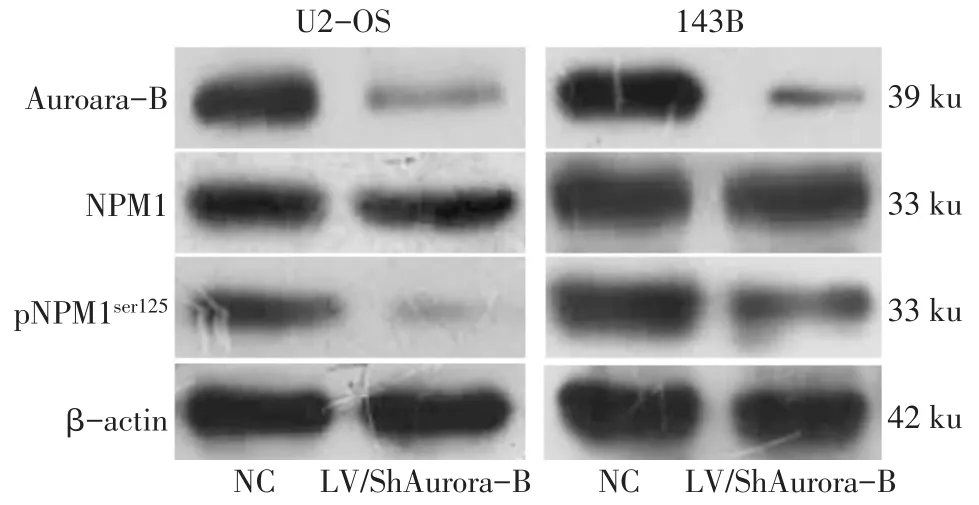
Fig.2 Expressions of Aurora-B,NPM1 and pNPM1ser125 detected by Western blot assay图2 Western blot检测Aurora-B、NPM1和pNPM1ser125蛋白的表达
Tab.2 The cell migration ability detected by Wound healing assay in OS cells表2 Wound healing实验检测骨肉瘤细胞的迁徙能力(n=3,%,±s)

Tab.2 The cell migration ability detected by Wound healing assay in OS cells表2 Wound healing实验检测骨肉瘤细胞的迁徙能力(n=3,%,±s)
*P<0.05,**P<0.01;a与NC组比较,b与LV/ShAurora-B组比较,P<0.05;表3、4同
组别NC组LV/ShAurora-B组共转染组F U2-OS细胞50.7±10.4 20.2±5.6a 35.1±4.7ab 12.983**143B细胞61.5±12.8 23.0±9.8a 42.5±2.6ab 12.448*
2.4 各组骨肉瘤细胞的增殖情况比较 143B和U2-OS细胞中,LV/ShAurora-B组增殖能力均低于NC组(P<0.05),且LV/ShAurora-B+LV/NPM1共转染组能部分恢复下调Aurora-B的增殖抑制(P<0.05),见表3。
Tab.3 The proliferation ability detected by CCK-8 assay in OS cells表3 CCK-8实验检测骨肉瘤细胞增殖能力(n=3,OD值,±s)
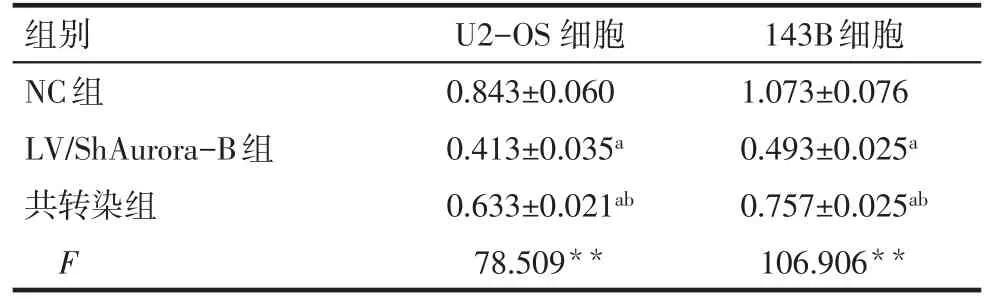
Tab.3 The proliferation ability detected by CCK-8 assay in OS cells表3 CCK-8实验检测骨肉瘤细胞增殖能力(n=3,OD值,±s)
组别NC组LV/ShAurora-B组共转染组F U2-OS细胞0.843±0.060 0.413±0.035a 0.633±0.021ab 78.509**143B细胞1.073±0.076 0.493±0.025a 0.757±0.025ab 106.906**
2.5 各组骨肉瘤细胞的侵袭能力比较 在2种细胞中,LV/ShAurora-B组侵袭细胞数均低于NC组(P<0.05),且LV/ShAurora-B+LV/NPM1共转染组能部分恢复下调Aurora-B的侵袭能力抑制(P<0.05),见表4、图4。
Tab.4 The invasion ability detected by Tanswell invasion assay in OS cells表4 Transwell invasion实验检测骨肉瘤细胞的侵袭能力(n=3,个/视野,±s)

Tab.4 The invasion ability detected by Tanswell invasion assay in OS cells表4 Transwell invasion实验检测骨肉瘤细胞的侵袭能力(n=3,个/视野,±s)
组别NC组LV/ShAurora-B组共转染组F U2-OS细胞155.000±14.526 82.333±22.745a 134.000±11.523a 14.613*143B细胞189.330±15.011 57.667±16.010a 120.667±13.051ab 63.997**

Fig.3 The cell migration ability detected by Wound healing assay in OS cells(×200)图3 Wound healing实验检测骨肉瘤细胞的迁徙能力(×200)

Fig.4 The cell invasion ability detected by Tanswell invasion assay in OS cells(crystal violet staining,× 200)图4 Transwell invasion实验检测骨肉瘤细胞的侵袭能力(结晶紫染色,×200)
3 讨论
Aurora-B是Aurora家族3个成员之一,其功能是参与调节中心体和微管的功能、保证染色体的精确分离和胞浆的有效分离、着丝粒的复制、双极纺锤体的形成以及监测纺锤体检测点的忠实性等[3]。它们通常在G2/M期达到高峰,是调节细胞周期由G2期向M期进展的关键因子。Aurora-B基因定位在17p13,处在易位、缺失或扩增活跃的染色体区段,意味着它们具有天然的不稳定性。有研究显示,Aurora-B通过激活蛋白激酶B(protein kinase B,AKt)/哺乳动物雷帕霉素靶点(mammalian target of rapamycin,mTOR)信号传导途径来促进淋巴瘤细胞存活和增殖[4]。本课题组前期研究表明,Aurora-B通过激活磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/AKt/核转录因子kappa β(nuclear factor kappa beta,NF-κβ)信号通路促进骨肉瘤恶性表型[5]。本次研究发现,PI3K/AKt抑制并不能完全逆转Aurora-B介导的骨肉瘤侵袭转移,提示Aurora-B所介导的骨肉瘤侵袭转移可能还涉及其他分子机制。因此,进一步探讨Aurora-B介导骨肉瘤侵袭转移的分子机制显得十分必要和重要。
NPM1是一种具有高活性的核仁蛋白,在核糖体蛋白组装、染色质重塑以及DNA修复、复制和转录中发挥积极作用[6-8]。磷酸化、乙酰化和泛素化等翻译后修饰可使生成的NPM1定位于不同的亚细胞区域,从而行使不同的功能。越来越多的证据表明,NPM1是一种直接参与癌症发病机制的核仁蛋白。在包括前列腺癌、血液肿瘤和高级浆液性卵巢腺癌等多种恶性肿瘤中发现,NPM1的高表达且与肿瘤进展和抗药性有关[9]。本研究通过生物信息数据库查找,显示NPM1在肉瘤中高表达以及NPM1高表达的患者预后较差,并且Aurora-B与NPM1之间可能存在磷酸化作用。以此为基础,通过体外实验,进一步证实了下调Aurora-B后磷酸化NPM1ser125蛋白的表达降低,而非磷酸化NPM1蛋白的表达不变。以上结果表明Aurora-B能够介导NPM1的磷酸化。然而,Aurora-B介导的NPM1蛋白磷酸化并不一定对骨肉瘤细胞恶性表型产生效应,为此,进一步行体外恶性表型的验证显示,沉默Aurora-B后骨肉瘤的侵袭、增殖和迁移能力均受到抑制,且沉默Aurora-B后同时过表达NPM1发现,下调Aurora-B对骨肉瘤侵袭、转移和增殖的抑制作用被部分缓解,这证实了Aurora-B能够通过介导NPM1蛋白磷酸化促进骨肉瘤细胞恶性表型,但是NPM1介导骨肉瘤恶性表型改变的具体分子机制仍未可知。
Chen等[10]研究显示,NPM1通过影响Akt活性,从而在乳腺癌中发挥抗凋亡作用。另外,研究证实RNA干扰(RNAi)沉默NPM1基因能显著降低前列腺癌细胞中细胞外调节蛋白激酶1/2(extracellular regulated protein kinases 1/2,ERK1/2)的磷酸化水平[11]。ERK1/2的磷酸化可促使与NF-κβ相结合的Iκβα发生降解,使定位于胞浆的NF-κβ转移至核内[12-13];NF-κβ的核内移位可促使基质金属蛋白酶-2(matrix metalloprotein-2,MMP-2)、MMP-9等与肿瘤转移相关的基因表达上调,促进包括骨肉瘤在内的多种肿瘤的细胞侵袭和转移[14-15]。因此,在骨肉瘤细胞中,Aurora-B是否通过NPM1/ERK/NF-κβ信号轴促进骨肉瘤恶性表型亦是后续有意义的研究方向。
综上所述,Aurora-B通过介导NPM1蛋白磷酸化促进骨肉瘤细胞恶性表型。但本研究仅做了Aurora-B沉默,且缺乏体内实验证实这一结论。另外,NPM1介导骨肉瘤恶性表型改变的具体分子机制亦有待后续进一步研究。
