胰腺癌细胞可溶性分泌物对小鼠脂代谢的影响
2019-02-14谢俊木子田文聪袁向飞胡立娟王丰
谢俊木子,田文聪,袁向飞,胡立娟,王丰△
癌症相关恶病质是由恶性肿瘤导致的一类代谢综合征,特征包括能量消耗增加、肝脏糖异生增多、脂肪分解加强、进食量减少、体质量下降等,极大地影响癌症患者的生活质量及生存率,其中胰腺癌患者并发恶病质的比例很高,为83%~87%[1]。瓦博格效应是指发生在癌细胞内的高糖酵解现象,与癌症患者恶病质现象密切相关,其发生使得患者体内脂代谢加强,导致脂肪储存减少,从而引发体质量下降[2-6]。通过对小鼠注射肿瘤细胞或接种瘤块等方式构建不同肿瘤的恶病质模型,也可观察到明显的脂肪含量下降、脂肪分解增强的现象[7-10]。另外在恶病质研究中发现,肿瘤细胞的分泌物,如肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、干扰素-γ(IFN-γ)等过量分泌也对代谢失衡有着促进作用[11-12]。值得注意的是,当肿瘤细胞分泌物作用在其他组织上的同时,其他组织如脂肪组织也能释放数种脂肪因子作用在肿瘤组织上,在这种相互作用下,体内试验无法将肿瘤细胞分泌物独立出来以观察其对脂肪组织代谢的影响。因此,本研究通过对BALB/c小鼠注射胰腺癌条件培养基,观察胰腺癌细胞系条件培养基中的可溶性分泌物对小鼠脂肪代谢的改变以及不同使用剂量的肿瘤细胞可溶性分泌物对脂代谢的影响。
1 资料与方法
1.1 一般资料 67只雄性BALB/c小鼠,均为4~5周龄,SPF级,体质量20~22 g,购自北京华阜康生物科技股份有限公司,并饲养于天津市南开医院实验动物中心,垫料及饲料均由该实验中心提供。胰腺癌细胞系Panc-1(#CC2401)、MiaPaCa-2(#CC2408)、BxPC-3(#CC2405)均购自中国科学研究院上海细胞库。DMEM培养基、RPMI-1640培养基购自美国Gibco公司,胎牛血清(FBS)购自美国HyClone公司。三酰甘油和肝糖原检测试剂盒购自南京建成生物工程研究所,葡萄糖检测试剂盒购自上海荣盛生物药业有限公司;小鼠胰岛素酶联免疫吸附(ELISA)测定试剂盒购自武汉伊莱瑞特生物科技股份有限公司;Western blot检测中使用的兔源ATGL单克隆抗体购自美国Epitomics公司,兔源β-actin单克隆抗体购自Santa Cruz公司,羊抗兔二抗购自KPL公司,ECL发光液(WBKLS0500)购自Merck Millipore公司。
1.2 胰腺癌细胞条件培养基制作 细胞被置于直径10 cm的培养皿中培养,Panc-1、MiaPaCa-2细胞培养皿中加入10 mL DMEM(含10%FBS+1%双抗)培养基,BxPC-3细胞培养皿中加入10 mL RPMI-1640(含10%FBS+1%双抗)培养基,所有细胞均培养于37℃、95%空气+5%CO2恒温培养箱孵育,2~3 d换一次液。待细胞融合度达到90%时,弃去原培养基,加入10 mL无血清的DMEM或RPMI-1640的培养基,继续37℃恒温孵育24 h后,将培养基分别收集,予以室温下离心(1 000 r/min,5 min)后,去除沉淀,放置于-20℃冰箱保存。
1.3 动物实验 小鼠在饲养时,室内光照黑暗各12 h交替,小鼠可自由获得食物(标准饲料)和水,垫料每周更换2次。本实验包括2个子实验(实验A、实验B先后进行),注射期均为7 d,第8天将小鼠处死,具体方法为给予小鼠10%水合氯醛腹腔注射麻醉,经眼内眦留取全部血液,常温下离心(3 000 r/min,10 min)后,取上层血浆,摘除小鼠的腹股沟脂肪垫(BAT)、附睾脂肪垫(WAT),将所有留存下的标本置于-80℃冰箱。
1.3.1 胰腺癌细胞可溶性分泌物对小鼠脂肪代谢的改变(实验A) 通过对小鼠注射3种胰腺癌细胞系(Panc-1、MiaPaCa-2、BxPC-3)的条件培养基以观察胰腺癌细胞可溶性分泌物对小鼠脂肪代谢的改变,研究其改变在胰腺癌细胞中的普遍性。取雄性BALB/c小鼠37只,适应性饲养3 d之后,按照随机数字表法分入4组中,分别为对照组(n=14)、Panc-1组(n=10)、MiaPaCa-2组(n=6)和BxPC-3组(n=7)。每组小鼠连续7 d接受培养基的皮下注射,每日两次(9:00 am,3:00 pm),每次1.0 mL,其中对照组注射正常DMEM培养基,剩余3组则注射Panc-1、MiaPaCa-2和BxPC-3细胞条件培养基。
1.3.2 不同剂量的胰腺癌MiaPaCa-2细胞可溶性分泌物对脂代谢的影响(实验B) 仅使用来自MiaPaCa-2细胞条件培养基,研究不同剂量的胰腺癌细胞可溶性分泌物对脂代谢的影响。雄性BALB/c小鼠30只,随机分为3组,分别为对照组(n=10)、1/2 M组(n=10)、M组(n=10),注射方法同1.3.1对照组所有小鼠注射1.0 mL DMEM培养基,1/2 M组予以每只每次0.5 mL MiaPaCa-2细胞条件培养基,M组则予以1 mL MiaPaCa-2细胞条件培养基。余处理同1.3.1。
1.4 观察指标 (1)进食量与体质量。于每日第一次注射前(9:00 am)记录小鼠食槽内饲料质量(食物质量)和体质量,记录时长为注射期第1天到第8日处死前,平均进食量=(后一日食物质量-前一日食物质量)/单笼小鼠数,体质量和食物质量共记录8次,得到7次平均进食量的记录,每日均进行组间比较。通过对体质量和平均进食量的检测观察胰腺癌可溶性分泌物对小鼠体质量及食欲的影响。(2)血浆及肝脏分析。对其血浆及肝脏组织进行分析,观察其脂肪代谢相关指标是否发生了改变。(3)脂肪组织分析。对BAT、WAT予以称质量,提取脂肪组织蛋白检测脂肪三酰甘油脂肪酶(ATGL)蛋白表达水平,观察脂肪垫质量和ATGL蛋白表达水平变化。
1.5 ELISA检测血浆胰岛素含量 将预制好的8个标准品工作液和血浆样品各吸取100µL,分别加入ELISA酶标板内,覆膜后置于37℃孵育90 min。余按照产品说明书逐步操作。酶标仪被应用于对酶标板内液体吸光度的检测,波长为450 nm,读取每个孔的光密度(OD)值后,根据说明书利用标准孔建立曲线,通过血浆样品孔的OD值计算出血浆中胰岛素浓度。
1.6 检测血浆葡萄糖含量 取小鼠血浆样本、蒸馏水和校准品(5.55 mmol/L)各2µL,加入96孔板中,每孔中加入200µL提前配制好的工作液,充分混匀孔中的液体,37℃恒温水浴15 min,应用酶标仪(波长505 nm)读取每孔中的OD值。葡萄糖含量(mmol/L)=样本管OD值/校准管OD值×校准液浓度(mmol/L)。
1.7 检测肝脏中肝糖原含量 将每只小鼠的肝脏样本(约20 mg)及3倍体积的碱液(试剂盒提供)加入EP管中,置于沸水中煮20 min左右,直至所有肝脏组织溶解。按照说明书,将上述原液稀释100倍,配制1%肝糖原检测液和显色液,在96孔板中分别加入相应体积的双蒸水、糖原标准液(0.1 g/L)和10倍稀释的1%肝糖原检测液以及显色液,充分混匀后再次放入沸水中煮5 min,冷却至室温后应用酶标仪(波长620 nm)读取每孔的OD值。糖原含量(mg/g组织)=测定管OD值/标准管OD值×标准管含量(0.01 mg)×1 000/1.11。
1.8 检测血浆中三酰甘油含量 分别取小鼠的血浆样本2.5µL、蒸馏水和校准品(2.26 mmol/L)加入96孔板内,每孔内再加入250µL工作液。充分混匀孔中液体后,将96孔板置于37℃恒温水浴中10 min,应用酶标仪(单波长510 nm)测定各孔的OD值。三酰甘油含量(mmol/L)=(样本OD值-空白OD值)/(校准OD值-空白OD值)×校准品浓度(mmol/L)。
1.9 Western blot检测ATGL蛋白表达水平 将WAT和BAT组织进行粉碎,用RIPA蛋白裂解液提取蛋白,将标本在10%的聚丙烯酰氨凝胶中进行电泳分离,然后利用PVDF膜对蛋白进行湿转法转膜,转膜全程处于冰浴中。转膜后的PVDF膜浸泡于5%脱脂牛奶中,置于水平摇床上低速孵育3 h,孵育结束后予以TBST溶液清洗5 min,再根据分子质量适当剪裁,分别放入相应的ATGL(1∶1 000)和β-actin(1∶5 000)一抗中,4℃孵育过夜。次日用TBST溶液洗膜(10 min×3次)后,放入羊抗兔二抗(1∶10 000)中置于水平摇床上低速孵育1 h,TBST溶液充分洗膜,最后在暗室中应用ECL法化学发光法显影,Quantity One软件进行图像处理并计算相对表达量。
1.10 统计学方法 采用SPSS 25.0对数据进行统计分析。符合正态分布的计量资料以±s表示,多组间比较采用单因素方差分析,方差齐者两两比较使用LSD-t法,方差不齐者采用Dunnett's T3法,P<0.05为差异有统计学意义。
2 结果
2.1 胰腺癌细胞可溶性分泌物对小鼠脂肪代谢的改变(实验A)
2.1.1 进食量和体质量 第1天注射后小鼠的进食量均有不同程度的下降,注射Panc-1条件培养基组小鼠的平均进食量下降趋势较为明显,之后随着对注射的逐步适应,进食量逐渐恢复趋于稳定。注射前半期小鼠的体质量逐渐下降,在第3或第4天达到最低值,随后逐渐回升,其中Panc-1组的体质量在注射第4天较对照组出现明显下降(P<0.05),见图1。
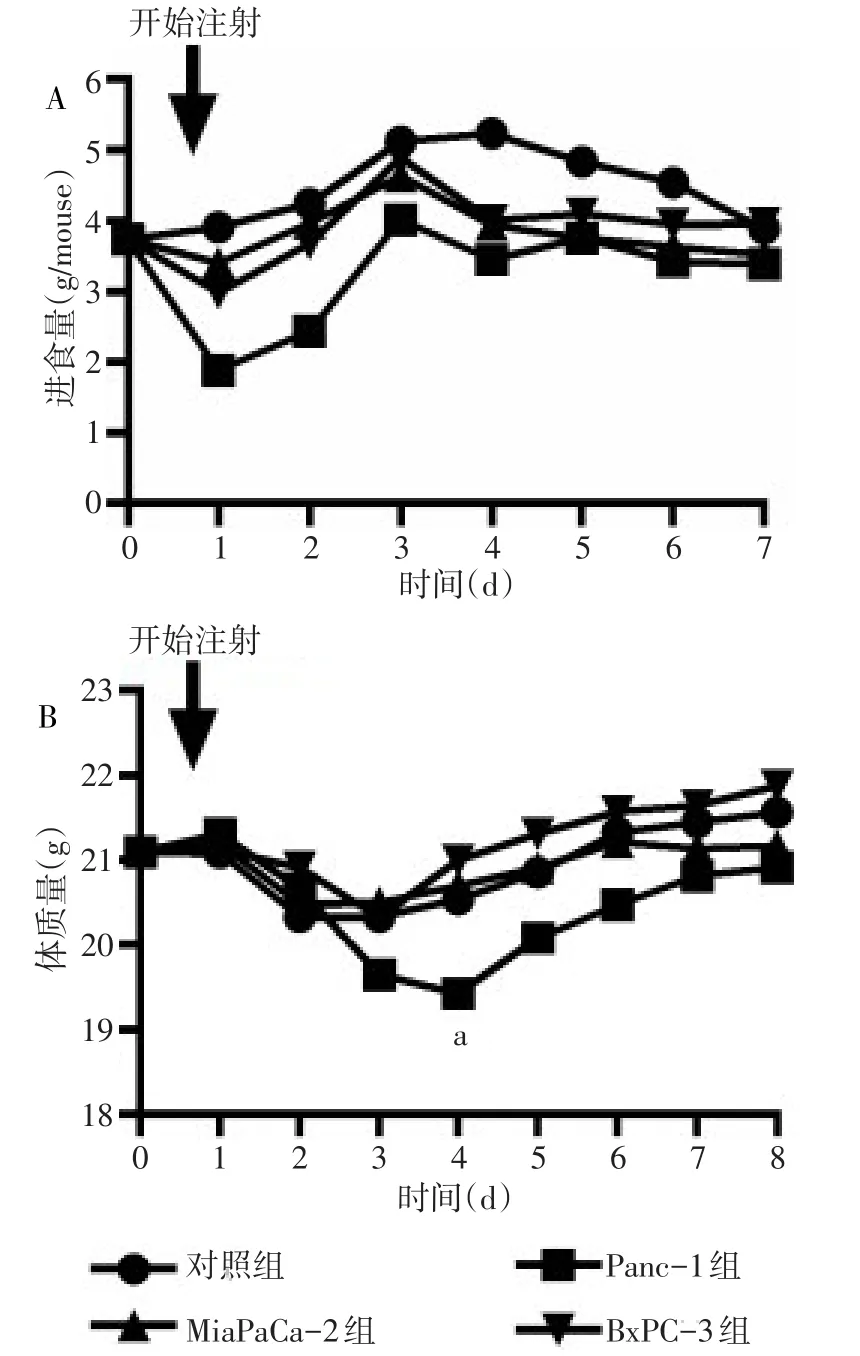
Fig.1 Changes of food intake and body weight in mice after injecting three pancreatic cancer cell secretions图1 注射3种胰腺癌细胞分泌物后小鼠进食量及体质量变化
2.1.2 血浆及肝脏分析 与对照组相比,MiaPaCa-2组和BxPC-3组血浆胰岛素、血糖水平升高,肝糖原、三酰甘油水平下降(P<0.05),Panc-1组与对照组比较仅三酰甘油水平下降(P<0.05),其他各指标差异均无统计学意义,见表1。
2.1.3 脂肪组织分析 MiaPaCa-2组和BxPC-3组较对照组 BAT、WAT质量均有增加(P<0.05)。Western blot结果显示,3个胰腺癌细胞注射组的BAT和WAT中ATGL蛋白表达水平较对照组均不同程度下降(P<0.05),见表2、图2。
Tab.1 Analysis of data from plasma and liver after injecting three pancreatic cancer cell secretions表1 注射3种胰腺癌细胞分泌物后小鼠血浆及肝脏分析(±s)
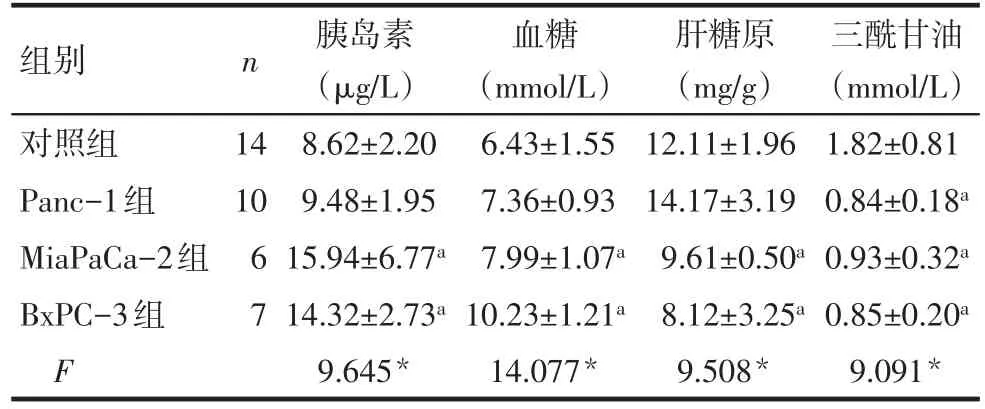
Tab.1 Analysis of data from plasma and liver after injecting three pancreatic cancer cell secretions表1 注射3种胰腺癌细胞分泌物后小鼠血浆及肝脏分析(±s)
*P<0.05;a与对照组相比,P<0.05;表2同
组别对照组Panc-1组MiaPaCa-2组BxPC-3组F n 14 10 67胰岛素(µg/L)8.62±2.20 9.48±1.95 15.94±6.77a 14.32±2.73a 9.645*血糖(mmol/L)6.43±1.55 7.36±0.93 7.99±1.07a 10.23±1.21a 14.077*肝糖原(mg/g)12.11±1.96 14.17±3.19 9.61±0.50a 8.12±3.25a 9.508*三酰甘油(mmol/L)1.82±0.81 0.84±0.18a 0.93±0.32a 0.85±0.20a 9.091*
Tab.2 Analysis of data from adipose tissues after injecting three pancreatic cancer cell secretions表2 注射3种胰腺癌细胞分泌物后小鼠脂肪组织分析(±s)
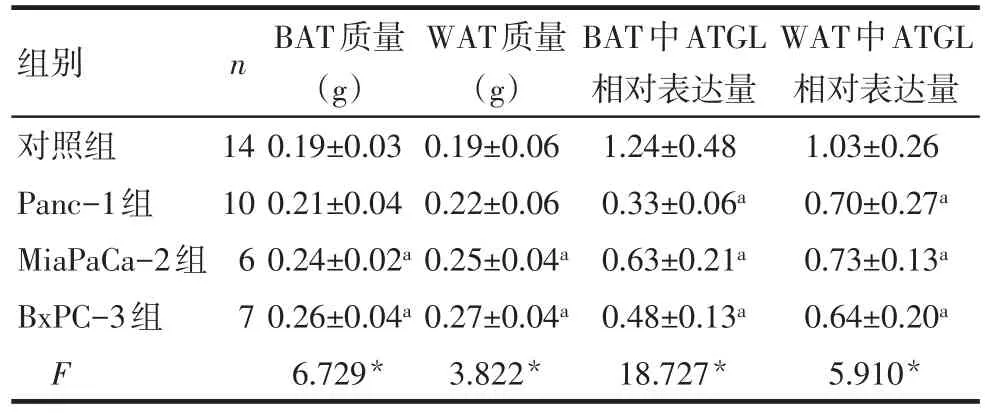
Tab.2 Analysis of data from adipose tissues after injecting three pancreatic cancer cell secretions表2 注射3种胰腺癌细胞分泌物后小鼠脂肪组织分析(±s)
组别对照组Panc-1组MiaPaCa-2组BxPC-3组F n 14 10 67 BAT质量(g)0.19±0.03 0.21±0.04 0.24±0.02a 0.26±0.04a 6.729*WAT质量(g)0.19±0.06 0.22±0.06 0.25±0.04a 0.27±0.04a 3.822*BAT中ATGL相对表达量1.24±0.48 0.33±0.06a 0.63±0.21a 0.48±0.13a 18.727*WAT中ATGL相对表达量1.03±0.26 0.70±0.27a 0.73±0.13a 0.64±0.20a 5.910*
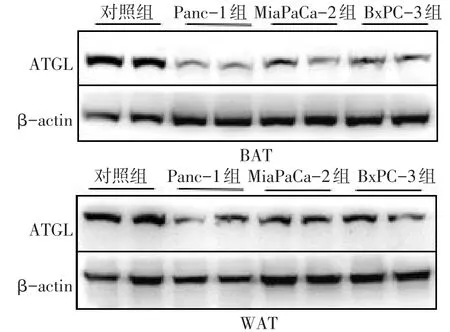
Fig.2 The changes of ATGL protein expression after injecting three pancreatic cancer cell secretions图2 注射3种胰腺癌细胞分泌物后ATGL蛋白表达变化
2.2 不同使用剂量的胰腺癌MiaPaCa-2细胞可溶性分泌物对脂代谢的影响(实验B)
2.2.1 血浆及肝脏分析 1/2 M组和M组较对照组血浆胰岛素水平均上升(P<0.05),M组上升更明显,且M组中血糖含量较对照组上升(P<0.05)。M组中肝糖原和血浆三酰甘油含量较对照组和1/2 M组均减少(P<0.05),见表3。
Tab.3 Analysis of data from plasma and liver after injecting different doses of cancer cell secretions表3 注射不同剂量的肿瘤分泌物后小鼠血浆及肝脏分析 (±s)
Tab.3 Analysis of data from plasma and liver after injecting different doses of cancer cell secretions表3 注射不同剂量的肿瘤分泌物后小鼠血浆及肝脏分析 (±s)
*P<0.05;a与对照组相比,P<0.05;b与1/2 M组相比,P<0.05;表4同
组别对照组1/2 M组M组F n 10 10 10胰岛素(µg/L)7.90±2.55 14.96±5.35a 17.33±7.57a 7.800*血糖(mmol/L)5.69±1.35 6.43±1.46 7.51±1.29a 4.492*肝糖原(mg/g)15.31±5.55 15.40±4.61 8.17±3.57ab 7.963*三酰甘油(mmol/L)1.98±0.67 1.86±0.57 1.21±0.44ab 5.216*
2.2.2 脂肪组织分析 1/2 M组和M组的BAT和WAT质量均较对照组增加(P<0.05),见表 4。Western blot结果显示,M组BAT和WAT中ATGL蛋白表达水平较对照组显著下降(P<0.05),见表4、图3。
Tab.4 Analysis of data from adipose tissues after injecting different doses of cancer cell secretions表4 注射不同剂量的肿瘤分泌物后小鼠脂肪组织分析(±s)
Tab.4 Analysis of data from adipose tissues after injecting different doses of cancer cell secretions表4 注射不同剂量的肿瘤分泌物后小鼠脂肪组织分析(±s)
组别对照组1/2 M组M组F n 10 10 10 BAT质量(g)0.21±0.04 0.26±0.04a 0.25±0.04a 4.017*WAT质量(g)0.27±0.02 0.33±0.06a 0.32±0.04a 4.243*BAT中ATGL相对表达量1.29±0.22 0.94±0.32 0.43±0.13a 33.485*WAT中ATGL相对表达量1.20±0.30 1.01±0.52 0.52±0.23a 8.681*
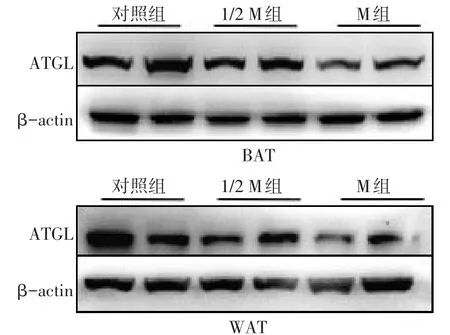
Fig.3 The changes of ATGL protein expression after injecting different doses of cancer cell secretions图3 注射不同剂量的肿瘤分泌物后ATGL蛋白表达变化
3 讨论
目前,癌症相关恶病质的发病机制尚未被完全阐明,但共识是,其发生是一个复杂的病理过程,伴有代谢及体液改变、厌食、乏力等现象,胰腺癌以其极高的恶病质发生率成为诸多癌症恶病质研究者关注的重点[13-14]。
胰岛素是人体内调控代谢的一种重要激素,可调节葡萄糖代谢,同时刺激脂肪生成和抑制脂肪分解,恶病质发生时,机体长期暴露在促炎因子如TNF-α、IL-6等中,使得代谢平衡被打乱,胰岛素敏感性下降,随之出现胰岛素抵抗现象,胰腺癌患者中胰岛素抵抗的高发推测与肿瘤分泌的某些蛋白如胰淀素等有关[15-16]。此时由于胰岛素敏感性降低,使得血浆中胰岛素水平升高,肝脏中糖原分解增强,血浆葡萄糖水平上升。研究表明,体内脂肪参数的改变与胰岛素信号通路密切相关,当胰岛素抵抗发生时,同时可观察到脂肪生成被抑制且储存量减少,脂肪分解加强[17-18]。本实验中,MiaPaCa-2 组和BxPC-3组注射胰腺癌细胞条件培养基的小鼠体内可见显著的胰岛素抵抗现象,即胰岛素和血糖均显著升高,甚至比荷瘤鼠中[10]更明显,且高注射剂量引起的效能更显著,这提示胰岛素抵抗不论胰腺癌细胞存在与否均可被观察到。
另外,脂肪组织曾经被认为是一个惰性组织,如今多定义其是一个大型的具有清晰解剖结构、并能与身体其他区域交互作用的内分泌器官[19-20]。恶病质时脂肪的流失与脂肪动员增加、脂肪氧化增加、脂质生成和储存减少等有关,而由脂肪组织表达的ATGL与脂肪代谢直接关联,其表达水平与脂肪分解程度呈正相关性,通过观察ATGL可以判断脂肪组织中三酰甘油分解情况。有研究证实,ATGL敲除能阻止癌症相关恶病质的进展[21-22]。本实验通过对ATGL的表达检测显示,小鼠体内脂肪分解反而减弱,且MiaPaCa-2组和BxPC-3组中BAT和WAT质量较对照组增加,提示脂肪储存增加。Panc-1组BAT和WAT质量无明显增加,推测其原因可能是由于饥饿导致了脂肪分解加强,抵消了部分条件培养基带来的特异效应[23]。不同于肿瘤恶病质时期,瓦博格效应引起的脂肪分解增强可导致脂肪组织储存减少。本研究显示,与对照组相比,Panc-1组、MiaPaCa-2组和BxPC-3组中ATGL蛋白表达水平下降,且BAT和WAT质量增加,提示机体脂肪分解减弱,且高注射剂量能引起更大的效能,说明肿瘤恶病质时期脂肪分解增强这一效应需要活的癌细胞的存在,而在胰腺癌分泌物中可能存在某些物质引起脂肪分解的减弱。另外,Panc-1组尽管未见胰岛素抵抗现象,但与另外两种胰腺癌细胞注射组一样,均有脂肪分解减弱的现象,证明由癌细胞可溶性分泌物引起的脂解下降与同样由其引起的胰岛素抵抗现象是相对独立存在的。
