钙信号在酸刺激促进Barrett食管发生中的作用研究
2019-02-12徐靖宇
谢 睿,徐靖宇
(遵义医科大学附属医院 消化内科,贵州 遵义 563099)
Barrett食管(Barrett's esophagus,BE)是临床上一种常见的食管疾病,最主要的症状有反酸、胃灼热、胸骨后疼痛、吞咽困难等,其病理特点是食管下段复层鳞状上皮被单层柱状上皮替代[1]。BE作为食管腺癌最重要的癌前病变,与食管腺癌的发生密切相关,多中心研究证实BE患者食管腺癌的发病危险性是正常人的30~50倍[2-3]。因此如果能及时防治BE的发生,就可能从源头降低食管腺癌的发病率。
目前已知的Barrett食管的致病因素众多,但大量的临床研究证据表明酸暴露刺激引起的食管粘膜微环境改变与Barrett食管的发生最为密切。已有报道证实胃食管反流性疾病引起的胃酸刺激会导致细胞内的pH降低,减少细胞程序性死亡,增加细胞的增殖,促进食管粘膜的癌变过程。Triadafilopoulos等[4]亦发现在给予BE患者质子泵抑制剂治疗后,可以显著抑制其肠化上皮的异常增殖并降低BE患者食管癌的发生率,提示酸暴露刺激在Barrett食管发生发展中的重要地位。近年来相关机制研究发现盐酸刺激正常食管上皮细胞的过程中通常伴随着细胞内钙的增高,表明细胞内钙的变化有可能参与上述调控过程,但具体的调控途径尚不完全清楚[5],已知在正常食管粘膜-BE-食管腺癌的演变过程中,尾型同源盒转录因子-2(Caudal-related homeobox transcription factor-2,CDX2)基因至关重要, CDX2作为一种肠型分化的标志物和核心分子,在胃上皮的研究中已证实参与胃粘膜上皮肠化生过程的调控,而近年来研究发现CDX2亦是Barrett食管发生过程中重要的下游靶基因,CDX2能通过与众多肠上皮特异性基因或核转录因子(MUC2、Villin,KLF4等)协同作用,诱导食管粘膜肠化生作用。因此,本研究拟从分子和功能调控两方面阐明钙信号通过影响肠型分化的标志物CDX2促进Barrett食管发生发展的重要作用,以期为以Barrett食管的防治寻找新的靶点。
1 材料与方法
1.1 材料 正常食管上皮细胞株HEEC购于中科院上海细胞库,免疫组化Barrett食管标本来源于遵义医科大学附属医院病理科诊断为Barrett食管的食管标本(25例)。正常食管组织标本来源于健康自愿者于遵义医科大学附属医院消化内镜室内镜下所取食管标本(25例)。激光共聚焦实验所用的Nigericin和细胞内钙荧光探针Frua-2AM购于EIPA(美国Sigma公司)和Intergone公司;10%胎牛血清、1640培养基及胰酶购于美国GIBCO公司;细胞培养所用二氧化碳CO2培养箱(型号3131)购于美国Thermo公司;激光扫描共聚焦显微镜均购于德国Leica公司;CDX2抗体及β-actin抗体均购于Abcam公司。
1.2 方法
1.2.1 HEEC细胞培养与分组 HEEC于5%的二氧化碳CO2、37℃培养箱中培养,采用含有10%胎牛血清的RPMI1640培养基(含有100 U/L青霉素、100 μg/L链霉素的双抗),每1~2天用含0.02% EDTA和0.25%胰蛋白酶溶液消化并传代。将传代后的HEEC细胞均匀分配到3个培养皿中继续培养,待细胞密度约为80%时分别予以pH7.4培养基(对照组)、pH5.5培养基、pH5.5培养基+BAPTA-AM处理24 h。
1.2.2 免疫组化检测正常食管和Barrett食管的CDX2表达 标本脱蜡后将脱蜡后的玻片放置于3%双氧水中作用10 min,再放置于PBS液中洗涤10 min。将玻片置于0.01 mol/L(pH=6.0)的枸橼酸盐中,置于微波炉中高火加热2×10 min,待其自然冷却后,将玻片置于PBS中洗涤1次,5 min。,将稀释好的一抗(1∶50)滴加在组织上并使其完全覆盖放入湿盒中,4℃孵育过夜。去除一抗,将玻片用PBS液洗涤3×10 min,然后滴加二抗(抗一抗来源的),使其覆盖于组织表面,室温放置30 min。DAB显色,结果运用IPP软件统计阳性信号值。
1.2.3 Western-blot技术检测HEEC细胞的CDX2表达 用蛋白裂解液提取细胞总蛋白,RCDC 法检测蛋白浓度,经5%的浓缩胶和10% 的分离胶SDS-PAGE 电泳,每孔上样量为40 μg总蛋白。浓缩胶60 V 电泳1 h,分离胶100 V电泳2 h,常规湿法转膜120 min,5%的BCA 封闭1 h,一抗孵育4℃过夜(CDX2抗体1∶1 000,β-actin抗体1∶5 000),二抗室温孵育2 h,(二抗稀释比例:山羊抗鼠1∶5 000,山羊抗兔1∶10 000) ,ECL 化学发光,凝胶成像系统显影。
1.2.4 激光共聚焦显微镜检测HEEC细胞内Ca2+动态变化 预先将载玻片在酒精内浸泡24 h,于紫外灯下照射15 min后置于24 孔板内,将细胞接种于24孔板内后培养1~2d备用,成功爬片后开始实验,实验时用按比例配置的PSS 液(含140 mM Na+、5 mM K+、2 mM Ca2+、149 mM Cl-、10 mM HEPES和10 mM葡萄糖,pH 7.4)漂洗3次,加入2 μL终浓度为10 μmol /L 的Frua-2AM,室温避光孵育60 mim,孵育结束再用PSS液漂洗3 次(10 min /次) ,然后将长有HEEC细胞的盖玻片置于倒置荧光显微镜台上的标准灌注室中,调整共聚焦激发波长488 nm,发射波长527 nm 探测荧光发射,数据采集间隔时间为5 s,扫描时间为20 mim,动态观察Frua-2AM 所标Ca2+的荧光强度的变化来表示细胞质内游离Ca2+水平的变化。

2 结果
2.1 CDX2在Barrett食管粘膜的表达水平显著高于正常食管粘膜 CDX2在正常食管粘膜组织和BE食管粘膜组织中均有阳性表达,亚细胞定位主要表达于细胞核内,部分细胞质中也有表达,而且在Barrett食管粘膜组织中的CDX2的表达水平显著高于正常食管粘膜组织,差异具有统计学意义(P<0.001,见图1、表1)。

A:CDX2在正常食管粘膜组织中的表达;B:CDX2在人BE粘膜组织中的表达;左上、下×100,右上、下×200。图1 免疫组化检测人正常食管粘膜和人Barrett食管粘膜组织中CDX2的表达
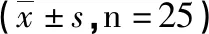
表1 人正常食管粘膜组织和Barrett食管粘膜组织中CDX2的表达比较
*:本组与正常食管粘膜上皮比较,P<0.001。
2.2 酸刺激对HEEC细胞内钙离子水平的影响 通过灌流系统分别用不同pH值的缓冲液刺激HEEC细胞,钙离子测定结果发现与对照组(pH 7.4)相比,pH5.5和pH5.0的酸性缓冲液能明显诱导HEEC细胞内的钙离子水平升高,差异有统计学意义(P<0.001),而pH7.0、6.5、6.0的酸性缓冲液对HEEC细胞内的钙离子水平无明显影响(P>0.05,见图2)。另外在给予pH5.5酸性缓冲液刺激的同时加入细胞内钙螯合剂BAPTA-AM(10μmol/L)共同作用,可见pH5.5酸性缓冲液诱导的细胞内钙增高明显被抑制(P<0.001,见图3)。提示酸刺激(pH5.0-pH5.5)可以调控食管上皮细胞的胞内钙水平,而细胞内钙螯合剂BAPTA-AM能有效抑制这种细胞内的钙变化。

A:钙离子成像检测不同pH刺激后细胞钙离子变化曲线;B:不同pH刺激后细胞钙离子变化统计图;*:与pH 7.4对照组比较,P=0.0006<0.001,n=50。#:与pH 7.4对照组比较,P=0.0005<0.001,n=50。图2 钙离子成像检测不同pH刺激对HEEC细胞内钙离子水平变化的影响

*:本组与 pH 5.5酸性缓冲液组比较,P=0.0005<0.001,n=55。图3 钙离子成像检测细胞内钙螯合剂BAPTA-AM对pH5.5酸性缓冲液调控HEEC细胞内钙离子水平变化的影响
2.3 酸刺激对HEEC细胞CDX2蛋白表达的影响 与pH7.4对照组相比,给予pH5.5酸性环境孵育HEEC细胞24h后,CDX2的蛋白表达明显上调(P<0.001,见图4),提示酸刺激可能通过调控CDX2的表达促进BE的发生发展。

*:本组与pH 7.4对照组比较 ,P=0.0007<0.001,n=3。图4 Western-blot检测pH5.5酸性环境刺激HEEC细胞24h后CDX2蛋白的表达变化
2.4 钙螯合剂BAPTA-AM对酸刺激诱导的CDX2表达变化的影响 为了进一步检测细胞内钙变化对调控CDX2表达的重要作用,在给予pH5.5酸性缓冲液孵育细胞的同时加入细胞内钙螯合剂BAPTA-AM(10μmol/L)共同作用,结果发现与对照组(pH7.4)比较,pH5.5酸刺激HEEC细胞后CDX2蛋白质表达水平明显升高(P<0.001),而加入BAPTA-AM共同作用后pH 5.5诱导的CDX2表达上调被明显逆转(P<0.001,见图5),提示细胞内钙变化是酸刺激调控CDX2表达过程中的关键环节。

#:本组与pH 7.4对照组比较P=0.0009<0.001,n=3;*:本组与pH 7.4对照组比较P=0.046<0.05,n=3;&:本组与pH 5.5酸刺激组比较,P=0.030<0.05,n=3。图5 Western blot检测人pH5.5及细胞内钙螯合剂BAPTA-AM对HEEC细胞CDX2表达变化的影响
3 讨论
Barrett食管的一个特征在于复层鳞状上皮被单层柱状上皮所替代,目前认为Barrett食管是食管腺癌发生过程中重要的危险因素[6]。过去数十年,BE相关腺癌的发病率在西方人群中显著增加。但最近几年,随着我国人民生活方式的日益西化,BE发病率也呈上升趋势,这必将导致BE相关食管腺癌的发病率迅速升高。更重要的是临床研究发现如果早期合理的治疗Barrett食管,部分患者的病变是可以发生逆转的。因此,阐明其发生机制对BE相关食管腺癌的早期诊断和治疗具有重要意义。
大量的临床研究证据表明酸暴露刺激引起的食管粘膜微环境改变与Barrett食管的发生最为密切[7]。已有报道证实胃食管反流性疾病引起的胃酸刺激会导致细胞内的pH降低,减少细胞程序性死亡,增加细胞的增殖,促进食管粘膜的癌变过程[8]。当食管下段粘膜长期反复受到胃酸、胆汁酸刺激时,可导致食管粘膜遭到腐蚀破坏以及炎症性改变,更为严重的是可导致食管单层鳞状上皮向柱状上皮细胞的转变[9]。因此目前认为酸暴露及胆汁反流刺激引起的食管粘膜微环境改变可能与Barrett食管发生密切相关。已有报道证实胃食管反流性疾病引起的胃酸刺激会导致细胞内的pH降低,长期的胃酸刺激可以诱导食管粘膜从正常生理向癌转变,肠化上皮的异常增殖并降低BE患者食管癌的发生率。更为重要的是,在动物实验的研究中发现,无论是通过食管下段与空肠起始部手术吻合模拟十二指肠食管反流模型,还是给予长期高酸反流的条件诱导刺激,都能成功地建立Barrett食管的动物模型,这有力地支持了酸暴露刺激与胆汁反流在Barrett食管发生发展中的重要作用。
在正常食管粘膜-BE-食管腺癌的演变过程中,CDX2基因至关重要, CDX2是一种肠型分化的标志物和核心分子,主要表达于肠上皮细胞、胰腺上皮细胞以及胃与食管中的肠上皮化生细胞,但在正常食管、胃粘膜和其它正常上皮均低表达或无表达,其在肠上皮早期分化及肠型维持方面具有关键作用[10-11]。CDX2能直接激活许多种肠上皮特异性基因表达,如(mucin 2)MUC2、Villin[12],已知在小肠胚胎干细胞中CDX2的表达能促使干细胞向小肠上皮分化,而抑制其表达则能诱导出鳞状上皮,而在胃上皮的研究中已证实CDX2 的表达是胃粘膜上皮肠化生的关键因素[13-14]。我们的实验证实在临床的Barrett食管中CDX2的阳性率和表达强度较正常食管粘膜明显增高,并且给予pH 5.5的酸性环境后,可以诱导正常永生化食管鳞状上皮细胞HEEC中 CDX2的表达上调,提示CDX2是Barrett食管发生中重要的下游靶基因,而进一步机制研究发现在给予pH 5.5的酸性环境刺激后,细胞内钙离子水平明显增高。细胞内Ca2+信号是重要的第二信使[15]。已知Ca2+作为应答胞外信号快速转变为胞内信号的重要媒介,其参与了机体各种生理及病理过程,在正常生理情况下,细胞内Ca2+浓度变化被精确的调控(包括细胞内钙离子来源、升高的浓度、持续的时间以及频率)。当在炎症损伤以及肿瘤发生等病理过程中,细胞内Ca2+浓度的精确调控发生紊乱进而活化下游一系列信号通路,调控疾病的发生发展。我们进一步的结果也证实给予细胞内钙离子阻断剂BAPTA-AM共同作用后,pH5.5诱导的 HEEC细胞CDX2的表达上调能够被明显逆转,提示细胞内的钙变化的确是其中的关键环节。
虽然钙信号下游调控CDX2的具体机制尚不明确,但通过文献检索发现胃酸可以激活一系列的信号途径,例如食管上皮细胞暴露于酸性微环境时可激活包括ERK、NF-KB和p38MAPK在内调控细胞的增殖、凋亡行为的多条信号通路[16-17],进而诱导COX2、前列腺素E2的表达[18]。还有研究发现在pH极低的酸性环境刺激诱导了细胞内氧化应激途径的激活,进而促进了Barrett食管的发生发展过程,而氧化应激途径的激活又与NF-KB、JAK-STAT、MAPK等炎症相关信号转导通路的激活密切相关[19]。课题组将进一步研究证实酸性刺激诱导BE的相关信号通路及调控细胞内钙变化的具体通道,为防治BE寻找到新靶点,进而有效地防止食管腺癌的发生发展。
