干扰素对JAK2 V617F阳性骨髓增殖性肿瘤PD-1/PD-L1及Treg表达的影响
2019-01-29张丽军齐峰成志勇张朝吴士杰郭艳涛孙丽娜彭占仙梁文同
张丽军,齐峰,成志勇,张朝,吴士杰,郭艳涛,孙丽娜,彭占仙,梁文同
0 引言
骨髓增殖性肿瘤(myeloproliferative neoplasms, MPN)是指分化相对成熟的一系或多系骨髓细胞不断地克隆增殖所致的一组肿瘤性疾病。大部分MPN患者中存在着JAK2 V617F、JAK2基因第12号外显子(exon l2)、MPL W515K基因第10号外显子(exonl0)、钙网蛋白(calreticulin,CARL)等突变[1]。JAK2 V617F突变导致酪氨酸激酶过度活化并持续激活JAK/STAT等信号通路[2]。干扰素α-2b(interferon alpha, IFN-α2b)通过作用于JAK-STAT信号通路,发挥其抗肿瘤、抗血管新生、影响细胞迁移的作用[3],可用于MPN的经典治疗。相关研究显示,干扰素α-2b可使约80%的MPN患者达到血液学缓解,并可以减轻脾肿大,且不存在向白血病转化的潜在风险[4]。
程序性死亡受体-1(programmed death-1,PD-1)即CD279,主要表达于活化的T淋巴细胞、B淋巴细胞、自然杀伤(NK)细胞表面,其介导的抑制信号在自身免疫、肿瘤免疫、移植免疫和感染免疫方面发挥了重要的负性调节作用[5]。程序性死亡配体-1(programmed death-ligand 1, PD-L1)即CD274,是PD-1的配体,主要表达于抗原递呈细胞(APC)及肿瘤细胞[6]。PD-L1与T细胞受体PD-1结合后可诱导T细胞耗竭、失活、凋亡[7],形成免疫抑制的肿瘤微环境,导致肿瘤免疫逃逸。调节性T细胞(regulatory T cells, Treg)是一群具有免疫抑制功能的T细胞,CD4+Treg主要作用是抑制自身反应性T细胞,发挥负调控免疫系统的作用[8]。
JAK2 V617F阳性的MPN患者中PD-1/PD-L1及Treg的表达及干扰素对其表达的影响尚无相关报道。本研究初步探讨了PD-1、PD-L1及Treg在JAK2 V617F阳性患者的表达及干扰素对PD-1/PD-L1通路及Treg的影响,以期为MPN的诊疗提供新的思路及理论依据。
1 资料与方法
1.1 临床资料
收集2016年10月—2018年4月在保定市第一医院门诊或住院接受定量PCR检测确定有JAK2 V617F突变的MPN患者61例,其诊断均符合2016年WHO血液学疾病诊断标准。分为初治组41例,男23例,女18例,年龄27~82岁,中位年龄60岁。其中真性红细胞增多症(PV)11例、原发性血小板增多症(ET)18例、原发性骨髓纤维化(PMF)12例;IFN-α2b治疗组20例,男11例,女9例,年龄27~81岁,中位年龄62岁。其中真性红细胞增多症(PV)6例、原发性血小板增多症(ET)8例、原发性骨髓纤维化(PMF)6例,IFN-α2b治疗组均接受IFN-α2b皮下或肌肉注射,每次300万U,3次/周,治疗6月以上;另收集20例健康志愿者作为对照组,男10例,女10例,年龄25~66岁,中位年龄59岁。研究方案由保定市第一医院伦理委员会批准,所有对象均签署知情同意书。
1.2 试剂
IFN-α2b购自北京凯因科技股份有限公司(批号20170046),人外周血淋巴细胞分离液购自天津灏洋华科生物科技有限公司(产品编号:2010C1119),FITC标记的CD3、CD4、CD8单抗、PE标记的CD25单抗及APC标记的Foxp3单抗均购自美国BD公司(Becton, Dickinson and Company),PD-1(FITC Mouse Anti-Human CD279,批号7285690)及PD-L1(PE Mouse Anti-Human CD274,批号7104833)抗体购自美国BD PharmingenTM公司,血液基因组DNA提取试剂盒购自北京博迈德生化科技有限公司,引物由北京赛百盛公司合成,TaqMan Gene Expression MasterMix购自ABI公司。
1.3 试验方法
1.3.1 实时荧光定量PCR(qRT-PCR)JAK2 V617F突变量检测 分别采集各组的新鲜骨髓液2 ml,以100 U/ml的肝素钠抗凝,DNA提取试剂盒提取标本DNA,终浓度50~100 ng/μl,qRT-PCR(包括探针反应)反应体系共25 μl,反应条件:50℃ 2 min,95℃ 10 min 1循环,95℃ 15 s,60℃1 min 40循环,设置空白对照及标准品。依照标准品计算JAK2及JAK2 V617F的绝对拷贝值,计算JAK2 V617F与JAK2的比值,即JAK2 V617F突变率。PCR反应体系引物序列及探针如下:JAK2上游引物:5'-CAG CAA GTA TGA TGA GCA AGC TTT-3',下游引物:5'-TGA ACC AGA ATA TTC TCG TCT CCAC-3';探针:5'-FAM-TCA CAA GCA TTT GGT TTT-MGB-3';JAK2 V617F下游引物:5'-CCA GAA TAT TCT CGT CTC CAC TGA A-3'。
1.3.2 流式细胞学检测PD-1、PD-L1的表达 收集各组骨髓细胞,分别加入0.8 μl PD-1抗体、1 μl PD-L1抗体充分混匀后室温避光孵育15 min。加入溶血素(1:1 000)低速涡流混匀,室温避光静置8~10 min,离心弃上清液。PBS洗涤1次,1 ml PBS重悬细胞后上机检测。CellQuest软件获取1×106个细胞进行分析,以CD45/SSC设门分出髓系细胞群及淋巴细胞群,以CD45阳性率及颗粒度分为髓系细胞群及淋巴细胞群,分别检测髓系细胞及淋巴细胞表面PD-1、PD-L1的表达。PD-1、PD-L1表达高于20%为阳性表达。
1.3.3 流式细胞学检测Treg的表达 收集各组外周血单个核细胞加入荧光素标记的单克隆抗体CD3、CD4、CD8、CD25。PBS缓冲液洗涤一次,离心弃上清液。加1 ml Foxp3 Fixation/permeabilization工作液。室温避光孵育40 min。PBS洗涤2次。重悬细胞加入二抗Foxp3,室温避光孵育20 min。PBS洗一次后重悬细胞,上机检测Treg。
1.3.4 原代细胞培养 无菌条件下取15例初治MPN患者抗凝骨髓液和外周血4 ml,应用淋巴细胞分离液分离单个核细胞,取含10%新生牛血清的RPMI1640培养液重悬细胞,置于50 ml细胞培养瓶中,加入PBS稀释后的IFN-α2b至终浓度1×106U/L放入37℃、5%CO2饱和湿度环境培养48 h,取培养后细胞检测骨髓髓系细胞PD-1、PD-L1及外周血Treg的表达。
1.4 统计学方法
SPSS19.0软件进行统计学分析,多组间比较采用方差分析,组间两两比较选用q检验或t检验,两变量的相关程度采用Pearson直线相关分析法分析,干扰素体外干预数据为非正态分布,采用Wilcoxon秩和检验分析,检验水准α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1 各组JAK2 V617F、PD-1、PD-L1及Treg表达分析
初治组JAK2 V617F、髓系细胞PD-1、髓系细胞PD-L1及Treg表达均高于IFN-α2b治疗组和对照组(P<0.05);IFN-α2b治疗组JAK2 V617F、髓系细胞PD-1、髓系细胞PD-L1及Treg表达高于对照组(P<0.05)。
初治组和IFN-α2b治疗组淋巴细胞PD-1、PD-L1表达水平虽然高于对照组,但表达量低,且差异无统计学意义(均P>0.05),见表1、图1。
2.2 JAK2 V617F突变量<50%组和JAK2 V617F突变量≥50%组PD-1、PD-L1及Treg的表达
将41例初治组患者进行分层分析,分为JAK2 V617F突变量<50%组、JAK2 V617F突变量≥50%组,分别有20例、21例。结果显示:JAK2<50%组PD-1、PD-L1及Treg的表达明显低于JAK2≥50%组,差异有统计学意义(P<0.05),见表2。
2.3 JAK2 V617F阳性MPN患者JAK2 V617F、PD-1、PD-L1及Treg表达的相关性
表1 JAK2 V617F阳性骨髓增殖性肿瘤不同组JAK2 V617F、PD-1、PD-L1及Treg表达量的关系 (±s)Figure1 Expression of JAK2 V617F, PD-1, PD-L1 and Treg in different groups of JAK2 V617F-positive myeloproliferative neoplasms (±s)
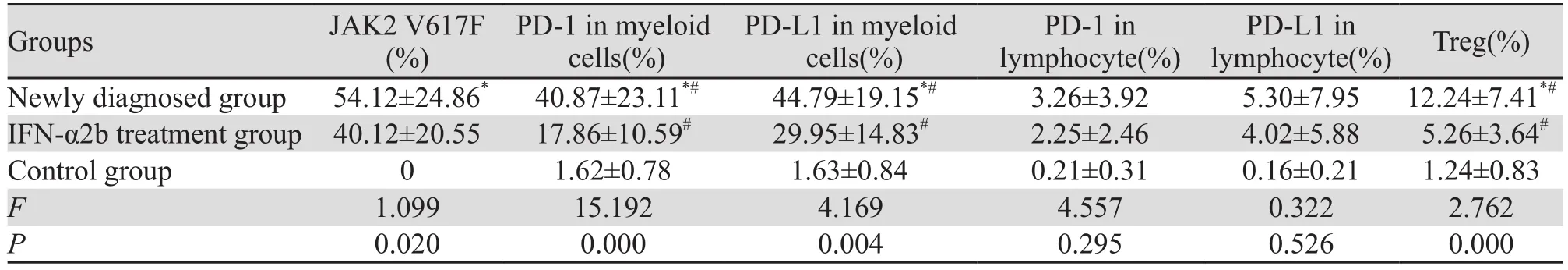
表1 JAK2 V617F阳性骨髓增殖性肿瘤不同组JAK2 V617F、PD-1、PD-L1及Treg表达量的关系 (±s)Figure1 Expression of JAK2 V617F, PD-1, PD-L1 and Treg in different groups of JAK2 V617F-positive myeloproliferative neoplasms (±s)
Notes: *: P<0.05, compared with the IFN-α2b treatment group; #: P<0.05, compared with the control group
Groups JAK2 V617F(%)PD-1 in myeloid cells(%)PD-L1 in myeloid cells(%)PD-1 in lymphocyte(%)PD-L1 in lymphocyte(%) Treg(%)Newly diagnosed group 54.12±24.86* 40.87±23.11*# 44.79±19.15*# 3.26±3.92 5.30±7.95 12.24±7.41*#IFN-α2b treatment group 40.12±20.55 17.86±10.59# 29.95±14.83# 2.25±2.46 4.02±5.88 5.26±3.64#Control group 0 1.62±0.78 1.63±0.84 0.21±0.31 0.16±0.21 1.24±0.83 F 1.099 15.192 4.169 4.557 0.322 2.762 P 0.020 0.000 0.004 0.295 0.526 0.000
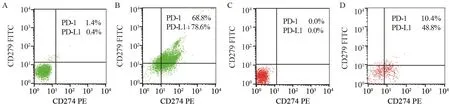
图1 PD-1、PD-L1在JAK2 V617F阳性骨髓增殖性肿瘤初治组和健康对照组中的表达情况Figure1 Expression of PD-1 and PD-L1 in control group and newly diagnosed group of JAK2 V617F-positive myeloproliferative neoplasms
Pearson相关性分析表明,JAK2 V617F突变量与髓系细胞PD-1、PD-L1、淋巴细胞PD-1表达呈正相关(r=0.498,P<0.01;r=0.686,P<0.01;r=0.406,P<0.01);髓系细胞PD-1与髓系细胞PD-L1、淋巴细胞PD-1表达正相关(r=0.758,P<0.01;r=0.382,P<0.05)。Treg与各组均无相关性(P>0.05)。淋巴细胞PD-L1各组间无相关性(P>0.05)。
表2 JAK2 V617F突变量与PD-1、PD-L1及Treg的表达的关系 (±s)Table2 Relationship between JAK2 V617F and expression of PD-1, PD-L1 and Treg (±s)
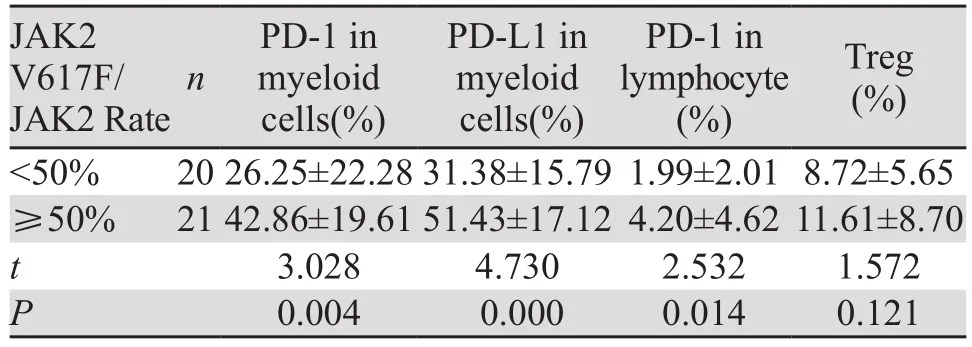
表2 JAK2 V617F突变量与PD-1、PD-L1及Treg的表达的关系 (±s)Table2 Relationship between JAK2 V617F and expression of PD-1, PD-L1 and Treg (±s)
JAK2 V617F/JAK2 Rate Treg(%)<50% 2026.25±22.2831.38±15.791.99±2.018.72±5.65≥50% 2142.86±19.6151.43±17.124.20±4.6211.61±8.70 t 3.028 4.730 2.532 1.572 P 0.004 0.000 0.014 0.121 n PD-1 in myeloid cells(%)PD-L1 in myeloid cells(%)PD-1 in lymphocyte(%)
2.4 IFN-α2b对体外培养MPN原代细胞PD-1、PD-L1及Treg表达的影响
1×106U/L IFN-α2b体外干预原代细胞后,髓系细胞PD-1、PD-L1及Treg的表达减低,差异有统计学意义(P<0.05),淋巴细胞PD-1表达差异无统计学意义(P>0.05),见表3。
表3 IFN-α2b作用前后髓系细胞PD-1、PD-L1,淋巴细胞PD-1及Treg表达量的比较 (±s)Table3 Comparison of PD-1, PD-L1 expressions in myeloid cells, PD-1 expression in lymphocyte, Treg expression before and after IFN-α2b treatment (±s)
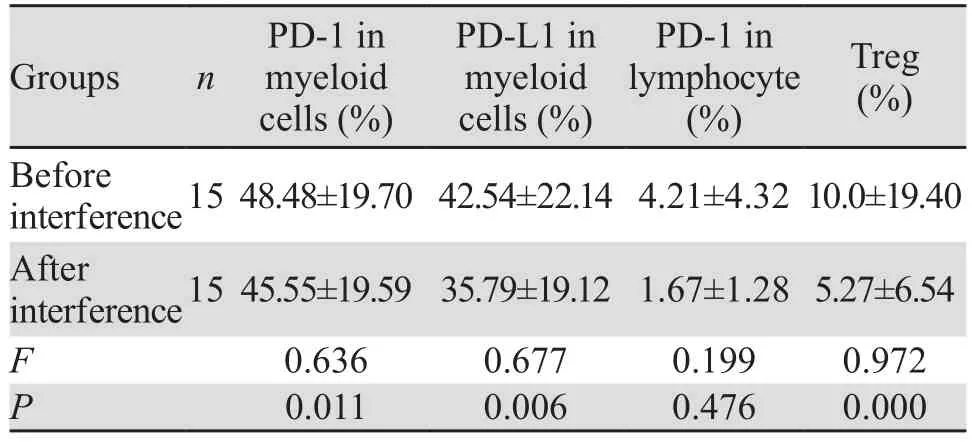
表3 IFN-α2b作用前后髓系细胞PD-1、PD-L1,淋巴细胞PD-1及Treg表达量的比较 (±s)Table3 Comparison of PD-1, PD-L1 expressions in myeloid cells, PD-1 expression in lymphocyte, Treg expression before and after IFN-α2b treatment (±s)
Groups n PD-1 in myeloid cells (%)PD-L1 in myeloid cells (%)PD-1 in lymphocyte(%)Treg(%)Before interference1548.48±19.7042.54±22.144.21±4.3210.0±19.40 After interference1545.55±19.5935.79±19.121.67±1.285.27±6.54 F 0.636 0.677 0.199 0.972 P 0.011 0.006 0.476 0.000
3 讨论
包括血液系统恶性肿瘤在内的多种肿瘤细胞存在着免疫逃逸机制。免疫检查点可以激活T细胞诱导的调节通路。抑制共刺激信号可以促进T细胞增殖,进而防止致癌突变。免疫检查点在阻断宿主免疫应答中起着至关重要的作用[9]。其中PD-1/PD-L1作为免疫检查点重要成员,已成为肿瘤免疫治疗的重要靶点[10-12]。本研究检测了61例JAK2 V617F阳性MPN患者PD-1、PD-L1的表达。初治组PD-1、PD-L1均高表达,且IFN-α2b治疗组PD-1、PD-L1的表达量较初治组明显减低。同时JAK2 V617F的表达与PD-1、PD-L1呈正相关。
细胞因子受体JAK-STAT通路是一条重要的细胞增殖信号转导通路,该通路的激活对促进细胞增殖、抑制细胞凋亡具有重要作用[13]。IFN-α2b可以通过调控JAK-STAT信号通路发挥其抗肿瘤作用[2]。有研究表明,在肝癌中JAK/STAT1是IFN-γ诱导人肝癌细胞系PD-L1表达的主要途径,TNF-α和IFN-γ可协同诱导肝癌细胞PD-L1的表达[14]。在黑色素瘤中,IFNα与PD-1/PD-L1抑制剂或可产生协同效应[15]。本研究中MPN患者应用IFN-α2b后JAK2 V617F表达量明显减少,且PD-1、PD-L1表达量亦减低。原代细胞培养结果显示干扰素可以下调PD-1、PD-L1的表达。表明干扰素可能通过负反馈调控JAK-STAT信号通路,进而下调PD-1/PD-L1信号通路,达到抑制肿瘤的作用。
Treg在肿瘤患者的T淋巴细胞中所占比例明显升高,抑制效应T淋巴细胞的抗肿瘤活性[16]。有研究表明,PD-1/PD-L1信号通路可能是Treg发挥抑制作用的机制之一。PD-1基因敲除小鼠Treg不能抑制CD8+T细胞增殖或IFN-γ分泌[17]。本试验研究了61例患者Treg的表达,相比对照组,初治组及治疗组Treg的表达量明显升高。有研究表明,干扰素作用短期内可以引起PD-L1及Treg上调,可能与Treg数量的增加使机体维持保护性免疫,避免了机体过度的免疫反应有关[18],长期作用效果来看,可能参与抑制PD-1、PD-L1及Treg表达。本研究结果显示IFN-α2b作用后可使PD-L1及Treg表达减低,原代细胞培养结果亦支持该结论。部分患者干扰素治疗后存在PD-L1及Treg上调,该部分患者是否与预后不良有关,尚需进一步研究。
本研究初步探讨了JAK2 V617F阳性MPN患者JAK2 V617F、PD-1、PD-L1及Treg的表达及各表达量之间的相互关系,以及干扰素对MPN患者JAK2 V617F、PD-1、PD-L1及Treg表达的抑制作用。为PD-1/PD-L1通路在MPN中的作用提供一定的理论依据。
