二甲双胍对人食管鳞癌侧群细胞的作用及机制
2019-01-29邵凯迪王留兴陆士新
邵凯迪,王留兴,陆士新,2
0 引言
中国食管癌发病率位于全球食管癌发病率的第7位,死亡率居全球食管癌死亡率第10位[1]。而我国食管癌约90%病例是鳞状细胞癌[2]。目前食管癌的治疗方法主要是手术、放疗及化疗。迄今为止,尽管有多种可用的治疗选择,但食管癌的复发转移及其不良预后仍然是临床医学的难题。
自肿瘤干细胞(cancer stem cell, CSC)学说提出,众多学者把对食管癌的研究方向转到干细胞层面上来,以SP分选作为肿瘤干细胞的鉴定方式之一。Huang与Li等[3-4]用Hoechst 33342方法从食管癌细胞系和食管癌组织原代培养细胞中分离,鉴定出侧群(side population, SP)与非侧群(non-side population, NSP)细胞。SP细胞这群特殊的细胞具有高致瘤性、自我更新、多向分化、耐药的潜能,这些特性与肿瘤干细胞十分相似[5-7],因此SP分选渐渐成为研究肿瘤干细胞的重要方法,为进一步研究肿瘤干细胞的生物学功能和分子机制奠定了基础。
二甲双胍(metformin, Metf)在临床上广泛用于Ⅱ型糖尿病的治疗。对健康者的血糖并无明显影响。近年来,Metf的抗肿瘤作用受到广泛重视,因Metf对CSC具有抑制作用[8]。目前,Metf对食管癌CSCs的作用及机制尚需进一步研究,本文旨在研究二甲双胍对食管鳞癌SP细胞干性的作用及机制。
1 材料与方法
1.1 细胞株和主要试剂
人食管鳞癌细胞系KYSE系列(30, 150, 180,410, 450, 510)、S1、TE1、Ec109细胞购自协和医学院基础研究所。RPMI 1640培养基、胎牛血清购于美国Gibco公司。Hoechst 33342、盐酸二甲双胍购于美国Sigma-Aldrich公司。CCK-8试剂盒购于日本Dojindo化学公司。鼠抗β-actin单克隆抗体购于美国Santa Cruz公司。兔抗SOX2、OCT4单克隆抗体购于美国Abcam公司。山羊抗鼠二抗、山羊抗兔二抗购于北京中杉金桥公司。
1.2 细胞培养
细胞系均用RPMI 1640(含10%胎牛血清)培养基于37℃、5%CO2的恒温培养箱培养。食管癌细胞进入对数生长期后,每2~3天用0.25%胰蛋白酶(含0.02%EDTA)传代一次.
1.3 SP细胞比例检测及分选
取对数生长期的细胞,消化成单细胞悬液,PBS洗涤2遍,常规细胞计数,以1×106个细胞每毫升重悬于RPMI 1640培养基中(+2%FBS)。取1 ml重悬的液体,加入ABCG2抑制剂利血平,于37℃培养箱中避光孵育30 min,然后加入终浓度为5 μg/ml的荧光染料Hoechst 33342,于37℃培养箱中避光孵育90 min,期间间断振荡混匀。孵育结束后,用冷PBS洗涤细胞2次,离心收集,重悬于400 μl PBS中,用350 nm的紫外激光激发Hoechst 33342,用405/BP309(Hoechst蓝)滤光片测量荧光发射。流式细胞仪检测或分选。实验重复3次。
1.4 二甲双胍对细胞系SP比例的作用
取处于对数生长期食管癌KYSE150细胞,消化成单细胞悬液,然后接种在6孔板中,待长到约6孔板面积的50%时,加入含不同浓度二甲双胍的新鲜细胞培养液,每个浓度设置3个平行孔;加入不同浓度二甲双胍后24 h后常规消化细胞为单细胞悬液,通过1.3步骤进行SP细胞比例检测。
1.5 使用CCK-8方法检测不同浓度二甲双胍对SP细胞增殖的影响
取分选的SP细胞,常规细胞计数,按5 000个每孔接种于96孔板中过夜,第二天观察细胞贴壁情况良好后,每孔加入含不同浓度的二甲双胍培养基(终浓度分别为5、10、15、20 mmol/L),每个浓度设5个复孔,以不加药物的复孔为对照组。继续培养24和48 h后,加入配制好的CCK-8工作液,继续放入细胞培养箱中避光孵育2 h,于酶标仪中测定在450 nm处的吸光度(OD值)。吸光度(OD值)=实验组平均OD值-调零孔平均OD值。
1.6 二甲双胍对SP细胞平克隆形成能力的影响
取分选的SP及NSP细胞,常规细胞计数,以300个每孔接种于6孔板,每孔加入含不同浓度的二甲双胍以及10%FBS的RPMI 1640培养基悬浮细胞,每个浓度设置3个平行孔,细胞置于37℃、5%CO2培养箱培养10~14天,至细胞克隆超过50个细胞时终止培养,无水甲醇溶液室温固定10 min,结晶紫室温染色20 min后流水冲洗染料,计数每孔克隆形成数。克隆形成率=每孔克隆形成数/每孔接种细胞数×100%。
1.7 二甲双胍对SP细胞成球能力的作用
将分选后的细胞接种于6孔板中,加入不同浓度二甲双胍后48 h后将细胞常规消化为单细胞悬液,细胞计数,每孔2 000个细胞,接种于低吸附6孔板中,每个浓度设置3个平行孔,加入3 ml无血清成球培养基,将6孔板置于37℃、5%CO2培养箱中,培养10天,拍照并统计。
1.8 二甲双胍对SP细胞相关基因蛋白表达水平的影响
取分选的SP细胞, PBS洗3次后加入含蛋白酶抑制剂的细胞裂解液进行总蛋白的提取。然后进行SDS-PAGE凝胶电泳分离,再将蛋白转至PVDF膜。经TBST/5%脱脂奶粉室温封闭后,依次孵育相应的一抗和二抗,最后进行显色。
1.9 统计学方法
实验数据采用SPSS19.0统计学软件进行分析,本研究应用Studentttest等检验方法,用GraphPad Prism 5.0软件制图,P<0.05为差异有统计学意义。
2 结果
2.1 不同细胞系的SP比例
为了明确细胞系的SP比例,本实验共检测9种食管鳞癌细胞系的SP比例,SP比例在0.2%~2%左右,且不同细胞系的SP比例不尽相同,见图1。每种细胞系至少重复三次,经多次实验后,发现KYSE150细胞SP比例较稳定,遂对其进行分选及以下实验。
2.2 二甲双胍对SP比例的影响
KYSE150细胞通过不同浓度的二甲双胍作用24 h后进行SP检测,发现对照组SP比例为(1.54±0.45)%,5 mmol/L二甲双胍作用24 h后的SP比例为(1.02±0.39)%,10 mmol/L二甲双胍作用24 h后SP比例降为(0.53±0.32)%,与对照组相比差异均有统计学意义(P=0.03和P=0.001)。由此可知二甲双胍能降低SP的比例,且SP比例的下降程度与二甲双胍浓度呈正相关性,见图2。
2.3 不同浓度二甲双胍对SP细胞增殖的影响
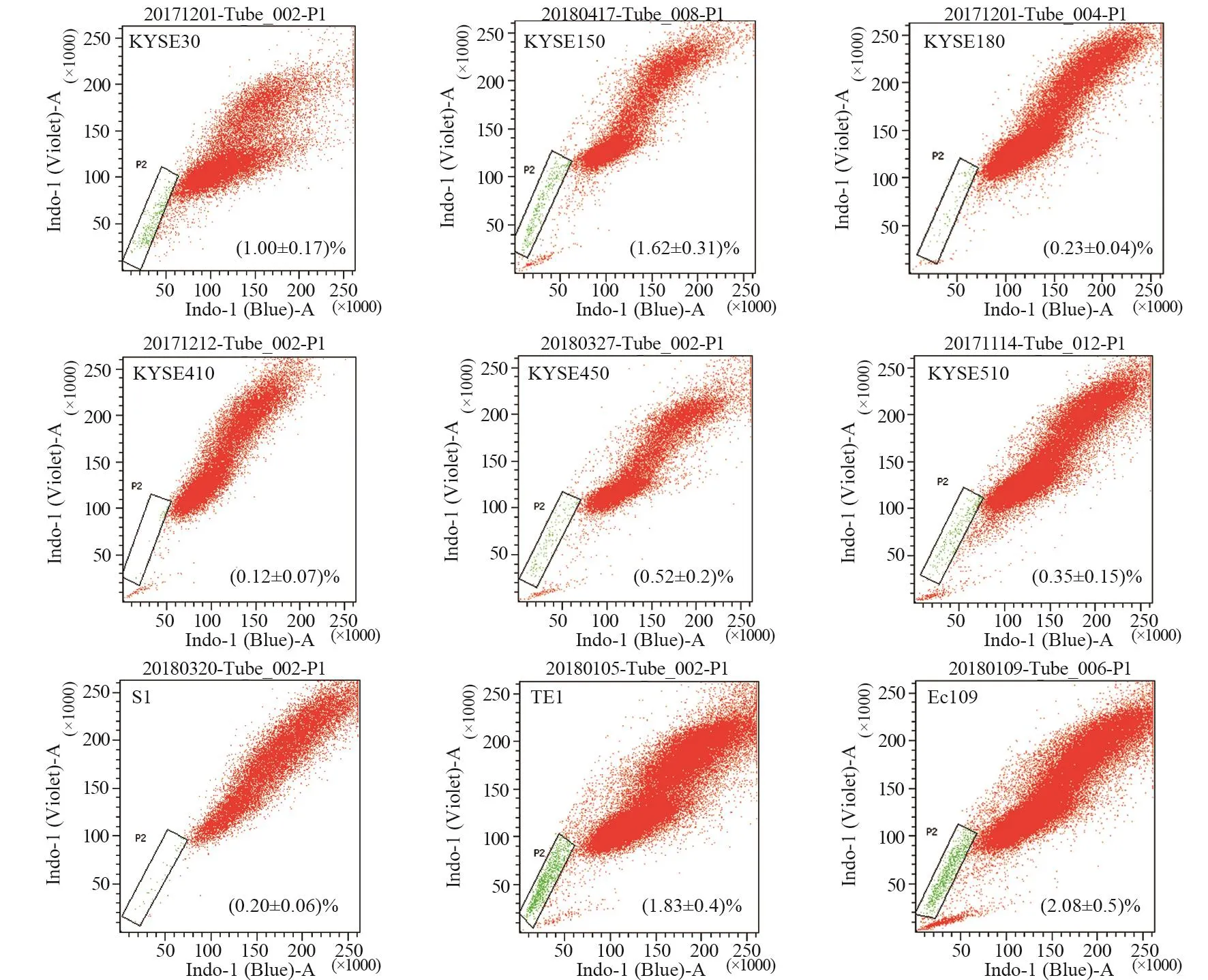
图1 9种不同食管鳞癌细胞系的SP(side population)比例Figure1 SP radte of nine different esophageal squamous cell lines

图2 不同浓度二甲双胍对KYSE150 SP比例的影响Figure2 Effect of different concentrations of metformin on SP rate of KYSE150
分选后的SP细胞给予不同浓度二甲双胍作用24或48 h后,通过CCK-8方法检测细胞增殖,5 mmol/L二甲双胍处理SP细胞24 h后,细胞增殖并未受到影响,其余实验组测得细胞增殖均受到不同程度抑制,且细胞的增殖抑制程度与二甲双胍浓度及给药时间呈显著正相关性,见图3。
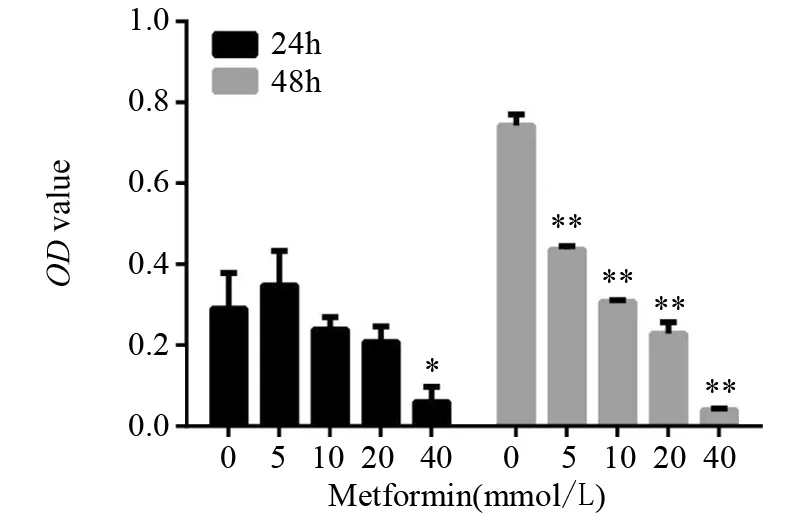
图3 不同浓度二甲双胍对SP细胞增殖的影响Figure3 Effect of different concentrations of metformin on proliferation of SP cells
2.4 不同浓度二甲双胍对SP细胞克隆形成能力的影响
14天后观察分选后SP细胞的克隆形成情况,发现SP细胞形成克隆较NSP细胞的克隆较大且多,0 mmol/L二甲双胍SP细胞平均克隆数目为(122.2±10.31)个,NSP细胞平均克隆数目为(51.4±4.58)个,而在培养基中加入5 mmol/L二甲双胍组均未见克隆长出,差异有统计学意义(P=0.000),见图4。
2.5 二甲双胍对SP细胞成球能力的影响
食管癌KYSEl50经不同浓度二甲双胍处理48 h后接种6孔板中,10天后结束培养并观察拍照,SP细胞中0 mmol/L二甲双胍组成球数目为(26.00±2.31)个,5 mmol/L二甲双胍组成球数目为(9.67±1.20)个,两者差异有统计学意义(P=0.003)。NSP细胞中0 mmol/L二甲双胍组成球数目为(9.00±1.16)个,5 mmol/L二甲双胍组成球数目为(1.67±0.67)个,两者差异有统计学意义(P=0.005),见图5。
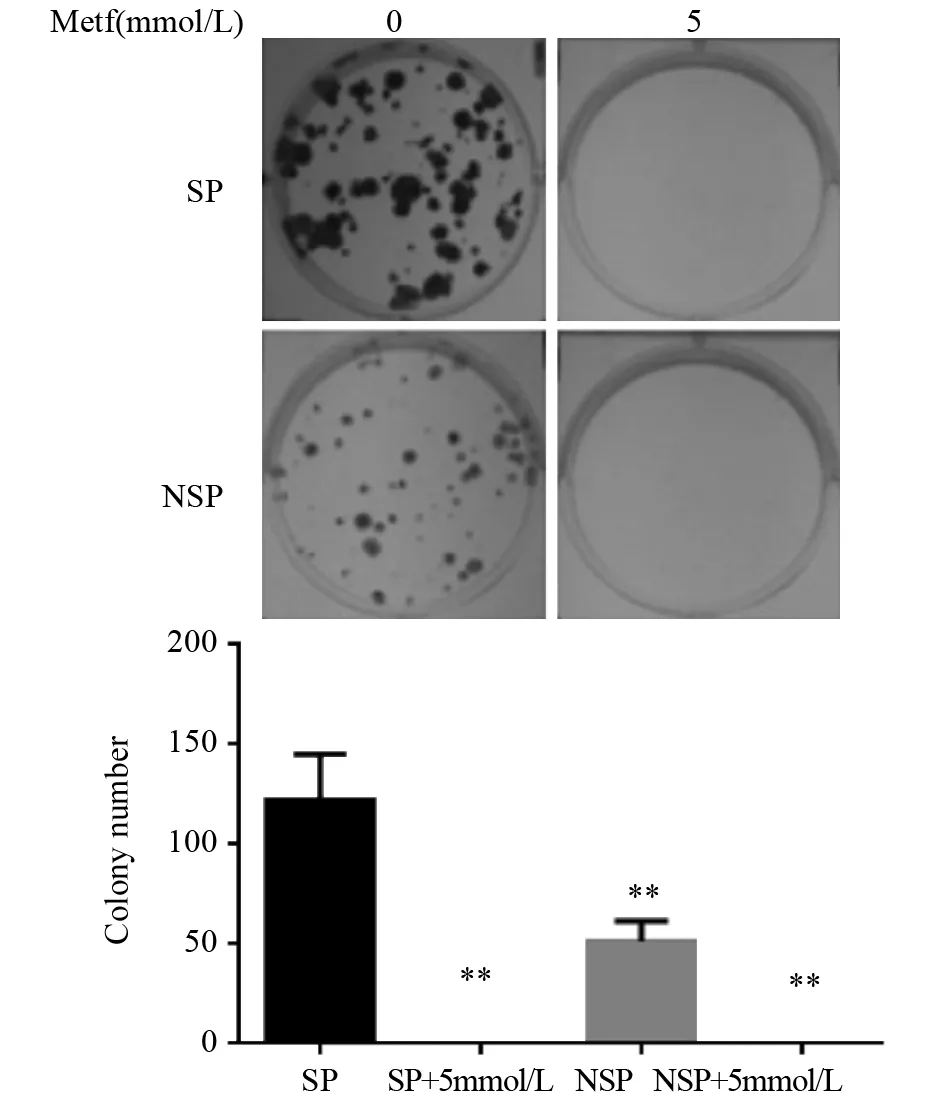
图4 不同浓度二甲双胍对SP、NSP细胞克隆形成能力的影响Figure4 Effect of different concentrations of metformin on clonality of SP and non-side population (NSP) cells
2.6 二甲双胍对SP细胞相关基因蛋白表达水平的影响
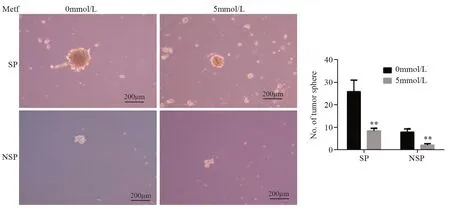
图5 不同浓度二甲双胍对SP、NSP细胞成球能力的影响Figure5 Effect of different concentrations of metformin on sphere-forming efficiency of SP and NSP cells
分选后的SP细胞经不同浓度二甲双胍处理24 h后提取总蛋白,发现细胞中干细胞相关基因SOX2以及OCT4的表达均有不同程度的降低,见图6。
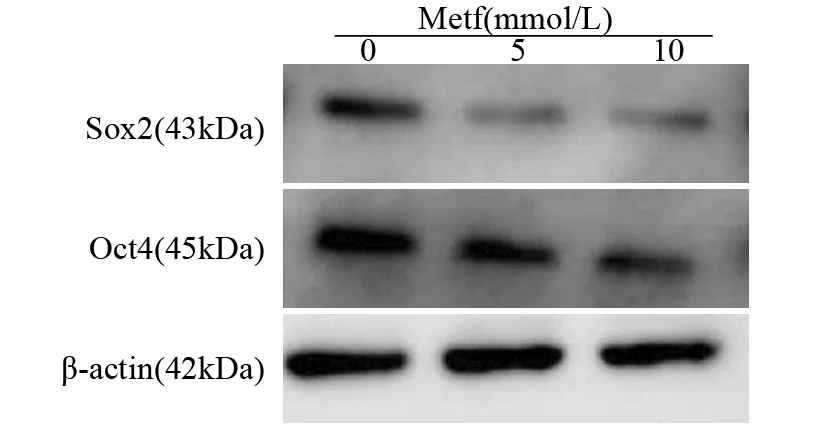
图6 不同浓度二甲双胍对SP细胞相关基因蛋白表达水平的影响Figure6 Effect of different concentrations of Metf on expression of related genes protein in SP cells
3 讨论
我国食管癌患者就诊时大多处于中晚期,无论是手术还是放化疗,其临床效果及预后均不能让人满意,甚至大多数患者在病理性完全缓解后早期出现远处转移。据统计,我国食管癌患者5年生存率约为20.9%[9]。尽管目前有一些新药物包括靶向药应用于食管癌的治疗,但对于绝大多数终末期食管癌患者来说,预后依然相对较差。放化疗后的复发转移仍然是患者预后差的主要原因。
肿瘤干细胞被认为是肿瘤细胞内具有无限分裂潜能、自我更新能力和固有化疗耐药性的一小部分细胞[10-11],虽只占肿瘤细胞的很少部分,但却有着强大的致瘤性、转移性和放疗抵抗性。肿瘤干细胞学说的提出很好地解释了有关肿瘤的发生、发展、转移、复发及耐药性等问题,并且提供了更多的肿瘤治疗和临床应用思路,若能够降低肿瘤干细胞的比例,将会在一定程度上降低患者的复发转移,改善肿瘤患者的预后。
目前流行病学研究显示Metf可以降低多种实体瘤的发生,范洪君等[12]以甲基苄基亚硝胺诱发大鼠食管癌,并用Metf治疗,其结果显示:Metf明显抑制食管癌的发生。Li和Wang等[13-14]的研究证明Metf抑制食管癌细胞增殖,并增强了食管癌对顺铂的敏感度。Honjo等[15]研究证明:因Metf靶向CSC和mTOR,所以Metf抑制食管癌细胞生长并且增强了食管癌细胞对5-Fu毒性敏感度。目前的研究支持以前的临床观察,即Metf用于临床治疗对食管癌患者有益,能够补充其他治疗,有效治疗食管癌。
在本实验中测得的9种食管鳞癌细胞系的SP细胞与NSP细胞比例在0.2%~2%左右,这个比例与世界文献报道的数值一致,结果表明:我们分离SP细胞的技术是科学的、可信的。SP细胞与NSP细胞比例各不相同,这与其恶性程度有一定的关系[16-17];同时放化疗的长期应用也可以富集SP细胞,因此SP/NSP的比例也可能与细胞系来源的患者是否经过放化疗有关。KYSE150来源为日本49岁女性低分化食管鳞癌,并经过放疗,这与其有着稳定的SP/NSP比例有一定的关系。平板克隆形成是检测单个肿瘤细胞增殖能力的简单方法,能形成克隆的细胞必为能贴壁并具有增殖活力的细胞;成球实验反应了细胞的干性,有许多实验研究,通过细胞成球实验来获得干细胞[18-19];SOX2及OCT4均为干细胞相关基因,对维持干细胞多向分化及自我更新能力有着非常重要的作用。Bao等[20]对胰腺癌的研究显示二甲双胍可以抑制胰腺癌细胞的增殖、克隆形成及成球能力,并降低CD44、EpCAM、EZH2、Notch-1、Nanog及Oct4等干性相关基因的表达从而杀伤胰腺癌干细胞。Honjo等[15]对食管腺癌的相关研究,结果显示二甲双胍可以抑制食管腺癌干性相关基因的表达并且抑制PI3K/mTOR信号转导通路增加氟尿嘧啶对食管腺癌干细胞的杀伤能力。
从本实验可看出,二甲双胍可以降低KYSE150细胞系的SP数量,抑制分选的SP细胞的增殖、平板克隆形成、成球实验等,并能够降低SOX2、OCT4等干细胞相关基因的表达,并且随着二甲双胍浓度的增高,其降低效果更明显。由此可知,二甲双胍能够在一定程度上降低食管癌细胞的干性,其可能也是通过降低干细胞相关基因的表达来杀伤干细胞,不过其具体机制仍需进一步深入研究。
二甲双胍作为临床上常用的治疗2型糖尿病的药物,其安全性及不良反应已知、价格低廉,已有多篇文章报道其对不同肿瘤的抑制作用等,通过本研究发现,二甲双胍能够杀伤肿瘤干细胞,在一定程度上降低肿瘤干细胞的比例,这可能为食管癌的临床治疗提供一个新的思路,为食管癌患者提供一个更有效的治疗方法。
