异黏蛋白调控鼻咽癌细胞增殖及紫杉醇耐药的研究
2019-01-29余长云刘勇曹华
余长云,刘勇,曹华
0 引言
鼻咽癌为东南亚及我国南部地区常见的恶性肿瘤之一,每年约有80 000新发病例[1]。放射治疗是鼻咽癌的首选治疗方法,对早期患者效果较好,五年生存率可达90%以上;但对于晚期患者效果并不理想。目前认为,放化疗结合的综合治疗是鼻咽癌的重要治疗手段,化疗在中晚期或复发及转移患者的治疗中起着非常重要的作用[2-4]。然而化疗耐药的产生严重制约了鼻咽癌患者的最终治疗效果。因此,阐明鼻咽癌化疗耐药的分子机制,并采取有效措施预防和抑制鼻咽癌化疗耐药,对提高患者的总体治疗效果具有重要意义。
异黏蛋白(metadherin, MTDH)作为癌基因在乳腺癌、肝癌和肺癌等多种实体瘤中异常表达,并促进肿瘤细胞增殖、侵袭转移等恶性生物学行为[5]。我们前期研究发现MTDH在头颈部鳞状细胞癌(简称头颈鳞癌)组织中高表达,能通过诱导上皮-间质转化(epithelial-mesenchymal transition, EMT)和肿瘤血管新生促进头颈鳞癌侵袭转移,与患者预后显著负相关[6-7]。然而,目前有关MTDH在头颈鳞癌化疗耐药中的作用报道尚少。因此,本研究旨在前期研究的基础上探讨MTDH对鼻咽癌细胞增殖及紫杉醇耐药的影响。
1 材料与方法
1.1 材料
人鼻咽癌细胞株5-8F、HNE-1均购自北纳创联生物公司。RPMI 1640培养基购自美国Hyclone公司,特级胎牛血清购自杭州四季青生物工程材料有限公司,0.25%胰蛋白酶消化液(含乙二胺四乙酸)、双抗(青霉素-链霉素)均购自美国Gibco公司,细胞计数(CCK-8)试剂盒购自上海碧云天生物技术有限公司,MTDH过表达慢病毒颗粒、MTDH沉默慢病毒颗粒及对照慢病毒颗粒均由河南九睿生物技术有限公司设计合成,嘌呤霉素购自美国Santa Cruz公司,Lipofectamine 2000购自美国Thermo Fisher Scientific公司,兔抗人MTDH多克隆抗体购自美国Proteintech Group公司,小鼠抗人β-actin单克隆抗体购自上海碧云天生物技术有限公司。
1.2 方法
1.2.1 细胞培养 人鼻咽癌细胞5-8F、HNE-1均在37˚C、5%CO2及饱和湿度条件下,用含有10%特级胎牛血清、100 u/ml青霉素和100 μg/ml链霉素的RPMI1640培养基进行培养,常规0.25%胰蛋白酶消化传代。所有实验均选用处于对数生长期的细胞。
1.2.2 细胞转染 将状态良好的5-8F、HNE-1细胞按约2×105个/孔接种于6孔板中,用无抗生素细胞培基培养24 h,使转染时细胞融合率达80%~85%。转染按照Lipofectamine 2000转染说明书进行,感染复数MOI=10。转染后24 h更换新鲜培养基继续培养48 h,加入4 μg/ml的嘌呤霉素进行筛选2周后,Western blot检测MTDH过表达和沉默效果,再进行后续实验。后续实验分为亲本细胞组、MTDH过表达组、MTDH沉默组及阴性对照组。
1.2.3 Western blot提取各组细胞总蛋白 采用二喹啉甲酸法(bicinchoninic acid, BCA)测定细胞总蛋白浓度。取50 μg总蛋白进行变性处理,进行10%~12%十二烷基硫酸钠-聚丙烯酰胺凝胶(SDSPAGE)电泳。蛋白电泳分离后转至PVDF膜,5%脱脂牛奶室温下封闭2 h。加入兔抗人MTDH多克隆抗体(1:800)、小鼠抗人β-actin抗体(1:1000)于4˚C下孵育过夜。洗膜后,于辣根过氧化抗兔二抗(1:3000)、辣根过氧化抗小鼠二抗(1:1000)室温下孵育1 h。洗膜后,经化学发光剂显影,在凝胶成像系统上拍照并分析。实验重复三次。
1.2.4 CCK-8法检测细胞增殖能力 分别将5-8F、HNE-1 MTDH过表达细胞、MTDH沉默细胞及阴性对照细胞按1×104个每毫升接种于96孔板,每孔100 ml,每组设5个复孔,共培养5天。分别于培养第1d、2d、3d、4d和5d时向每孔加入10 μl CCK-8测定液,2 h后用酶标仪测定450 nm波长吸光度值(OD)。实验重复三次。
1.2.5 流式细胞实验检测细胞周期及凋亡 分别将5-8F、HNE-1 MTDH过表达细胞、MTDH沉默细胞及阴性对照细胞接种于六孔板中,每孔约1×106个细胞,每组设3个复孔,培养24 h。胰酶消化制成细胞悬液,1 000 r/min离心5 min,弃上清液,以PBS溶液重悬、1 000 r/min离心5 min、去上清液,重复洗涤细胞2次后弃去上清液,每组细胞加入1 ml 70%乙醇重悬固定细胞,18 h后行流式细胞术检测细胞周期。同法,收集各组细胞进行Annexin V-FITC和PI双染色,1 h内行流式细胞术检测各组细胞凋亡率。实验均重复三次。
1.2.6 CCK-8法检测紫杉醇对5-8F、HNE-1细胞的30%抑制浓度(IC30)、50%抑制浓度(IC50)、70%抑制浓度(IC70) 常规培养细胞处于对数生长期时消化传代,细胞计数并调整5-8F细胞数为1×104个每毫升接种于96孔板,每孔100 ml;过夜贴壁后向各孔中加入不同浓度紫杉醇100 ml(紫杉醇终浓度分别为0、0.78、1.56、3.13、6.25、12.5和25 nmol/L),同时设置只含10%胎牛血清的RPMI 1640培养基的空白组,每组设3个复孔;培养48 h后每孔加入10 μl CCK-8测定液,2 h后用酶标仪测定450 nm波长吸光度值(OD)。计算各浓度的抑制率,并算出紫杉醇对5-8F细胞的IC30、IC50、IC70浓度。生长抑制率=(OD对照组平均值-OD实验组平均值)/(OD对照组平均值-OD空白组平均值)×100%。紫杉醇对HNE-1细胞的IC30、IC50、IC70检测时加入的紫杉醇终浓度分别为0、0.1、1、5、10、20和50 nmol/L,其余步骤同5-8F细胞。实验均重复三次。
1.2.7 CCK-8法检测细胞生存率 分别将5-8F MTDH过表达细胞及阴性对照细胞、HNE-1 MTDH过表达细胞及阴性对照细胞1×104个每毫升接种于96孔板,每孔100 ml,每组设5个复孔;过夜贴壁后向各孔中加入含IC50、IC70浓度紫杉醇的细胞培养基100 ml,48 h后CCK-8法检测细胞生存率。分别将5-8F MTDH沉默细胞及阴性对照细胞、HNE-1 MTDH沉默细胞及阴性对照细胞1×104个每毫升接种于96孔板,每孔100 ml,每组设5个复孔;过夜贴壁后向各孔中加入含IC30、IC50浓度紫杉醇的细胞培养基100 ml,48 h后CCK-8法检测细胞生存率。实验重复三次。
1.3 统计学方法
采用SPSS 19.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,采用多样本均数的方差分析进行多个样本均数的比较,进一步两两比较采用Bonferroni检验,采用独立样本t检验进行两样本均数的比较。所有检验均为双侧检验,P<0.05为差异有统计学意义。
2 结果
2.1 建立稳定高表达和沉默MTDH的鼻咽癌细胞株
Western blot结果显示5-8F、HNE-1过表达组细胞MTDH表达量分别是对照组的4.6倍、2.77倍;1号干扰序列在5-8F、HNE-1中沉默效率均达80%以上,见图1~2。以上结果表明,MTDH稳定高表达和沉默的细胞株构建成功,可用于下一步实验研究。
2.2 MTDH对鼻咽癌细胞生长增殖能力的影响
CCK-8结果显示,MTDH过表达后5-8F、HNE-1细胞在培养3、4、5 d时的OD值均大于对照组,两两比较差异均有统计学意义(均P<0.05);然而,沉默MTDH表达后,5-8F、HNE-1细胞在培养3、4、5 d时的OD值均小于对照组,两两比较差异均有统计学意义(均P<0.05),见图3。这些表明,MTDH上调可促进鼻咽癌细胞生长增殖,MTDH下调抑制鼻咽癌细胞生长增殖。
2.3 MTDH对鼻咽癌细胞周期的影响
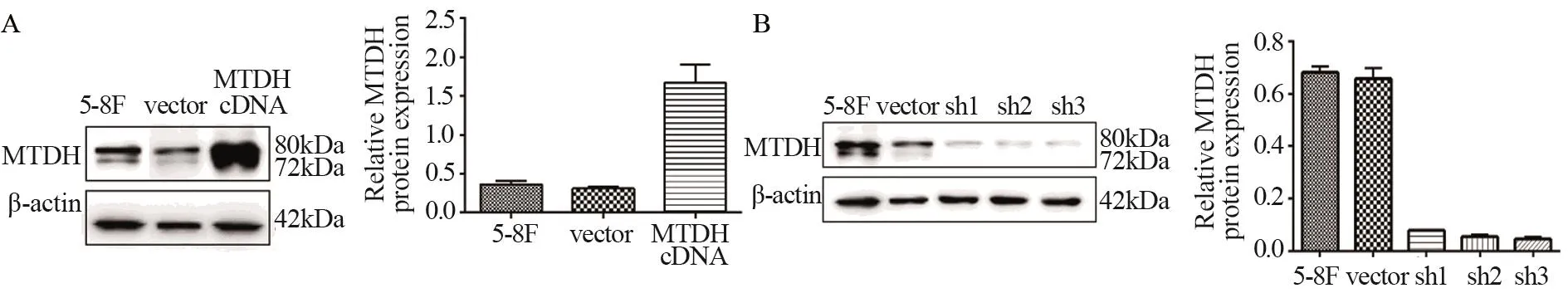
图1 转染MTDH cDNA和MTDH-shRNA后5-8F细胞中MTDH蛋白相对表达情况Figure1 The expression of MTDH protein in 5-8F cells transfected with MTDH cDNA and MTDH-shRNA
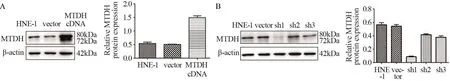
图2 转染MTDH cDNA和MTDH-shRNA后HNE-1细胞中MTDH蛋白表达情况Figure2 The expression of MTDH protein in HNE-1 cells transfected with MTDH cDNA and MTDH-shRNA
流式细胞实验结果显示:MTDH沉默组的G1期细胞比例(5-8F:(55.813±2.521)%,HNE-1:(55.117±1.495)%)较对照组(5-8F:(37.330±0.325)%, HNE-1:(48.487±0.781)%)明显增加,两两比较差异均有统计学意义(5-8F:t=-18.694,P=0.000;HNE-1:t=-6.807,P=0.002);而MTDH沉默组S期细胞比例(5-8F:(34.753±2.626)%,HNE-1:(23.543±2.251)%)与对照组(5-8F:(35.127±2.072)%,HNE-1:(20.683±2.634)%)比较差异无统计学意义(5-8F:t=0.193,P=0.856;HNE-1:t=-1.430,P=0.226);MTDH沉默组G2/M期细胞比例(5-8F:(8.727±4.873)%, HNE-1:(23.277±4.093)%)较对照细胞组(5-8F:(25.630±1.470)%, HNE-1:(31.060±2.037)%)明显减少,两两比较差异均有统计学意义(5-8F:t=5.752,P=0.005; HNE-1:t=2.949,P=0.042),见图4。
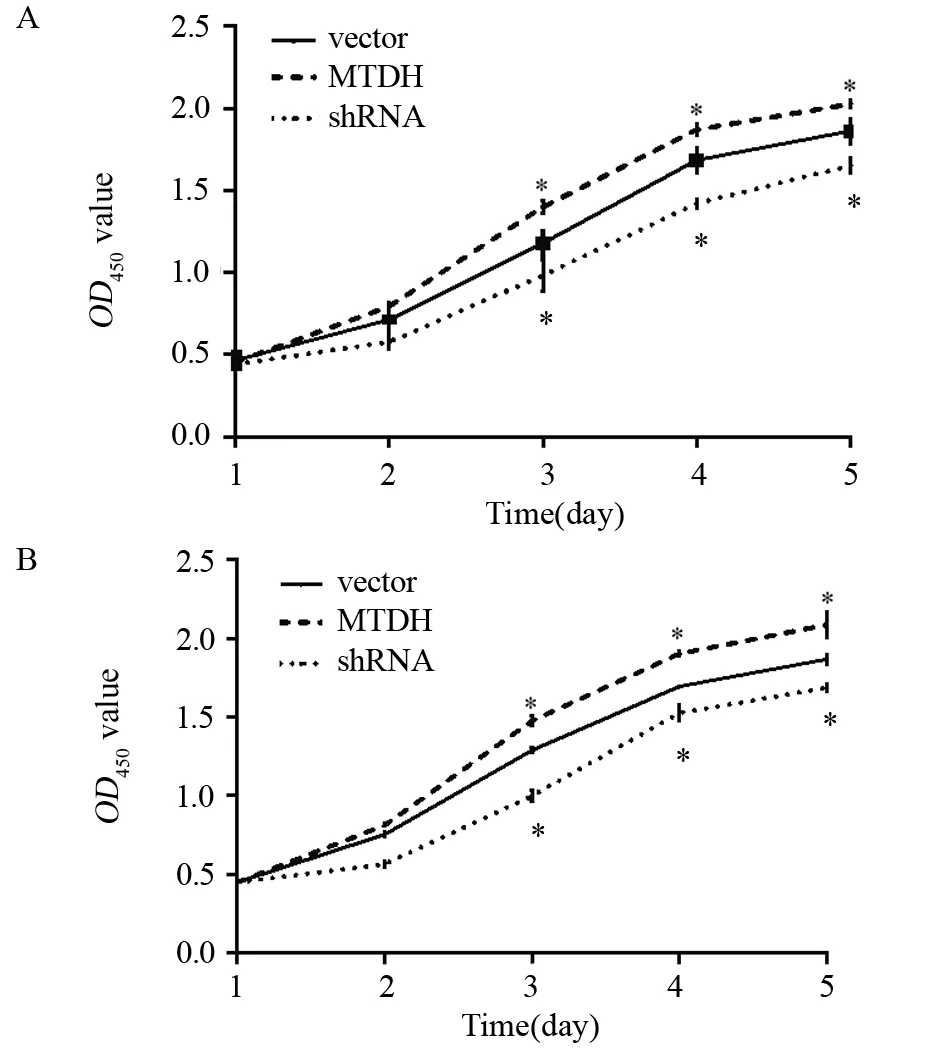
图3 MTDH对5-8F细胞(A)、HNE-1细胞(B)增殖能力的影响Figure3 Effects of MTDH on proliferation of 5-8F(A) and HNE-1(B) cells
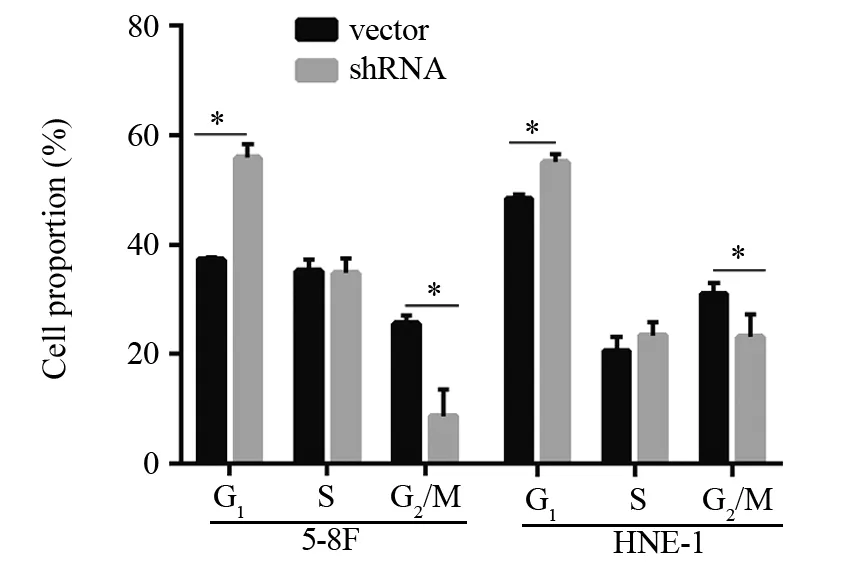
图4 MTDH对5-8F、HNE-1细胞周期的影响Figure4 Effect of MTDH on cell cycle of 5-8F and HNE-1 cells
2.4 MTDH对鼻咽癌细胞凋亡的影响
流式细胞实验结果显示,MTDH过表达组细胞凋亡率(5-8F: (1.243±0.266)%, HNE-1: (5.590±0.387)%)较对照组细胞凋亡率(5-8F:(3.293±1.243)%, HNE-1: (6.617±0.431)%)降低,两两比较差异均有统计学意义(5-8F:t=4.118,P=0.015;HNE-1:t=3.067,P=0.037),见图5A。MTDH沉默组细胞凋亡率(5-8F:(6.737±0.735)%, HNE-1:(11.910±1.102)%)较对照组细胞凋亡率(5-8F:(3.293±1.243)%, HNE-1:(6.617±0.431)%)增高,两两比较差异均有统计学意义(5-8F:t=-4.005,P=0.016; HNE-1:t=-7.744,P=0.001),见图5B。
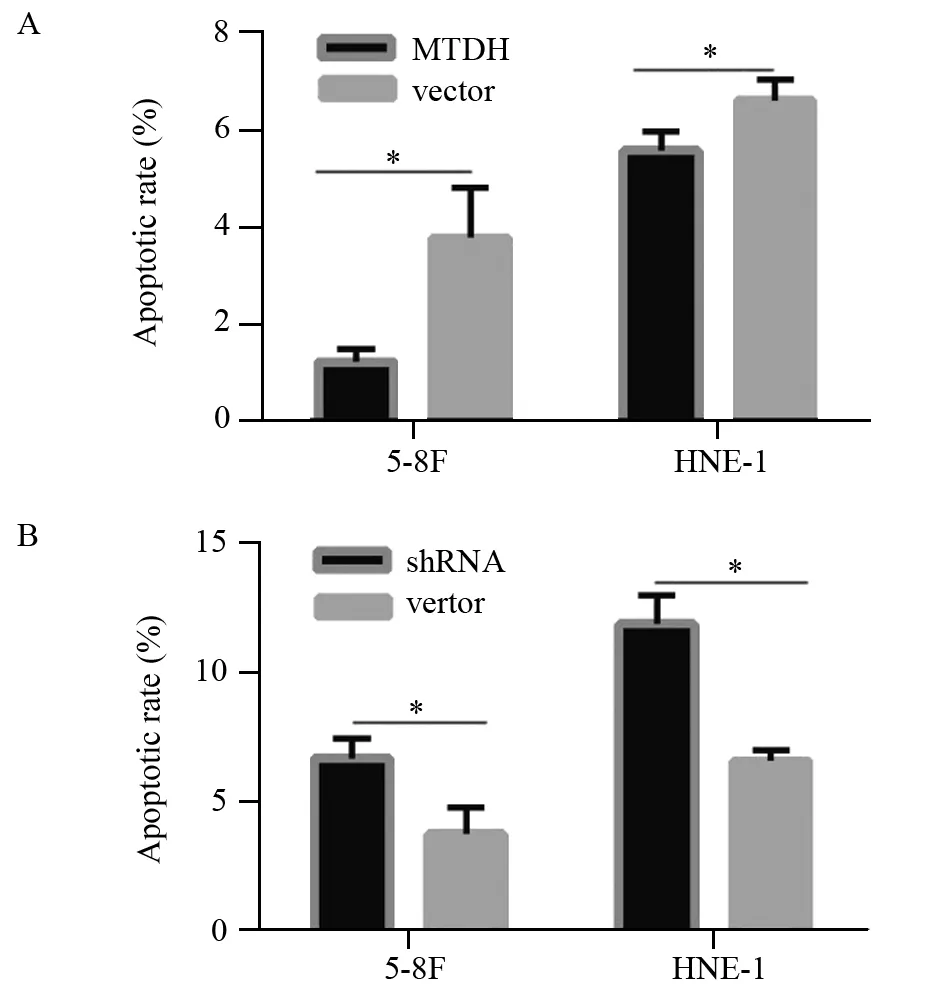
图5 MTDH过表达(A)及沉默(B)后对5-8F、HNE-1细胞凋亡的影响Figure5 Effects of MTDH overexpression(A) and silence(B) on apoptosis of 5-8F and HNE-1 cells
2.5 上调MTDH降低鼻咽癌细胞对紫杉醇敏感度
根据CCK-8结果确定,紫杉醇对5-8F的IC30、IC50、IC70分别为2.947、5.875、8.802 nmol/L,紫杉醇对HNE-1的IC30、IC50、IC70分别为2.077、6.768、22.052 nmol/L。分别用IC50、IC70浓度的紫杉醇作用于MTDH过表达鼻咽癌细胞及对照细胞,48 h后CCK-8法检测细胞生存率。结果显示:MTDH表达上调之后,鼻咽癌细胞对紫杉醇的敏感度降低,在IC70浓度下,MTDH过表达组细胞的生存率(5-8F: 41.05±5.47, HNE-1:44.37±2.07)高于对照组细胞(5-8F: 28.94±3.24, HNE-1: 30.16±3.56),两两比较差异均有统计学意义(5-8F:t=-4.261,P=0.003; HNE-1:t=-7.727,P=0.000);在IC50浓度下,MTDH过表达组细胞的生存率(5-8F: 61.36±6.51, HNE-1:64.17±3.26)亦高于对照组细胞(5-8F: 50.16±2.39, HNE-1: 54.98±3.15),两两比较差异均有统计学意义(5-8F:t=-3.610,P=0.007; HNE-1:t=-4.538,P=0.002),见图6。
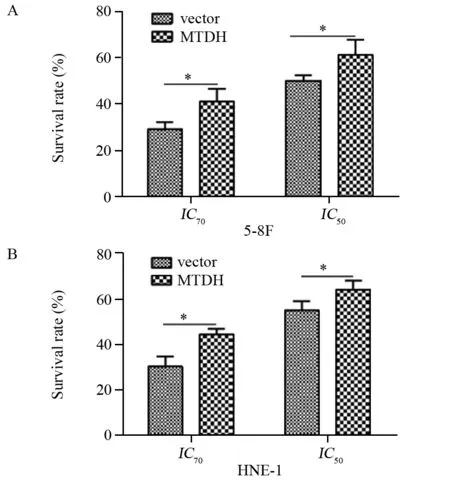
图6 上调MTDH降低鼻咽癌细胞5-8F(A)、HNE-1(B)对紫杉醇敏感度Figure6 MTDH overexpression decreased sensitivity of NPC 5-8F(A) and HNE-1(B) cells to paclitaxel
2.6 下调MTDH提高鼻咽癌细胞对紫杉醇敏感度
分别用IC30、IC50浓度的紫杉醇作用于MTDH沉默组鼻咽癌细胞及对照细胞,48 h后CCK-8法检测细胞生存率。结果显示:沉默MTDH表达之后,鼻咽癌细胞对紫杉醇的敏感度升高,在IC50浓度下,MTDH沉默组细胞的生存率(5-8F: 30.70±1.73, HNE-1: 44.99±3.16)低于对照组细胞(5-8F:50.16±2.39, HNE-1: 54.98±3.15),两两比较差异均有统计学意义(5-8F:t=14.757,P=0.000; HNE-1:t=5.008,P=0.001);在IC30浓度下,MTDH沉默组细胞的生存率(5-8F: 62.56±5.14, HNE-1: 63.36±3.51)亦低于对照组细胞(5-8F: 73.78±2.76,HNE-1: 72.95±2.94),两两比较差异均有统计学意义(5-8F:t=4.297,P=0.003; HNE-1:t=-4.681,P=0.002),见图7。
3 讨论
紫杉醇作为鼻咽癌化疗的一线药物,其临床效果得到一致认可。然而,细胞耐药性的产生严重制约了其最终治疗效果。因此,阐明紫杉醇耐药性产生的分子机制,寻找紫杉醇耐药密切相关的分子标志物和干预靶点,有望改善鼻咽癌患者的临床治疗效果。近年来,尽管紫杉醇耐药的相关性研究取得一定进展,但其具体分子机制目前仍不十分清楚,尚需从新的角度进行深入探讨。
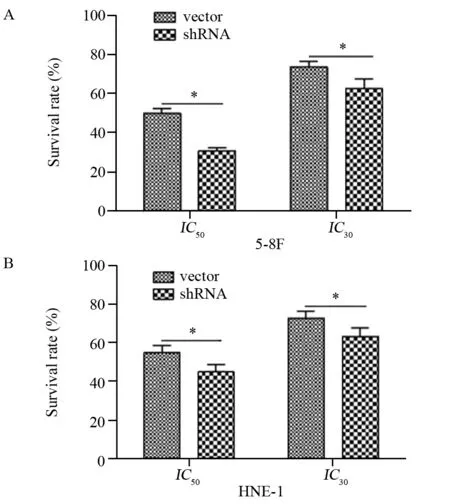
图7 下调MTDH提高鼻咽癌细胞5-8F(A)、HNE-1(B)对紫杉醇敏感度Figure7 MTDH silence sensitized NPC 5-8F(A) and HNE-1(B) cells to paclitaxel
MTDH是2002年新发现的一个癌基因,在肺癌、乳腺癌、肝癌等多种恶性肿瘤中异常表达,在肿瘤发生、发展过程中发挥着十分重要的作用[5]。研究发现,MTDH在乳腺癌、肝癌、子宫内膜癌等恶性肿瘤中高表达,并促进化疗耐药性产生[8-10]。然而,MTDH在鼻咽癌化疗耐药中的作用目前尚不明确。李果等研究发现MTDH蛋白在鼻咽癌细胞和组织中的表达较鼻咽部黏膜均显著上调,其表达水平与患者血清EB病毒滴度的高低、T分级、临床分期、颈部淋巴结转移呈显著正相关[11]。本研究中,我们通过基因功能获得或缺失研究表明,MTDH过表达可促进鼻咽癌细胞生长增殖及紫杉醇耐药性;而沉默MTDH表达可抑制鼻咽癌细胞生长增殖,并增强鼻咽癌细胞对紫杉醇敏感度。宋振川等在乳腺癌的研究中发现,MTDH可通过调控凋亡等促进乳腺癌细胞紫杉醇耐药[12]。Zhang等在前列腺癌的研究中发现,以MTDH为靶点的基因疫苗能有效抑制小鼠前列腺癌的生长转移并增强化疗药物紫杉醇的敏感度[13]。本研究结果与宋振川及Zhang等的研究结果一致,表明MTDH对紫杉醇化疗耐药具有促进作用。然而,MTDH如何调控鼻咽癌细胞生长增殖及紫杉醇耐药性的产生有待进一步研究。
研究表明,MTDH可通过促增殖和抗凋亡效应调控肿瘤细胞的增殖[14]。本研究中细胞周期分析结果显示,沉默MTDH表达后鼻咽癌细胞G1期比例增加,S期细胞无显著变化,G2/M期细胞比例降低,提示MTDH沉默后可能通过将细胞阻滞在G1期来抑制细胞增殖。此外,流式细胞分析还显示,MTDH过表达组细胞凋亡率降低,MTDH沉默组细胞凋亡率增加。这些结果与MTDH在卵巢癌、黑色素瘤等恶性肿瘤中的研究一致[15-16],提示MTDH可能通过调控细胞周期和凋亡进而影响鼻咽癌细胞增殖。EMT是具有极性的上皮细胞向具有活动能力的间质细胞转化的过程,是一类基本形态和基因表型变化,在胚胎发育、创伤修复、肿瘤侵袭转移、放化疗抵抗等生理、病理过程中发挥着重要作用[17]。我们前期研究证实,MTDH可通过诱导EMT形成,进而促进头颈鳞癌细胞侵袭转移[6]。此外,在另一项研究中我们发现,MTDH在酸性微环境调控鼻咽癌细胞紫杉醇耐药中发挥重要作用[18]。这些提示我们,MTDH可能通过EMT调控鼻咽癌细胞细胞紫杉醇耐药,这也是我们后续研究的方向之一。
综上所述,本研究在体外水平阐明MTDH可促进鼻咽癌细胞生长增殖及紫杉醇耐药性的产生。该研究结果进一步丰富了MTDH在肿瘤中的生物功能,为今后利用MTDH蛋白作为鼻咽癌紫杉醇耐药的分子靶点提供了新的实验数据和理论依据。然而,MTDH调控鼻咽癌细胞生长增殖及紫杉醇耐药的具体分子机制仍需深入探讨,且需从体内实验对现有体外实验结果进行佐证。
