白藜芦醇对糖尿病大鼠认知功能损害的改善作用
2019-01-21周玉兰冀俊林李玉旺
周玉兰,冀俊林,李玉旺
随着中国老龄化的加速,痴呆成为老年人致残的三大因素之一。每年约有10%~15% 的认知障碍患者转化为痴呆[1]。糖尿病是由胰岛素水平不足或胰岛素作用缺陷引起的代谢性疾病,糖尿病患者在全球日益增多,2000年糖尿病患者总数为1.71亿人,到 2030 年预计高达 3.66 亿人[2]。 糖尿病会导致多系统损害,对认知功能的损害不容忽视[3]。然而,糖尿病相关认知功能损害的机制仍不十分明确,且仍无有效治疗。白藜芦醇是一种天然的酚类化合物,在红葡萄的表皮中富集,在虎杖中也大量存在。大量研究证实了白藜芦醇具有许多药理学作用,包括抗氧化、抗凋亡、抗癌症及抗炎等特性[4-6],其对于认知功能同样具有明显的改善作用[7]。该实验采用STZ法建立糖尿病大鼠痴呆模型,通过水迷宫实验检测大鼠认知功能的变化来评价白藜芦醇对糖尿病大鼠认知功能损害的治疗效果,并研究其相关机制。
1 材料与方法
1.1 实验仪器及主要试剂 MorriS水迷宫(中国医学科学院药物所);白藜芦醇(Sigma),TNF-α 及 IL-6 ELISA 试剂盒 (Abcam),β-actin 抗体、Bax、Bcl-2及 Caspase-3抗体(Abcam)。
1.2 实验动物分组与动物模型的建立 健康成年SD雄性大鼠60只,体重220 g~260 g,购于天津市实验动物中心,动物质量合格证号:SCXK(京)2005-0001。分为对照组、模型组、治疗组,每组20只。所有大鼠进行适应性喂养7 d。模型组和治疗组大鼠接受链脲佐菌素(STZ)左下腹腹腔注射建立糖尿病模型(链脲佐菌素溶于生理盐水中,按60 mg/kg注射),对照组注射等量生理盐水。链脲佐菌素注射72 h后尾静脉连续3 d、每天1次测量血糖(血糖仪测定),若平均血糖>16.7 mmol/L视为糖尿病模型制作成功。造模后1周,治疗组大鼠给予40 mg/kg(10 ml/kg)白藜芦醇单侧腹腔注射治疗,1次/d,连续治疗4周。对照组和模型组大鼠每日给予等量生理盐水腹腔注射。
1.3 行为学检测大鼠认知功能 白藜芦醇治疗4周后行水迷宫测试检测各组大鼠空间学习记忆能力。水迷宫水池壁高50 cm,水深40 cm,水温维持在20~24℃,水池直径150 cm。在水迷宫的目标象限正中心位置放置一直径为10 cm的水下隐性平台,平台上表面位于水下1 cm处。前5 d进行定位航行实验,4次/d,每次从不同入水点放入大鼠。每只大鼠面朝水池壁放入池中,记录逃避潜伏期,即大鼠寻找平台的时间。若大鼠2 min内未到达水下平台,则将大鼠小心引导至平台上,并让其逗留15 s,120 s则为该大鼠逃避潜伏期时间。第6天撤去水下平台记录每组大鼠穿越平台次数。
1.4 海马TNF-α及IL-6检测 每只大鼠麻醉后提取海马备用,裂解后匀浆在4℃条件下使用离心机离心 5 min(14 000×g),留取上清液。 利用 ELISA试剂盒测定大鼠海马中TNF-α和IL-6的浓度。所有的操作步骤按照试剂盒说明书进行。
1.5 海马Bax、Bcl-2及Caspase-3蛋白检测 每只大鼠麻醉后提取海马备用,RIPA进行蛋白裂解(冰上30 min),匀浆在4℃条件下使用离心机离心5 min(14 000×g),随后测定蛋白浓度(BCA 法)。 取裂解液利用10%SDS聚丙烯酰胺凝胶室温下电泳(3 h),随后转膜,再TTBS处理1 h。再与如下抗体相结合:β-actin 抗体 (浓度 1∶2000)、抗 Bax 抗体(1∶1000)、抗 Bcl-2 抗体(1∶1000)、抗 Caspase-3 抗体(浓度1∶2000),4℃过夜。洗膜,然后利用二抗孵育,室温下1 h。最后红外成像系统进行曝光显影。Bax、Bcl-2、Caspase-3 蛋白与 β-actin 的 IOD 值比值作为其相对蛋白表达量。
1.6 统计学方法 应用SPSS 17.0统计软件对数据进行分析,计量资料以(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 Morris水迷宫实验检测大鼠认知功能 与对照组相比,模型组大鼠逃避潜伏期延长(P<0.05);与模型组相比,治疗组大鼠逃避潜伏期缩短,长于对照组(P<0.05)。与对照组相比,模型组大鼠穿越平台次数减少(P<0.05);与模型组相比,治疗组大鼠穿越平台次数增加,仍少于对照组(P<0.05)。结果说明,模型组大鼠认知功能较对照组大鼠下降,白藜芦醇治疗改善了糖尿病大鼠的认知功能,但仍未达到正常水平。治疗后大鼠逃避潜伏期与穿越平台次数结果见表1。
表1 白藜芦醇治疗对糖尿病大鼠行为学的影响(±s)
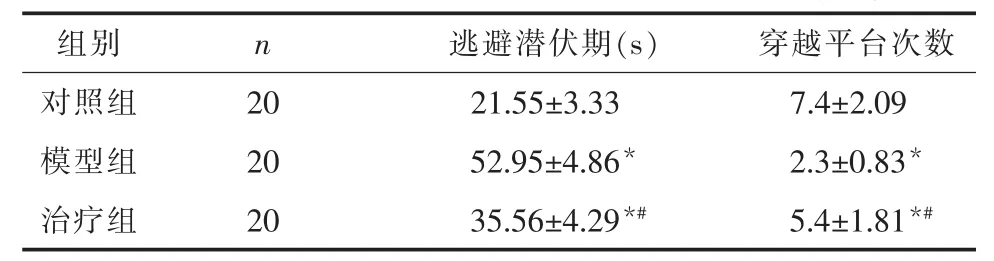
表1 白藜芦醇治疗对糖尿病大鼠行为学的影响(±s)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05。
组别 n 逃避潜伏期(s)穿越平台次数对照组 20 21.55±3.33 7.4±2.09模型组 20 52.95±4.86* 2.3±0.83*治疗组 20 35.56±4.29*# 5.4±1.81*#
2.2 海马TNF-α及IL-6的表达 模型组大鼠海马TNF-α及IL-6的含量明显升高,差异有统计学意义(P<0.05);治疗组大鼠海马 TNF-α 及 IL-6 的含量与模型组相比明显降低,但仍高于对照组,差异有统计学意义(P<0.05)。各组大鼠海马 TNF-α 及IL-6含量见表 2。
表2 各组大鼠海马部位TNF-α及IL-6的含量(±s)
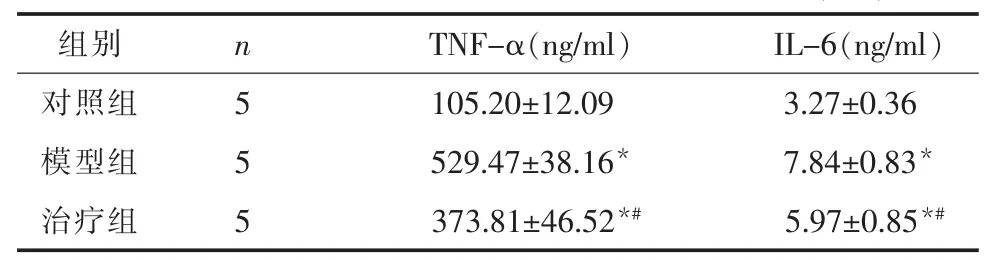
表2 各组大鼠海马部位TNF-α及IL-6的含量(±s)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05。
组别 n TNF-α(ng/ml)IL-6(ng/ml)对照组 5 105.20±12.09 3.27±0.36模型组 5 529.47±38.16* 7.84±0.83*治疗组 5 373.81±46.52*# 5.97±0.85*#
2.3 Western blot检测大鼠海马 Bax、Bcl-2及Caspase-3的表达 利用Western blot方法检测各组大鼠海马Bax、Bcl-2及 Caspase-3的表达 (表 3及图1)。模型组大鼠海马Bcl-2的表达明显减少,差异有统计学意义(P<0.05);治疗组大鼠海马 Bcl-2的表达与模型组相比增多,但仍低于对照组,差异有统计学意义(P<0.05)。 模型组大鼠海马Bax和Caspase-3的蛋白表达明显升高,差异有统计学意义(P<0.05);治疗组大鼠海马 Bax 和 Caspase-3 的蛋白表达与模型组相比降低,但仍高于对照组,差异有统计学意义 (P<0.05)。结果提示模型大鼠的Bax和Caspase-3等促凋亡蛋白增高、抗凋亡蛋白Bcl-2减少,说明其海马凋亡增多;而白藜芦醇治疗可减少糖尿病大鼠海马凋亡的发生。
表3 各组大鼠海马Bcl-2、Bax及Caspase-3蛋白的表达(±s)
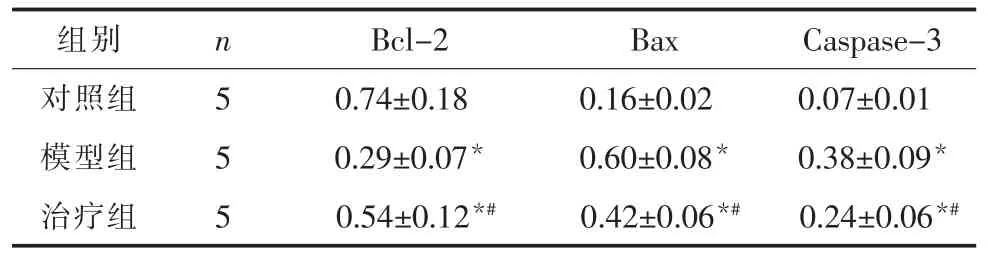
表3 各组大鼠海马Bcl-2、Bax及Caspase-3蛋白的表达(±s)
注:与对照组相比,*P<0.05;与模型组相比,#P<0.05。
组别 n对照组 5模型组 5治疗组 5 Bcl-2 Bax Caspase-3 0.74±0.18 0.16±0.02 0.07±0.01 0.29±0.07* 0.60±0.08* 0.38±0.09*0.54±0.12*# 0.42±0.06*# 0.24±0.06*#
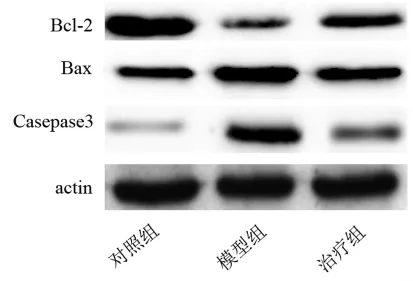
图1 各组大鼠凋亡相关蛋白表达
3 讨论
糖尿病是认知障碍及痴呆的危险因素之一。据报道,糖尿病患者的痴呆发病率总体上超过50%[8]。与非糖尿病患者相比,患者会伴随明显的认知下降[9]。啮齿动物的糖尿病模型同样表现出了认知功能的受损,利用链脲佐菌素(STZ)诱导的糖尿病大鼠显示了学习能力下降[10]。然而,对于认知障碍的治疗尚无有效措施。糖尿病是社会公共卫生的一个严峻问题,各种降糖药或胰岛素会引起许多不良反应,并面临胰岛素抵抗或低血糖症等重大挑战。最近的趋势是使用天然药物治疗糖尿病及其并发症,它可以产生同样的功效而不会产生很多不良反应[11]。白藜芦醇是一种天然存在的多酚类物质,在许多可食用植物的表皮中存在,白藜芦醇的有益作用是通过多种途径来实现的,这些途径包括控制炎症、抗氧化应激、保护线粒体功能和抑制细胞凋亡等[12-14]。白藜芦醇已被证实能改善各种类型急性中枢神经损伤的组织病理学和行为结果,包括中风,创伤性脑损伤,蛛网膜下腔出血和脊髓损伤等[15-17]。该实验发现,糖尿病大鼠的认知功能出现了明显的下降,经过4周的白藜芦醇治疗后,糖尿病大鼠的认知功能得到了明显的改善。
炎症反应是一种生理调节,它可以调节糖尿病患者的神经可塑性和神经发生,却不依赖于高血糖或皮质酮的分泌情况[18]。大量研究证实促炎因子的升高与糖尿病密切相关[19]。糖尿病会增加人类和动物的炎症反应,通过促进炎症因子的释放从而导致海马产生抗神经发生作用[20]。肿瘤坏死因子(TNF-α)是一种促炎性细胞因子,主要由激活的吞噬细胞,T淋巴细胞和肥大细胞产生[21]。 TNF-α是在激活宿主先天防御时首先产生的促炎细胞因子,上皮和内皮细胞是其主要靶点[22,23]。 TNF-α 对目标细胞产生多重影响,包括刺激这些细胞产生和释放多种炎性细胞因子[24]。IL-6是一种多功能的细胞因子,与宿主的先天防御和炎症反应密切相关,在多种炎症条件下,IL-6 的含量均会增加[25]。 TNF-α 及 IL-6等促炎因子被认为与糖尿病大鼠的认知功能障碍密切相关,减少TNF-α及IL-6的表达可有效改善糖尿病大鼠的认知功能[26]。该实验观察到糖尿病大鼠海马TNF-α及IL-6的表达增多,治疗组大鼠海马TNF-α及IL-6的表达减少,提示白藜芦醇对于糖尿病大鼠具有明显的抗炎特性,这可能是白藜芦醇改善糖尿病大鼠认知功能的重要作用机制之一。
凋亡是一种程序性的细胞死亡方式,在细胞死亡的众多不同机制中,细胞凋亡被提出用以解释许多神经障碍中所观察到的细胞缺失,如阿尔茨海默病、血管性痴呆、帕金森病、肌萎缩侧索硬化、卒中等[27]。Bcl-2和Bax是负责调控细胞凋亡的两个主要基因。Bcl-2是抗凋亡家族的关键成员,它对调节线粒体介导的细胞凋亡至关重要[28,29]。 Bcl-2 的过度表达已经被证明可以保护神经细胞免受神经毒素的伤害[30]。Bax属于促凋亡子家族中的一员,它通过转移到线粒体膜上,促进细胞色素C的释放,从而促进下游的细胞凋亡过程[31]。Caspase属于半胱氨酸蛋白酶家族,是细胞凋亡的重要介质。Caspase参与凋亡过程主要通过两种不同的途径:死亡受体途径和线粒体途径[32]。无论涉及什么途径,Caspase-3都扮演着凋亡执行者的作用。Caspase-3是一种促凋亡酶[33,34],通过激活 DNA 分裂因子,进而激活内切酶分裂核DNA,最终导致细胞凋亡。Zhao等[35]研究发现糖尿病增加Bax和Caspas-3的表达,从而进一步导致了STZ诱导的糖尿病大鼠的锥体神经元细胞凋亡。高血糖使海马神经元细胞中活性氧升高,导致ATP的活性降低,使Caspases-3和Caspases-9表达增加,从而产生Caspase依赖性的细胞凋亡发生[36]。该实验观察到糖尿病大鼠海马Caspase-3和Bax的表达增多,而Bcl-2降低,说明糖尿病大鼠出现了海马凋亡途径的激活。治疗组大鼠海马Caspase-3和 Bax的表达减少,Bcl-2的表达增多,提示白藜芦醇治疗对于糖尿病大鼠具有明显的抗凋亡特性。
综上所述,白藜芦醇治疗可明显改善糖尿病大鼠认知功能的损伤,降低促炎因子子TNF-α及IL-6的表达,抑制了凋亡相关蛋白的表达,其对糖尿病大鼠认知功能的改善作用机制可能与抑制凋亡途径和抗炎作用密切相关。为临床糖尿病相关认知功能障碍和其他类型痴呆的有效治疗提供了更多的理论支持。
