两种不同纳米金修饰方法制备的Au/CeO2复合物的抗氧化性能*
2019-01-21法孟梅
法孟梅,姚 鑫
(中国科学院大学 化学科学学院, 北京 100049)(2017年12月18日收稿; 2018年3月6日收修改稿)
近年来,Au/CeO2已经被广泛应用到电化学、催化等各个领域,并展现出优异的性能[1-3]。纳米Au和CeO2的结合使二者各自的优势相互补充,能够在一种复合物上得到充分发挥。纳米Au的稳定性、生物相容性和尺寸可选择性以及CeO2独有的氧化还原特性,使Au/CeO2作为抗氧化剂在生命健康领域具有相当大的潜力,现已有许多研究发现,Au/CeO2复合物在具备良好生物相容性的同时,能够展现出比未经修饰的CeO2更强的抗氧化性能[4-6]。
目前用于研究的Au/CeO2中,通常是由经典的简单沉积法来完成Au的负载,但是沉积法制备过程需要高温,这个过程形成的Au颗粒不稳定,尺寸难以控制,可能会在制备和反应过程中产生聚集或脱落,导致材料的活性下降。溶胶法作为一种更为可控的方法,在制备金属及金属复合物领域也引起人们的关注。此法是将金属预先制备成金属溶胶,再将预制好的金属颗粒固定在载体上。其优点是广泛适用于不同性质的载体,并且所制备金属的尺寸和粒径分布可调控,能够实现高分散的金属负载复合物的制备[7]。这种方法也被提出用于制备需要负载的纳米Au的复合物,其中,PVA作为一种廉价易得、无毒可溶的稳定剂被用于金溶胶的制备,从而调整AuNPs的尺寸和粒径分布[8-9]。不同制备方法得到的材料在性能方面必然会发生改变,通过比较不同制备方法得到的Au/CeO2的抗氧化性能,能够有针对性地对现有方法进行调整和改进,进而优化Au/CeO2的性能,这将对Au/CeO2在生物医学领域的应用起到巨大的推动作用。
本文中,我们以水热法制备的CeO2纳米棒为载体,分别采用溶胶法和沉积法对CeO2进行纳米金修饰,得到两种不同方法制备的Au/CeO2。在MV-Fenton体系中用紫外分光光度法对两种Au/CeO2的抗氧化性能进行研究,并结合TEM、HRTEM、XPS、XRD和Raman等表征方式,探索造成二者抗氧化性能差异的原因。研究结果表明:溶胶法制备的Au/CeO2上Au的粒径分布更均匀,并且比沉积法制备的Au/CeO2展现出更好的抗氧化性能。
1 实验部分
1.1 材料和仪器
硝酸亚铈(Ce(NO3)3·6H2O),甲基紫(MV),盐酸(HCl),聚乙烯醇(PVA),四水·氯金酸(HAuCl4·4H2O),六亚甲基四铵(HMT),国药集团试剂有限公司;氢氧化钠(NaOH),七水硫酸亚铁(FeSO4·7H2O),过氧化氢(H2O2, 35%),三羟甲基氨基甲烷(Tris),美国西格玛奥德里奇试剂公司;超纯水(18.25 MΩ·cm)。
透射电子显微镜(TEM):FEI TECNAI G2F20,美国FEI公司;X射线光电子能谱分析仪(XPS):ESCALAB 250XI,赛默飞世尔科技有限公司;X射线衍射仪(XRD):Bruker D8 Advance,德国布鲁克公司;显微拉曼光谱仪(Raman):inVia Reflex,英国雷尼绍公司;双光束紫外可见分光光度计(UV):AOE-A560,翱艺仪器(上海)有限公司。
1.2 两种Au/CeO2的合成与表征
1.2.1 CeO2纳米棒的合成
首先,用水热法合成CeO2纳米棒,方法[10]如下:将20 mL 0.175 mol/L Ce(NO3)3·6H2O迅速加入20 mL 4 mol/L NaOH溶液,剧烈搅拌30 min,待混合液冷却至室温,将混合液转入50 mL反应釜中,100 ℃下反应14 h,反应后的混合液离心去除上清液,用超纯水反复洗涤沉淀后,在50 ℃下干燥10 h,得到CeO2纳米棒粉末。
1.2.2 溶胶法制备Au/CeO2
金溶胶的合成方法[11]如下:将适量的PVA溶液加入到HAuCl4溶液中(Au∶PVA=1.5∶1 mg·mg-1),剧烈搅拌10 min,然后快速加入一定浓度的NaBH4溶液(Au∶NaBH4=1∶5 mol·mol-1),此时,溶液的颜色变为深棕色,表明金溶胶成功合成。取0.1 g CeO2粉末分散在超纯水中,与制备好的金溶胶按比例混合(使Au的质量分数为4.6%),持续搅拌10 h后,离心洗涤,在50 ℃下干燥10 h,得到溶胶法制备的Au/CeO2粉末。
1.2.3 沉积法制备Au/CeO2
取0.1 g CeO2粉末分散在超纯水中,然后逐滴加入10 mL 2.4 mmol/L HAuCl4溶液(使Au的质量分数为4.6%),在100 ℃加热状态下持续搅拌至完全干燥。将得到的金黄色粉末用超纯水重新分散,随后加入1 mL 10.0 mmol/L NaBH4,继续搅拌10 min后,离心洗涤,在50 ℃下干燥10 h,得到沉积法制备的Au/CeO2粉末。
1.2.4 材料的表征
材料合成后,分别用TEM、HRTEM、XPS、XRD和Raman等方式对材料的形貌、尺寸、晶面、价态等表面状态进行表征,并结合表征结果对不同负载方式制备的Au/CeO2复合物进行抗氧化性能的探究。
1.3 抗氧化性能的测定
将合成好的两种材料分散在超纯水中,制备成1.6 mmol/L Au/CeO2母液,充分超声后备用。用于紫外测定的样品中各组分按以下顺序依次加入到pH 4.7 0.1 mol/L Tris-HCl缓冲液中,并且使得各组分最终浓度分别为MV (1.2×10-5mol/L),FeSO4(0.18、0.45 mmol/L),Au/CeO2(4~80 μmol/L),H2O2(0.1 mol/L)。 最终样品的总体积为5 mL。将各组分混合后震荡5 min立即用紫外-可见分光光度计进行测定。
2 结果与讨论
2.1 材料的表征
图1为载体CeO2纳米棒和两种不同修饰方法制备的Au/CeO2的TEM图和HRTEM图。如图所示,我们成功合成了长度约为50~130 nm,直径约为8~12 nm的CeO2纳米棒(图1(a)),HRTEM图像显示其主要暴露(111)和(110)两种晶面(图1(d))。在CeO2纳米棒表面分别用溶胶法(图1(b))和沉积法(图1(c))修饰纳米金后,CeO2表面附着许多深色颗粒,并且附着在CeO2表面的颗粒暴露Au最常见的(111)晶面(图1(e, f)),这表明纳米金成功修饰在CeO2上。另外,比较两种负载方式制备的Au/CeO2中Au的粒径,可以看出:在S-Au/CeO2上,Au的粒径分布比较均匀,为4 nm左右(图1(e));而在D-Au/CeO2上,Au颗粒的大小不一,粒径分布不均匀,大约为2~8 nm,能明显地看到较大Au颗粒的出现(图1(f))。这说明与沉积法相比,溶胶法制备过程中Au的粒径能被很好地控制分布均匀,这与文献报道[12]一致。造成这种差异是由于在溶胶法制备过程中加入了PVA,其带有羟基的长碳链骨架通过范德华力和Au作用而起到空间稳定的作用,使Au的尺寸能够均匀分布[13]。

图1 CeO2、S-Au/CeO2和D-Au/CeO2纳米棒的TEM (a-c) 和HRTEM (d-f) 图Fig.1 TEM (a-c) and HRTEM (d-f) images of CeO2,S-Au/CeO2,and D-Au/CeO2 nanorods
2.2 抗氧化性能的测定
材料成功合成后,用紫外分光光度法在MV-Fenton体系中对不同负载方法制备的两种Au/CeO2的抗氧化性能进行测定。紫外测定原理如图2所示:MV在582 nm处有最大吸收波长(曲线A), 当体系中存在·OH时,MV的吸收峰值下降(曲线C, E),其间的差值用ΔA表示,并且ΔA的值与体系中·OH的浓度成正比。当含有自由基的体系中加入抗氧化剂,·OH部分被清除,吸收峰值回升(曲线B, D),回升值用Δa表示,并且Δa与清除自由基的数量成正比。为使实验结果看起来更直观,用Δa/ΔA表示材料的抗氧化活性:Δa/ΔA小于1时,材料显示抗氧化性,且数值越小,抗氧化活性越强[14]。

各曲线对应体系中的组成分别为:(A) MV,(B) MV+Fenton (低)+Au/CeO2,(C) MV+Fenton (低)/ 0.1 mol/L H2O2+0.18 mmol/L FeSO4,(D) MV+Fenton (高)+Au/CeO2,(E) MV+Fenton (高)/0.1 mol/L H2O2+0.45 mmol/L FeSO4。图2 MV-Fenton体系中抗氧化性能示意图Fig.2 Diagram of antioxidant activity in MV-Fenton reagent system
两种Au/CeO2抗氧化活性的测定结果如图3所示。从图3(a)可以看出,低自由基浓度体系下,两种Au/CeO2在所取浓度范围内Δa/ΔA均小于1,表明两种材料在此区间均显示抗氧化性能;并且,随着体系中材料浓度的升高,二者展现出的抗氧化活性也随之增强,这与之前报道的结果[6]相符。比较两种材料的Δa/ΔA数值可以得出,溶胶法制备Au/CeO2的Δa/ΔA数值总是比沉积法制备Au/CeO2的小,这说明S-Au/CeO2总是展现出比D-Au/CeO2更强的抗氧化活性。在高自由基浓度体系中,能够得出与在低浓度体系中相同的结论:两种材料的抗氧化性能随材料浓度的升高而增强,并且S-Au/CeO2展现比D-Au/CeO2更好的抗氧化活性(图3(b))。
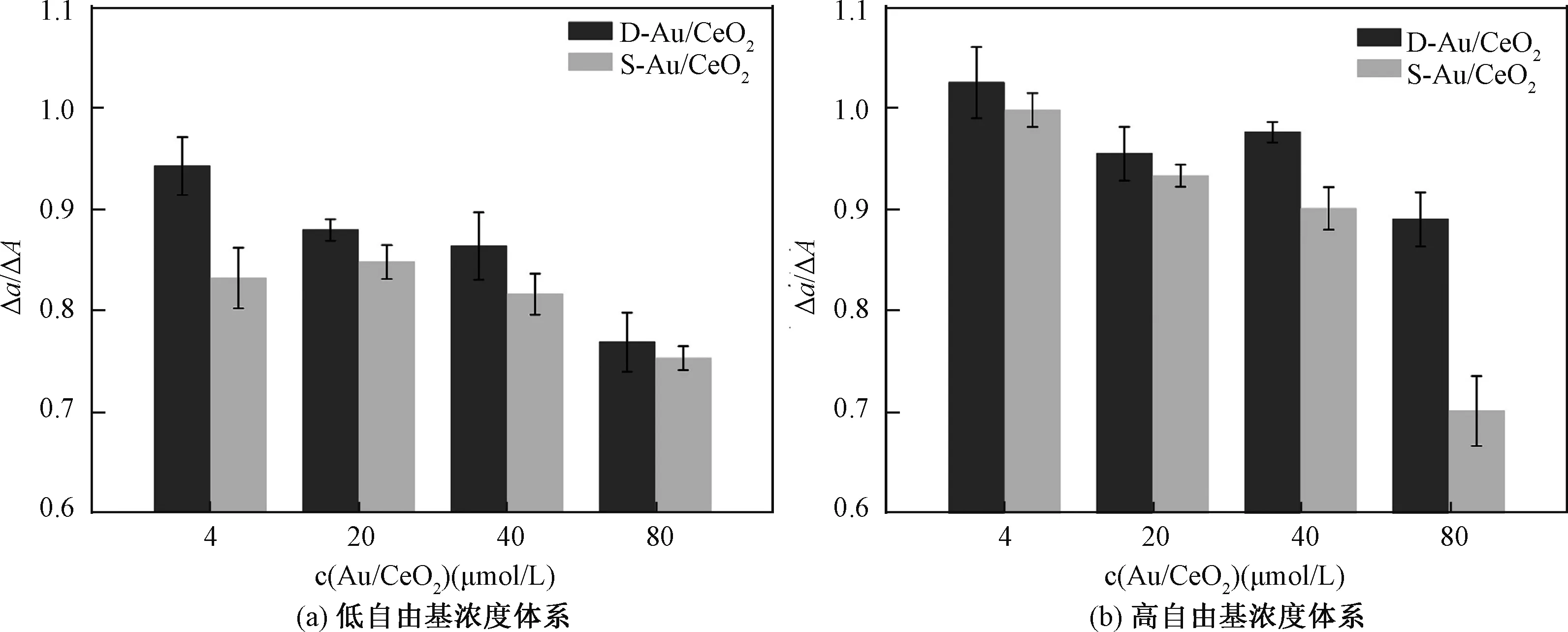
图3 D-Au/CeO2和S-Au/CeO2在高/低自由基浓度体系中的抗氧化性能Fig.3 Antioxidant activities of D-Au/CeO2 and S-Au/CeO2 in the systems with high and low free radical concentrations
另外,比较高、低自由基浓度体系中材料的抗氧化性可以看出,两种材料在不同自由基浓度下都展现抗氧化性能,但是高自由基体系中材料的抗氧化性比低自由基体系中差,这是由于体系中自由基含量太多引起的。从图2中可以看出,增加体系中FeSO4的浓度,紫外吸收曲线的峰值明显下降(曲线E),表明体系中自由基含量显著增加,故ΔA值增加,但是材料清除自由基的能力有限,使得高自由基体系中Δa/ΔA值减小,材料的抗氧化性较低自由基体系中有所减弱。但无论体系中自由基浓度和材料本身浓度多少,溶胶法制备的Au/CeO2均展现更高的抗氧化活性。
2.3 影响因素探究
为探究S-Au/CeO2展现出比D-Au/CeO2更好的抗氧化活性的原因,对两种材料的性质进行更加深入的研究。首先,用XRD和Raman对未经修饰的CeO2、溶胶法制备的S-Au/CeO2和沉积法制备的D-Au/CeO2这3种材料进行表征,表征结果如图4所示。XRD结果(图4(a))显示,曲线A和曲线B的形状和高度没有显著的差异,这表示溶胶法制备的Au/CeO2(B)与未经修饰的CeO2(A)相比,CeO2的晶型没有发生明显的改变,说明溶胶法负载在表面的Au未对CeO2的表面结构产生太大影响;然而,从沉积法制备的Au/CeO2表征结果看出,与曲线A相比,曲线C的形态发生很大变化,意味着CeO2的晶型发生显著改变,这可能是沉积法负载Au的过程极大地破坏CeO2的表面结构。因此,这种对CeO2表面结构的改变可能是影响两种材料抗氧化性能显现的重要原因。
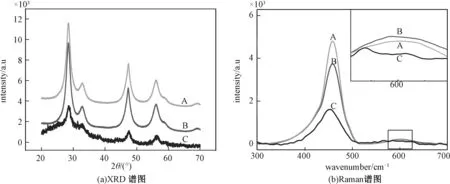
(b)中插图为595 cm-1处的细节图;3条曲线分别表示:A:CeO2,B:S-Au/CeO2,C:D-Au/CeO2。图4 3种纳米材料的XRD和Raman光谱图Fig.4 XRD and Raman patterns of the three CeO2 nanomaterials
以上结果从Raman表征结果(图4(b))中可以得到印证:464 cm-1处高峰对应的是萤石立方结构CeO2的拉曼振动模式(曲线A)[15]。如图所示,溶胶法负载Au后,此处的峰值稍有下降(曲线B),这可能是因为少量Au的附着使CeO2的表面发生轻微的变化;而从曲线C可以看出,沉积法负载Au后,D-Au/CeO2曲线的峰较未经修饰的CeO2有明显下降,说明CeO2的表面结构发生显著改变,这种改变可能是因为沉积法制备的加热过程对CeO2造成损害。另外,595 cm-1处矮峰的出现与CeO2表面的氧空位的存在有关[16]。从细节放大图中看到,与未经修饰的CeO2(曲线A)相比,溶胶法负载Au后CeO2在此处的峰值基本不变(曲线B);而沉积法负载Au后,峰值却有所降低(曲线C),这表明Au的沉积使CeO2表面氧空位的含量发生改变。产生这种现象的原因可能是:在沉积法制备过程中,Au最初以离子的形式与CeO2接触,而后以CeO2为依托被还原、生长、形成颗粒,这个过程有可能会导致Au与CeO2接触的表面积过大而覆盖CeO2的氧空位点;而相比溶胶法制备过程,Au与CeO2接触前已形成颗粒态,附着在CeO2表面时不会过多地遮蔽其表面的氧空位点。以上结果进一步证明溶胶法制备的Au/CeO2体现出更高的优越性,而沉积法制备过程会破坏CeO2的表面结构,进而降低材料的抗氧化性能。
已有文献报道,材料表面Ce3+的含量与其性能也有着密切的关系[17]。为了进一步探究造成两种材料抗氧化性能的差异影响因素,用XPS对材料的表面状态进行研究,表征结果如图5所示。XPS计算结果显:CeO2、S-Au/CeO2和D-Au/CeO2表面Ce3+的含量分别为21.0%、25.5%和20.3%(图5(a)),这说明溶胶法负载Au后,CeO2表面Ce3+含量上升,而沉积法负载Au后,CeO2表面Ce3+含量基本不变;另外,从Au/CeO2中Au的XPS结果(图5(b))中可以看出,溶胶法负载的Au在CeO2表面有Au+的存在,而沉积法负载的Au以Au0的形式存在。从以上结果中可以推断,溶胶法负载的Au和CeO2之间可能存在一个Au-Ce电子传递过程,表面的Ce4+转变为Ce3+,从而使S-Au/CeO2表面Ce3+含量上升,同时Au以Au+的形式存在于CeO2表面;而表面Ce3+含量的增加有利于抗氧化活性的展现,这也是溶胶法比沉积法制备的Au/CeO2抗氧化活性更强的一个重要原因。

图5 不同纳米金修饰方法制备的Au/CeO2的XPS图谱比较Fig.5 XPS spectra of Au/CeO2 prepared by different modification methods
3 结论
本文以CeO2纳米棒为载体,分别用溶胶法和沉积法制备两种不同的Au/CeO2复合物,并对两种Au/CeO2的抗氧化性能进行研究,进而探索造成二者性能差异的影响因素。实验结果表明,S-Au/CeO2展现出比D-Au/CeO2更强的抗氧化活性。我们认为,造成这种差异的原因有以下两点:第一,沉积法在加热过程中可能会对CeO2的表面结构造成损害,并且Au先接触后生长的方式可能会遮蔽CeO2表面的氧空位点,影响其表面结构,从而使抗氧化性能的展现受到阻碍;而溶胶法制备过程中不需要高温,纳米Au先形成后负载的方式也不会遮蔽CeO2的氧空位点。第二,溶胶法负载的Au和CeO2之间存在电子传递过程,使得材料表面的Ce3+含量上升,也有利于增强材料的抗氧化性。本研究为Au/CeO2复合物在抗氧化领域的应用提供了新的理论依据。
