氧化苦参碱对胰腺癌细胞上皮间质转化及Gli2表达影响
2019-01-18刘百庆张文成夏时海
刘百庆,张 斌,许 威,张文成,夏时海
(中国人民武装警察部队特色医学中心 肝胆胰脾中心,天津 300162)
胰腺癌是一种难治性疾病,与其早期转移且诊断困难而延误治疗时机有很大关系,因而研发针对胰腺癌侵袭转移的药物具有重要的临床价值。上皮间质转化(epithelial-mesenchymal transition,EMT)是肿瘤细胞发生转移的重要机制,它是指上皮细胞失去极性、细胞间接触转变成间质样细胞的过程,伴随细胞外基质(extracellular matrix,ECM)的大量产生,从而促进细胞的侵袭转移[1-2]。在胰腺癌患者中,绝大部分为胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)。大量研究证实,EMT在PDAC的侵袭转移中发挥了重要作用。Panc-1细胞是一种常见的用于研究PDAC生物学特性的低分化胰腺癌细胞株,并且,常见的EMT诱导因子转化生长因子β1(transforming growth factor β1,TGF β1)可通过激活hedgehog等信号通路诱导panc-1细胞构建EMT模型[3-5]。已有大量的药物研究用于对抗胰腺癌的EMT从而抑制癌细胞侵袭转移[3,5]。氧化苦参碱(oxymatrine,OM)为中药苦参干燥根中提取的生物碱,具有广泛的抗肿瘤作用,可抑制胰腺癌细胞的侵袭转移[6-8]。此外,研究也发现,OM可以抑制结肠癌细胞的侵袭转移,其机制与OM可抑制EMT有关[9-10]。然而,OM对胰腺癌panc-1细胞EMT是否有抑制作用及其机制仍不清楚。基于上述研究,我们在TGF β1诱导panc-1细胞构建EMT模型的基础上,利用OM进行干预,检测EMT相关因子的表达变化;同时检测hedgehog信号通路中核心转录因子Gli2的表达变化,初步探讨OM对胰腺癌侵袭转移的作用及其可能机制,为研发抗癌药物提供理论基础。
1 材料与方法
1.1 材料 人胰腺导管癌细胞株panc-1购自中科院上海生科院细胞资源中心;高糖DMEM培养基购自美国Gibco公司;胎牛血清(fetal bovine serum,FBS)购自美国Gibco公司;青链霉素混合液购自北京索莱宝公司;OM购自英国Abcam公司;TGF β1购自美国Sigma公司;Transwell小室购自美国Millipore公司;Matrigel基质胶购自美国BD公司;蛋白Marker购自北京索莱宝公司;RIPA蛋白裂解液购自上海碧云天公司;BCA蛋白浓度测定试剂盒购自北京鼎国昌盛公司;PVDF膜购自美国BD公司;单克隆兔抗人E-cadherin、兔抗人Vimentin、兔抗人Snail1、兔抗人Twist1和兔抗人GAPDH 购自沈阳万类公司;兔抗人Gli2购自武汉三鹰公司;辣根过氧化物酶(HRP)标记羊抗兔IgG二抗购自北京鼎国昌盛公司;ECL发光液购自上海碧云天公司;垂直板电泳槽、电泳仪、转膜槽购自美国Bio-Rad公司;5200Multi自动荧光/化学发光成像仪购自上海天能科技有限公司;ECLIPSE Ti-U荧光倒置显微镜购自日本Nikon公司。
1.2 方法
1.2.1 细胞培养 Panc-1细胞用含10%FBS、1%青链霉素的高糖DMEM培养基常规传代培养于37 ℃、5%CO2的孵育箱中。取对数生长期细胞随机分为4组:对照组(Control组)、模型组(TGF β1∶10 ng/mL)[3-5]、OM治疗组 (TGF β1 10 ng/mL+OM 1 mg/mL)[7-8,11]、OM对照组(OM:1 mg/mL)。待细胞增至70%~80%接触率时用不含FBS的DMEM培养基饥饿4 h后加入OM,作用0.5 h后再加入TGF β1,OM作用24 h,TGF β1作用48 h后终止培养。每组实验重复3次。
1.2.2 Transwell法测细胞侵袭力 取对数生长期的panc-1细胞计数,用不含血清的DMEM培养基配成2.5×105/mL的细胞悬液;在24孔板中加入500 μL含血清的DMEM培养基,而后将提前涂过Matrigel基质胶的Transwell小室放入其中,每个小室上室加入配制好的细胞悬液200 μL,周围孔用D-Hank’s缓冲液填充;设如上4组,37 ℃、5%CO2的孵育箱中培养48 h;而后取出小室, PBS缓冲液清洗3次后分别以4%多聚甲醛固定20 min、0.1%结晶紫染液染色15 min;用棉签除掉上室面细胞,显微镜下观察各组穿透到下室面的细胞数量。每组实验重复3次。
1.2.3 Western blot检测EMT相关蛋白及Gli2表达 超声裂解法提取各组panc-1细胞总蛋白,BCA法测定浓度后电泳分离,条件为恒压80 V、30 min之后调至120 V至分离完毕,样品量20 μg;电泳结束后以90 V恒压90 min冰浴下将聚丙烯酰胺凝胶上的蛋白转至PVDF膜;转膜结束后将目的蛋白条带置于含5%脱脂奶粉的TBST缓冲液中封闭3 h;加入相应的一抗稀释液(E-cadherin、Twist1、Gli2稀释度为1∶500,Vimentin、Snail1、GAPDH稀释度为1∶1 000),4 ℃条件下孵育过夜,TBST洗膜后加入HRP标记的羊抗兔IgG二抗稀释液(稀释度1∶10 000)室温中孵育3 h,再次以TBST洗膜,ECL化学发光显影。以GAPDH 作为内参,Image J软件测取条带灰度值进行统计,目的蛋白相对表达量=目的蛋白灰度值/GAPDH灰度值。
1.3 统计学分析 采用GraphPad Prism 6软件进行统计分析。多组间比较用单因素方差分析,两组比较采用SNK法,P<0.05为差异有统计学意义。
2 结果
2.1 OM对panc-1细胞侵袭力影响 为研究OM对胰腺癌panc-1细胞侵袭力影响,首先以TGF β1诱导panc-1细胞构建EMT模型。如图1所示,与对照组相比,TGF β1(10 ng/mL)刺激panc-1细胞后,侵袭到小室下室面细胞数量明显增加;OM(1 mg/mL)干预后,细胞数量减少;单独以OM刺激panc-1细胞,与对照组相比细胞数量无明显改变。上述结果表明OM可能是通过抑制EMT发生抑制了panc-1细胞的侵袭。
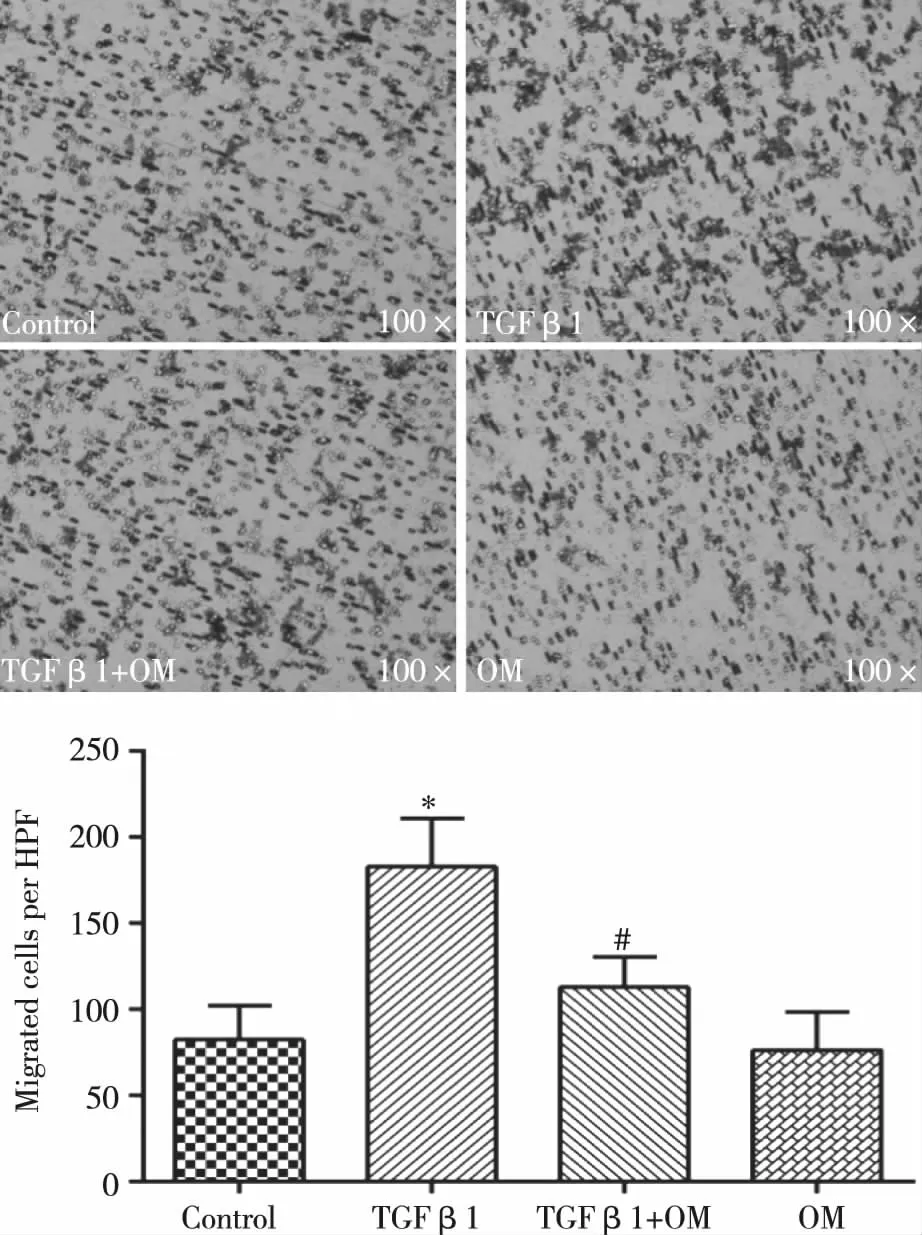
与对照组相比,*:P<0.05;与TGF β1组相比,#: P<0.05。图1 OM对panc-1细胞侵袭力影响
2.2 OM对TGF β1刺激的panc-1细胞中EMT相关蛋白表达影响 与对照组相比,TGF β1(10 ng/mL)刺激panc-1细胞后,EMT相关转录因子Snail1、Twist1表达上调;同时,上皮标志物E-cadherin表达下调,间质标志物vimentin表达上调。OM(1 mg/mL)干预后,上述结果被逆转。单独的OM对EMT相关蛋白表达无影响(见图2)。
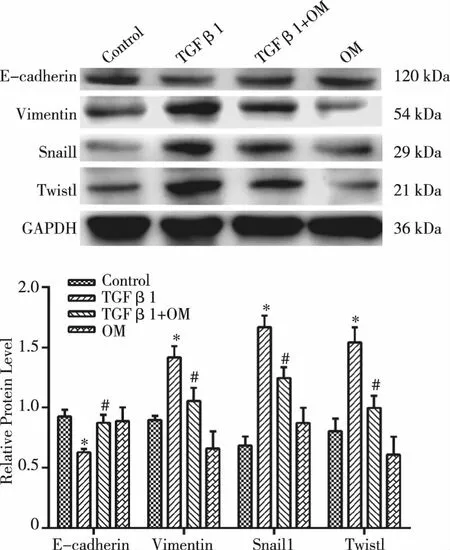
与对照组相比,*:P<0.05;与TGF β1组相比,#: P<0.05。图2 OM对TGF β1刺激的panc-1细胞中EMT相关蛋白表达影响
2.3 OM对TGF β1刺激的panc-1细胞中Gli2表达影响 与对照组相比,TGF β1(10 ng/mL)刺激panc-1细胞后,hedgehog信号通路核心转录因子Gli2表达上调。OM(1 mg/mL)干预后,上述结果被逆转。单独的OM对Gli2蛋白表达无影响(见图3)。
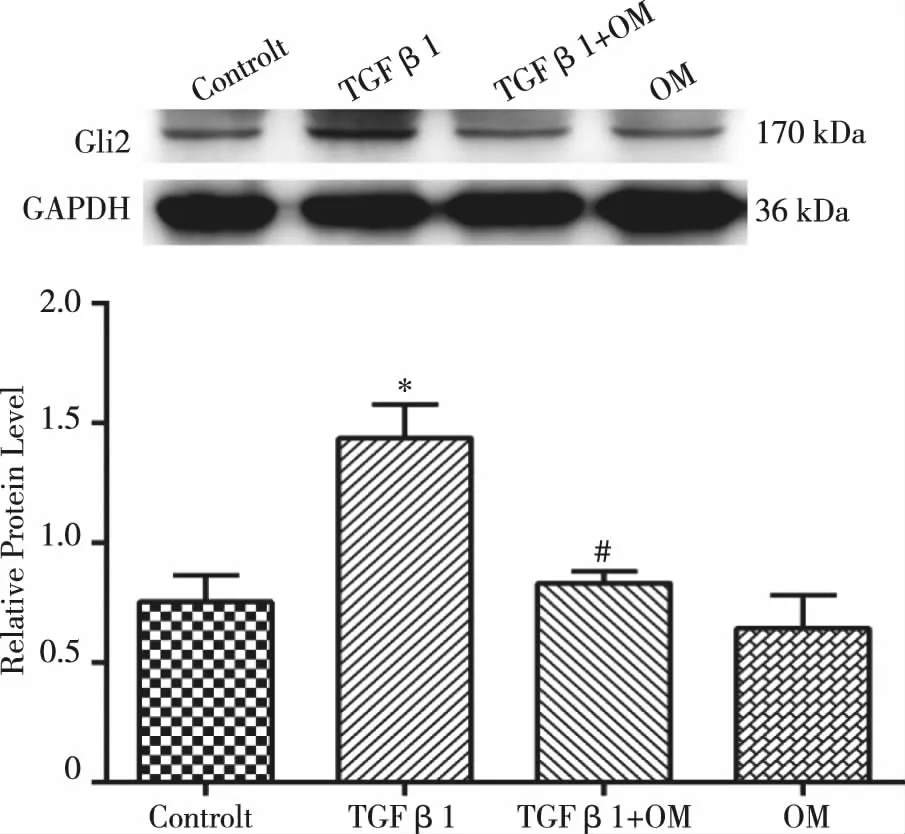
与对照组相比,*:P<0.05;与TGF β1组相比,#: P<0.05。图3 OM对TGF β1刺激的panc-1细胞中Gli2蛋白表达影响
3 讨论
胰腺癌是恶性程度极高的恶性肿瘤之一,被称为“癌中之王”。在我国,其死亡率位于消化系统恶性肿瘤死亡的第4位,近年来发病率有明显增高的趋势。美国癌症协会调查表明,胰腺癌死亡率正以每年0.3%的速度增加,5年生存率仅为6%~8%[12]。根治性的手术治疗是最有效的治疗方式之一,然而胰腺癌早期即可发生转移,约80%患者就诊时转移已发生,尸检中更是发现约90%患者都存在远处转移[1,13],因而研究胰腺癌的转移机制、研发有效的抗转移药物对于延长胰腺癌患者的生存周期有着重要的意义。
EMT是胰腺癌侵袭转移的重要机制之一,大量的研究已经证实胰腺癌细胞在多种信号通路、microRNAs等的调节下,通过启动EMT导致上皮细胞间连接的关键蛋白E-cadherin、ZO-1表达减少,同时细胞获得极性,使迁移侵袭能力得到增强[1-5]。TGF β1是常用的EMT诱导因子,可诱导PDAC细胞株panc-1构建EMT模型[3-5]。我们的实验中,10 ng/mL的TGF β1刺激panc-1细胞48 h后,细胞侵袭力得到明显增强;同时,Western blot结果表现为EMT相关转录因子Snail1 、Twist1及间质标志蛋白vimentin表达上调而上皮标志蛋白E-Cadherin表达下调,说明EMT模型建立成功。在此基础上,我们探讨了OM对胰腺癌EMT的作用。OM是课题组前期一直研究的一种中药提取物,具有广泛的生物学作用,包括抗癌和抗纤维化等,但具体机制尚未研究清楚[14]。前期研究发现,OM可以抑制胰腺癌SW1990细胞的侵袭力,但其与EMT之间的关系还不清楚[8]。除胰腺癌之外,OM还可以抑制其他肿瘤的侵袭转移[6,15-17],特别是OM可以通过抑制EMT进而抑制结肠癌细胞的侵袭转移[9-10]。在其他方面,有研究发现OM可以通过抑制EMT进而抑制胰腺、肺、肾等器官的纤维化[18-20],提示OM对EMT具有抑制作用。本实验中,OM作用于TGF β1刺激的panc-1细胞后,细胞增强的侵袭力得到抑制;同时,EMT相关标志蛋白的表达被逆转,提示OM对胰腺癌EMT具有抑制作用。然而,单独使用1 mg/mL的OM对panc-1细胞的侵袭力及EMT相关蛋白表达的影响并不明显,其原因可能与panc-1细胞分化程度低、OM作用浓度及时间不足等有关,有待进一步研究。上述研究结果表明,OM可能日后作为单一或联合其他化疗药物用于胰腺癌的临床治疗。
最后,我们初步探讨了一下OM抑制胰腺癌panc-1细胞EMT的可能机制。多种信号通路都可参与调节TGF β1诱导的胰腺癌EMT过程。马笛等[21]在研究大蒜素对TGF β1诱导的胰腺癌EMT抑制作用中发现,NF-κB信号通路可能参与了panc-1细胞EMT的发生。此外,TGF β1/Smad、Akt/mTOR、MAPK、hedgehog等信号通路也参与了TGF β1诱导的胰腺癌EMT发生[22-25]。另一方面,Jun二聚化蛋白2(Jun dimerization protein 2,JDP2)、Rac1b、DNA甲基化结合蛋白3 (Methyl-CpG-binding domain 3,MBD 3)等蛋白还可通过负向调节MAPK、TGF-β/Smad等信号通路进而抑制TGF β1诱导的胰腺癌EMT发生[26-28]。此外,研究发现OM也可以通过抑制TGF β1/Smad、NF-κB等信号通路抑制肿瘤细胞的EMT过程[9-10]。值得关注的是,hedgehog信号通路广泛参与了胰腺癌EMT过程。Gli蛋白家族是hedgehog信号通路中的核心转录因子,其中,Gli1、Gli2均有转录激活作用,在胰腺癌EMT过程中发挥重要作用[4,29]。研究发现,TGF β1诱导胰腺癌细胞后通过募集Smad3结合到Gli2的启动子区诱导Gli2的表达,后者表达又可进一步上调Gli1的表达[30]。并且课题组最近研究发现,OM可抑制TGF β1诱导的panc-1细胞中Smad3/Gli1的表达[31]。然而,OM对Gli2是否也有抑制作用未有研究。我们的实验中,TGF β1刺激panc-1细胞后Gli2表达上调;OM干预后,Gli2表达被抑制,结合课题组前期结果,提示OM对hedgehog信号通路具有一定的抑制作用。
综上所述,TGF β1诱导panc-1细胞构建EMT模型后给予OM进行干预,panc-1细胞的侵袭力及EMT相关标志物表达受到抑制;同时,OM还抑制了TGF β1刺激引起的hedgehog信号通路中核心转录因子Gli2的高表达,结合研究已证实hedgehog信号通路参与调控胰腺癌的EMT过程及OM对胰腺癌细胞中高表达的Gli1亦具有抑制作用,提示OM抑制EMT进而抑制胰腺癌侵袭转移的作用可能与OM对hedgehog信号通路中核心转录因子Gli1/2的抑制有关,丰富了OM的抗癌机制,为今后的进一步研究和临床应用提供参考。
