鲤浮肿病毒人工感染锦鲤的试验研究
2019-01-17徐立蒲王小亮王静波江育林
徐立蒲,张 文,王小亮,曹 欢,潘 勇,王静波,王 姝,王 澎,江育林
( 北京市水产技术推广站,北京 100176 )
鲤浮肿病毒(Carpedemavirus,CEV)是一种痘病毒,主要感染鲤鱼(Cyprinuscarpio)和锦鲤(C.carpiokoi),引起鲤浮肿病,或称为锦鲤昏睡病[1-2]。该病能引起鲤鱼和锦鲤出现较高的死亡率,病鱼表现昏睡、烂鳃、凹眼等临床症状。该病最早报道见于1974年的日本,之后陆续有北美和欧洲的报道[3-10]。近年来,我国北京、河北、浙江、云南等地养殖的鲤鱼和锦鲤多次暴发一种急性烂鳃症状的疾病,死亡率高,造成重大经济损失,已确认该病就是鲤浮肿病[11-16]。之后,全国水产技术推广总站相继在河南等地进行了鲤浮肿病的监测和流行病学调查[17]。调查结果表明,鲤鱼(包括锦鲤)感染鲤浮肿病毒和发生鲤浮肿病的现象均较为普遍和严重。鉴于当前该病防控形势严峻,并且目前未见国内外对鲤浮肿病的感染方式,尤其是未见鱼感染鲤浮肿病毒后各组织器官内病毒量动态变化情况等方面的研究报道。基于此,在实验室条件下,笔者比较研究3种不同感染方式下鲤浮肿病毒对锦鲤死亡率的影响,以及鲤浮肿病毒感染锦鲤后在鱼体内主要组织器官中的分布状况和病毒量动态变化情况,以期为鲤浮肿病的检测、诊断及防控提供理论依据。
1 材料与方法
1.1 病毒来源
病毒取自2016年北京市顺义区某水产养殖场的50尾确诊感染鲤浮肿病毒且有典型症状的发病锦鲤。共取鳃和肾约50 g,混合研磨后按1∶5加入含10%血清的M199细胞培养液,-80 ℃冻存备用。使用前,将混合组织液pH调至7.5,4 ℃、4000 r/min离心15 min,取上清液。经TaqMan Real-time PCR检测,鲤浮肿病毒含量约2.9×105个/μL。
1.2 试验鱼
锦鲤购自北京鑫淼水产公司,全长15~20 cm,体质量70~92 g。将鱼分组暂养在水族箱内,控制水温为20~22 ℃。每7 d从各个水族箱内随机取3尾鱼,取试验鱼鳃、肾、肝、脾、脑组织及器官,混合研磨后与含10%胎牛血清的M199细胞培养液按照1∶1比例混匀,冻融1次后用试剂盒抽提核酸,采用nested PCR方法进行鲤浮肿病毒检测[18]。连续2次检测确认,试验鱼未感染鲤浮肿病毒。
1.3 仪器和试剂
PCR仪为美国ABI Veriti型,荧光定量PCR仪为美国AB 7500型;2×Master PCR Mix购自北京百泰克生物技术有限公司,DNA抽提试剂盒为德国QIAGEN公司生产,nested PCR以及TaqMan Real-time PCR所用引物、探针等均购自生工生物工程(上海)股份有限公司。
1.4 人工攻毒试验一
试验共设置8个水族箱,编号为1~8号。每箱蓄水为150 L,放养13尾锦鲤。1号、2号为注射组,处理方式为腹腔注射,每尾鱼注射0.2 mL的感染病鱼的鳃和肾组织上清液(鲤浮肿病毒含量2.9×105个/μL);3号、4号为划伤后浸泡组,处理方式为先用针头划伤锦鲤体表,再在含2.4×108个/L鲤浮肿病毒的水中浸泡1 h后放回水族箱。5号、6号水族箱为浸泡组,将体表无损伤的鱼于含2.4×108个/L鲤浮肿病毒的水中浸泡1 h后放回水族箱。7号、8号水族箱为空白对照组,不感染病毒。浸泡时水温保持在20 ℃。试验持续20 d。期间各试验组不投喂,充气泵不间断充气,保持水中溶解氧为7~8 mg/L,水温为20~22 ℃。每3~4 d换水1次,换水量不超过25%。每日记录死亡情况和临床症状。每尾死亡鱼均制为两份样品,一份为鳃样品,一份为肾、肝、脾、脑的混合样品。此外每日自7号或8号对照箱中抽取1尾鱼制样。
所有样品制备方法均是称取质量0.5 g,充分匀浆后与500 μL M199细胞培养液混合。取样后置-36 ℃冻存,至试验全部结束后,统一用nested PCR对样品进行检测[18]。
1.5 人工攻毒试验二
试验设置8个水族箱,体积为150 L/箱,每箱放20尾锦鲤。按顺序编为1~8号,分为2个试验组,即划伤后浸泡组和对照组。划伤后浸泡组设6个平行箱,编号为1~6号;对照组设2个平行箱,编号为7号和8号。划伤后浸泡组处理方式为将健康锦鲤用针头划伤体表,在鲤浮肿病毒含量约2.4×108个/L的30 L水中浸泡1 h后放回各水族箱。对照组处理方式为将健康锦鲤用针头划伤体表后直接放回水族箱。划伤浸泡时水温保持在20 ℃。
试验共进行12 d。试验期间不投喂,充气泵不间断充气,保持水中溶解氧为7~8 mg/L,水温为20~22 ℃。每日定时自1~6号箱中各箱随机取1尾活鱼(弃死鱼)。每尾鱼逐个器官制样,即每尾鱼均分别取全血、鳃、脑、肾、肝、脾、肠、肌肉组织制样。鳃、脑、肾、肝、脾、肠、肌肉制备方法是称取质量0.5 g组织,充分匀浆后与500 μL M199细胞培养液混合;全血制备方法是抽取尾静脉血500 μL,加500 μL M199细胞培养液混合。取样后置-36 ℃冻存,此外每日自7号、8号对照箱中各抽取1尾鱼制样。试验全部结束后,所有样品统一用TaqMan Real-time PCR方法检测[8]。
1.6 nested PCR检测鲤浮肿病毒
样品取200 μL组织上清液,采用试剂盒抽提核酸,参考文献[18]的nested PCR方法进行鲤浮肿病毒检测。第一次PCR扩增的正向引物F1: 5′-GCTGTTGCAACCATTTGAGA-3′,反向引物R1:5′-TGCAGGTTGCTCCTAATCCT-3′,扩增该病毒编码外膜蛋白的4a基因(P4a)中的548 bp片段;第二次扩增的正向引物F2:5′-GCTGCTGCACTTTTAGGAGG-3′,反向引物R2:5′-TGCAAGTTATTTCGATGCCA-3′,再从中扩增180 bp片段。
1.7 TaqMan Real-time PCR检测和定量鲤浮肿病毒
以本实验室制备、保存的4-1C质粒(鲤浮肿病毒 P4a基因528 bp)标准品DNA个数6.0×1010个/μL,对其进行10倍系列稀释。取6.0×108~6.0×100个/μL的稀释度,每个稀释度3个平行,用于建立Real-time PCR检测的标准曲线。
样品取200 μL组织上清液,采用试剂盒抽提核酸,按英国环境、渔业水产养殖研究中心的TaqMan Real-time PCR方法进行鲤浮肿病毒检测[8]。引物qF1:5′-AGTTTTGTAKATTGTAGCATTCC-3′,qR1:5′-GATTCCTCAAGGAGTTDCAGTAAA-3′,荧光探针probe1:5′-[FAM]+AGAGT TTGTTTCTTGCCATACAAACT+[BHQ]-3′。
组织的病毒载量按下式计算:
病毒载量/个·ng-1={[10(Ct值-38.73)/-3.3606×PCR反应终体积20 μL/PCR体系加入的模板量2.5 μL]×抽提DNA终体积200 μL}/抽提核酸用组织量100 mg/1000
1.8 鳃组织病理观察
试验对象为人工攻毒试验一中的锦鲤。在发病死亡高峰期,取出现昏睡、凹眼、烂鳃等症状的濒死锦鲤和对照组锦鲤,剪取鳃丝,按鳃丝镜检法检测[19]。同时分别取鳃丝室温保存于10%甲醛固定液中,制备病理组织切片[19],显微镜下观察。
2 结果与分析
2.1 不同感染方式对锦鲤感染鲤浮肿病毒的影响
试验共持续20 d。空白对照组的鱼无死亡;而采用注射、划伤后浸泡、浸泡3种方式感染病毒的试验组鱼均出现烂鳃、凹眼、昏睡等典型鲤浮肿病症状(图1),并出现死亡(图2)。不同感染攻毒方式的死亡率依次为划伤后浸泡组(88%)>注射组(85%)>浸泡组(35%)(表1)。划伤后浸泡组和注射组间的死亡率差异不显著(P>0.05),但这两个组均与浸泡组之间存在极显著差异(P<0.01)。
划伤后浸泡组试验鱼在试验第4 d开始出现死亡情况,第5~7 d出现死亡高峰,死亡情况共持续9 d。试验开始的4~5 d内,发病锦鲤仅有不同程度的鳃丝损伤,无其他症状。至第6~7 d,发病锦鲤开始出现凹眼以及昏睡症状;剪取鱼鳃时会出现黑色血液,极快即凝固;发病锦鲤的体表、鳍条有出血症状。第8 d,发病锦鲤出现了全身浮肿症状;剖检脾淤黑肿大,腹水严重。表现症状与报道的鲤浮肿病症状基本一致。
浸泡组试验鱼在第5 d开始出现死亡情况,死亡持续9 d。试验锦鲤的发病过程和症状与划伤后浸泡组基本相同,仅死亡率低于划伤后浸泡组。
注射组试验鱼在试验第2 d开始出现死亡情况,但第2 d和第3 d死亡数量均较少,第4 d后死亡情况与划伤后浸泡组相近,死亡持续14 d。试验锦鲤的发病过程和症状与划伤后浸泡组基本相似。
检测3种感染方式下死亡锦鲤的鳃样品以及肝、肾、脑、脾混合样品,均可扩增出鲤浮肿病毒的548 bp和180 bp特异性条带。而对照组鱼不能扩增出鲤浮肿病毒特异性条带(图3)。

图1 人工感染病鱼症状(烂鳃和凹眼)

图2 3种不同方式感染试验组鱼的累积死亡情况各曲线上标注数字为相应时间的累积死亡鱼尾数.
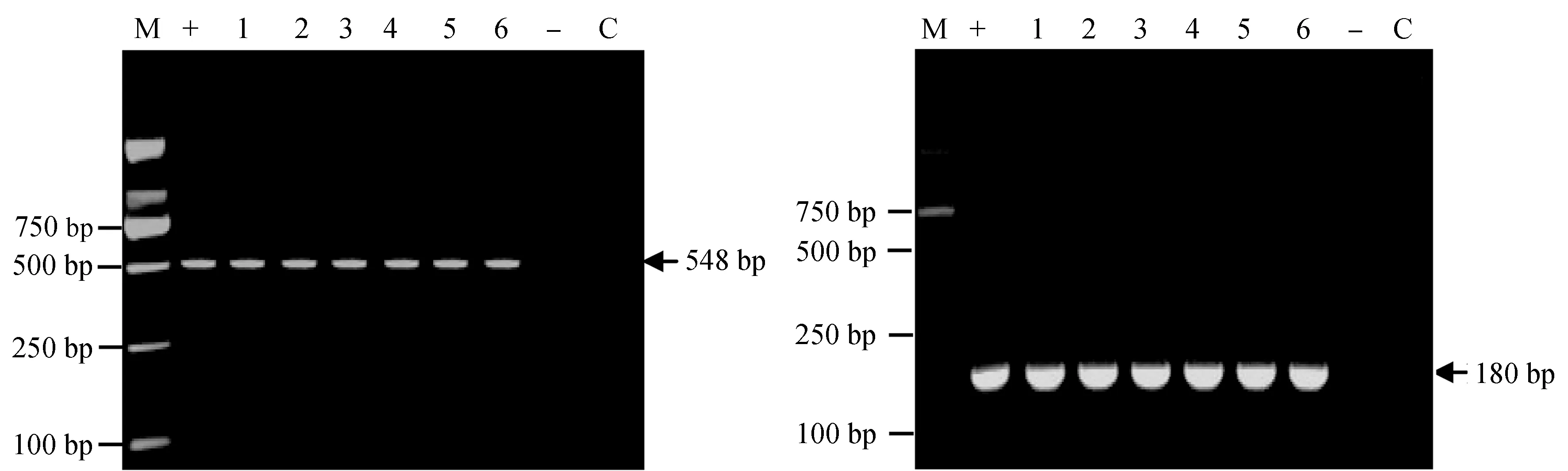
图3 人工感染试验第7 d死亡锦鲤的nested PCR检测鲤浮肿病毒电泳示意a:第一轮PCR扩增结果电泳,b:第二轮PCR扩增结果电泳;+:阳性对照,-:对照组鳃、肝、肾、脑、脾的混合样,C:空白对照;1:注射组的鳃,2:注射组的肝、肾、脑、脾的混合样;3:划伤后浸泡组的鳃,4:划伤后浸泡组的肝、肾、脑、脾的混合样;5:浸泡组的鳃,6:浸泡组的肝、肾、脑、脾的混合样.
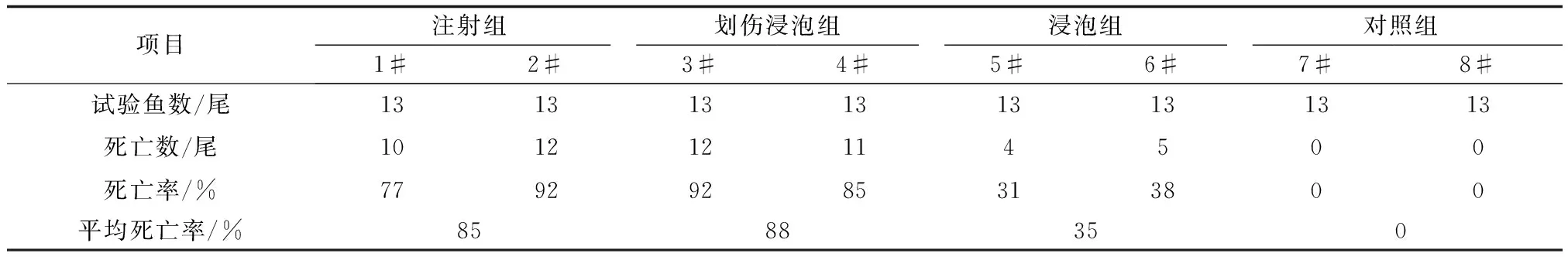
项目注射组划伤浸泡组浸泡组对照组1#2#3#4#5#6#7#8#试验鱼数/尾1313131313131313死亡数/尾101212114500死亡率/%77929285313800平均死亡率/%8588350
2.2 划伤后浸泡感染方式下鲤浮肿病毒在不同组织器官中的检出情况
2.2.1 标准曲线
标准质粒4-1C梯度稀释后,获得Real-time PCR扩增曲线(图4),由左至右依次为6.0×108~6×100个/μL;阴性和空白对照没有扩增。以6.0×108~6.0×100个/μL质粒密度的对数为横坐标,以Real-time PCR反应过程中样品扩增达到阈值水平经历的循环数(3个平行样Ct值的平均数)为纵坐标制作标准曲线(图5),标准曲线的回归系数为0.999。质粒密度与Ct值关系:Ct=-3.3606lg(质粒密度)+38.73。
2.2.2 各组织器官中鲤浮肿病毒的动态分布情况
锦鲤采用划伤后浸泡法人工感染鲤浮肿病毒,第1~3 d,各组织中均未检出鲤浮肿病毒。至第4 d,在鳃组织中首先检测到鲤浮肿病毒,病毒载量为0.4 个/ng,并且随着时间的推移鳃组织中鲤浮肿病毒的含量呈上升趋势,至第7 d达到峰值,病毒载量为314.8个/ng,随后病毒载量逐日降低,至第12 d在鳃组织中检测不到鲤浮肿病毒(表2)。在肾、肝、脑、肌肉和脾组织中也检出了鲤浮肿病毒,但是鲤浮肿病毒在这些组织中的含量及存在时间均显著低于鳃组织,表明鳃是鲤浮肿病毒增殖的最主要靶器官。试验期间在血和肠组织中未检出鲤浮肿病毒。在对照组鱼的各组织中未检出鲤浮肿病毒。
图4 Real-time PCR检测灵敏度试验由左至右质粒梯度依次为6.0×108~6.0×100 个/μL.
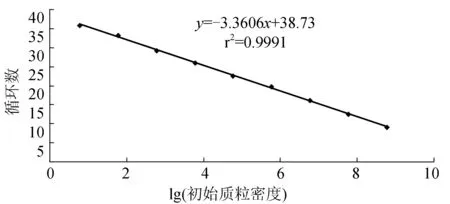
图5 Real-time PCR扩增标准曲线以6.0×100~6.0×108个/μL梯度的标准质粒进行标准曲线扩增.
2.3 病鱼鰓组织病理观察
在划伤后浸泡组感染发病高峰时,取鳃丝制作水浸片观察,可见鳃丝末端细胞增生,呈肿大状并相互黏附,有融合;末端充血严重,膨大成球状(图6)。进一步观察病理组织切片,病鱼鳃上皮组织肿胀,并有很多脱落,鳃血管充血和裸露,有血细胞大量逸出(图7)。
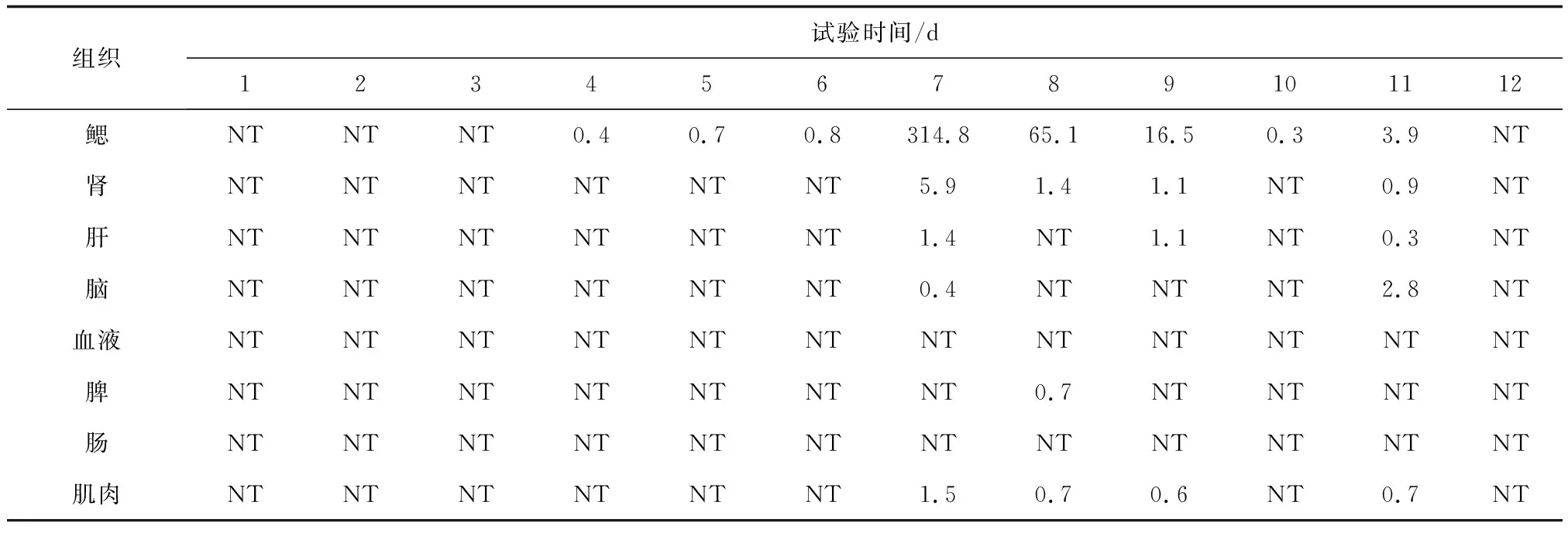
表2 锦鲤人工感染鲤浮肿病毒后不同组织中平均病毒载量 个/ng
注:NT表示未检出.
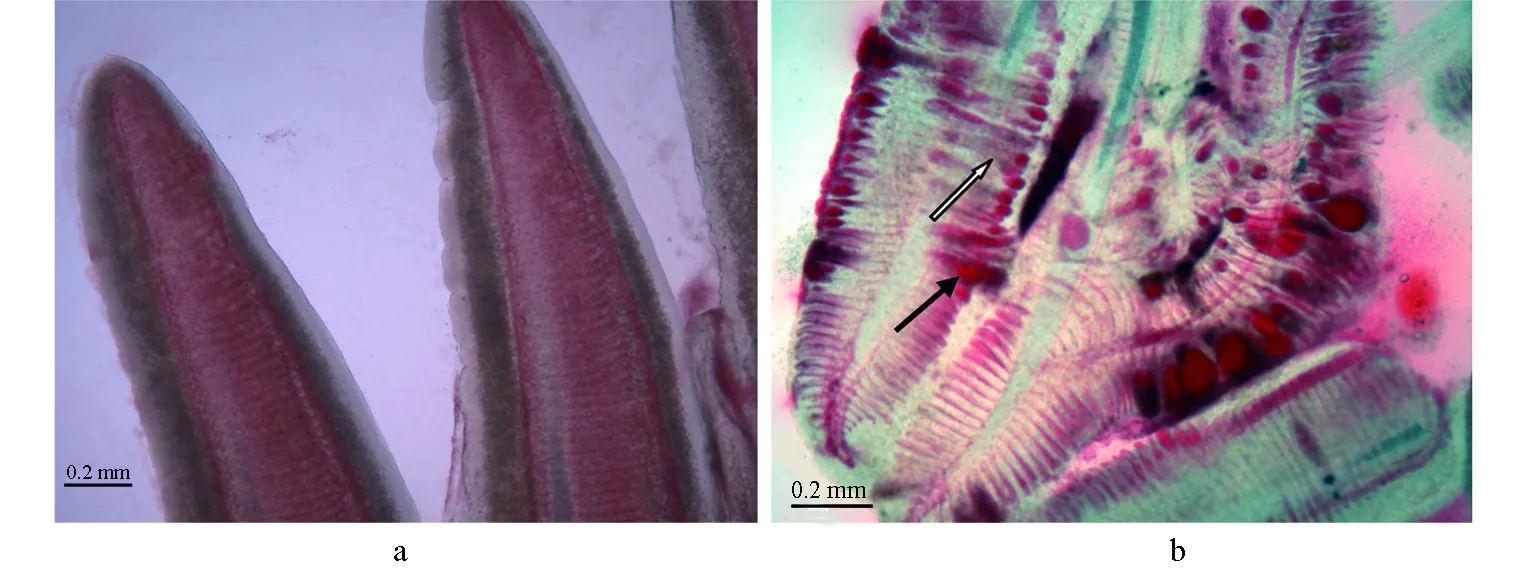
图6 锦鲤鳃丝水浸片a:对照组锦鲤; b:划伤后浸泡组发病锦鲤,鳃丝变粗并相互黏附(空箭头)、末端充血膨大成球状(实箭头).

图7 锦鲤鳃组织切片a.对照组锦鲤; b.划伤后浸泡组发病锦鲤, 箭头示鳃上皮组织脱落.
3 讨 论
3.1 不同方式感染鲤浮肿病毒对锦鲤发病状况和死亡率的影响
在注射、划伤后浸泡、浸泡3种感染方式下,试验鱼均出现了烂鳃、凹眼、昏睡等鲤浮肿病典型症状[3-5],nested PCR检测也确认试验锦鲤的鳃样品以及肝、肾、脑、脾混合样品中存在鲤浮肿病毒,说明可通过人工感染方式感染鲤浮肿病毒。浸泡,特别是划伤后浸泡可导致锦鲤较高的死亡率(88%),这也符合痘病毒在动物间的传播途径——主要通过皮肤的伤口感染,或由污染环境的直接或间接传染[20]。这提示养殖鱼类皮肤损伤或寄生虫叮咬在鲤浮肿病毒感染中起到比较重要的作用。浸泡组死亡率较划伤后浸泡组低很多,推测当锦鲤感染鲤浮肿病毒后,如果体表没有损伤或其他应激刺激,不会导致较高的死亡率。有研究表明,在养殖过程中发生鲤浮肿病后,施用抗菌或杀虫药、换水等应激措施会导致鲤鱼或锦鲤更高的死亡率[13,17],本试验结果也验证了这一点。注射组在试验第2 d即开始出现死鱼情况,但检测结果显示,未见病毒增殖,且第2 d死亡数量较少,第3 d后死亡情况与划伤后浸泡组相似,前3 d试验鱼的死亡可能因注射损伤所致,非病毒感染所致。
据国内外已有报道,鲤浮肿病发病水温范围较广,在7~27 ℃时均可发病[1-7,10-12]。经对我国河南等地区发生的鲤浮肿病的养殖场流行病学调查显示,发病一般有两个高峰,5—6月和9月,这两个时间段养殖水温为20~27 ℃[17]。本试验在20~22 ℃水温下进行,感染死亡率为35%~88%,这与调查的实际生产中鲤浮肿病发病死亡率基本一致。但20~22 ℃水温是否为鲤浮肿病的最适发病温度还有待进一步研究确定。
3.2 鲤浮肿病毒的主要靶器官及在不同组织内的分布和变化情况
温智清等[14]检测发现,云南发病锦鲤鳃和肾中鲤浮肿病毒载量为1~5 个/ng,鳃中病毒载量约为肾的6~7倍。Adamek等[21]在研究鲤浮肿病毒感染鲤鱼的临床症状与鲤鱼鳃、皮肤组织中的病毒载量关系时,发现鳃组织的平均病毒载量(520 个/ng)显著高于皮肤组织。本试验采用划伤后浸泡感染试验进一步研究了各组织器官中鲤浮肿病毒载量动态变化情况,在鳃、肾、肝、脑、脾、肌肉组织中均能检出鲤浮肿病毒,其中鲤浮肿病毒在鳃组织中出现最早(第4 d)、持续存在时间最长(7~8 d)、含量最高(峰值为314.8 个/ng组织)。在显微镜下进一步观察鳃丝水浸片,鳃丝末端细胞增生,并有融合;观察鳃丝组织切片,鳃丝血管中血细胞大量逸出,这些均是鳃有显著组织病理变化的表现。这表明鳃是鲤浮肿病毒感染的最主要靶器官。推测原因为,痘病毒科种类传播的主要方式是通过皮肤的伤口感染[20],鳃丝最易受到寄生虫或水质影响而被破坏,且鳃丝与养殖水中鲤浮肿病毒直接接触。鳃丝末端细胞增生的组织病理变化,会严重影响血液的气体交换,导致鱼缺氧,出现浮头、反应迟缓、甚至死亡。研究结果还显示,除鳃外,鲤浮肿病毒在肾组织内载量较低并能持续存在4~5 d;鲤浮肿病毒在肝、脑、脾、肌肉(含皮肤)组织内载量低且存在时间短。在感染的第12 d,包括鳃在内的各组织已经检测不出鲤浮肿病毒。因此在开展鲤浮肿病监测及检测工作时,建议主要取鳃和肾组织。
不同感染方式对锦鲤感染鲤浮肿病毒影响的试验结果显示,划伤后浸泡组试验鱼第4 d开始出现死亡,第5~7 d出现死亡高峰,死亡共持续9 d。划伤后浸泡组试验鱼各组织器官中鲤浮肿病毒的动态分布情况显示,锦鲤感染鲤浮肿病毒后有3 d的潜伏期,然后病毒大量增殖,在第7~9 d到达高峰,随后病毒量开始逐渐下降。上述两个试验结果显示,锦鲤感染鲤浮肿病毒后的死亡情况和病毒增殖情况基本同步,这也与实际生产中发病死亡过程相似。综上认为,在20~22 ℃,锦鲤感染鲤浮肿病毒有3~5 d的潜伏期,发病时间持续约9 d,随后各组织中病毒含量下降直至消失,这一现象提示鱼能够产生足够的免疫力,这也为用疫苗控制鲤浮肿病提供了可能性。关于鱼感染鲤浮肿病毒后抗体产生和细胞免疫的变化情况,还有待于进一步的深入研究。建议在进行鲤浮肿病毒监测时,最好抽取正在发病的鱼或尚未发病的鱼作为样本;如果取发病停止后存活的鱼为样本,则易得到假阴性检测结果,造成漏检。
