高纯度神经胶质瘤干细胞的分离与鉴定
2019-01-16,
,
神经胶质瘤是一种源于神经胶质细胞的脑部恶性肿瘤,是最常见的颅内肿瘤,尽管目前在神经胶质瘤的诊断、外科手术以及放化疗上取得了很大的进步,但是目前神经胶质瘤在治疗上仍面临着很大的困难,预后较差。就目前而言,神经胶质瘤病人接受广泛外科手术切除和术后辅助放化疗后平均生存期时间在14.6个月左右[1]。然而,最近10年在恶性胶质瘤细胞生物学的研究上大大提高了对恶性胶质瘤发生机制的认识,特别是神经胶质瘤干细胞,它是一个罕见的具有肿瘤干细胞特点的族群,这可能对研究恶性胶质瘤治疗后复发有帮助,和干细胞相似,神经胶质瘤干细胞具有自我更新复制能力,耐放疗及耐化疗,而且在大脑里面有侵袭转移能力以及很高的增殖潜能。少量神经胶质瘤干细胞经过治疗后幸存下来并快速增殖,重新形成胶质瘤[2]。因此,最新的抗胶质瘤治疗研究进展中旨在消除胶质瘤干细胞,防止恶性胶质瘤的复发。神经胶质瘤干细胞可能在肿瘤发生和肿瘤的复发中发挥着重要作用,找到能彻底杀灭神经胶质瘤干细胞的方法,消除这种神经胶质瘤干细胞种群,可能给临床治疗神经胶质瘤带来新的希望。因此,对神经胶质瘤干细胞的功能分析和发病机制进行详细的了解至关重要。这些发现为神经胶质瘤干细胞的生物学特性和对脑部肿瘤靶向治疗提供了一个开放的新视角。本实验经过分离提取并鉴定神经胶质瘤干细胞,对后期神经胶质瘤的发生机制、治疗及取得良好的治疗效果进行前期研究具有重要意义。
1 材料与方法
1.1 标本 十堰市太和医院神经外科术中的神经胶质瘤,术后病理诊断为间变型星形胶质细胞瘤,WHOⅢ级,IHC:GFAP(+),S-100(+),NeuN(-),Ki-67(20%)。
1.2 实验方法 病人术前未行放化疗和手术。取5个位点的脑肿瘤组织各1块,直径(5~10) mm,浸入无菌2 mL 无血清DMEM/F12培养液瓶中保鲜,外加无菌敷料严密包被,立即于30 min内送实验室进行分离培养。吸出标本瓶中上层液体,加入0.05%的胰蛋白酶2 mL于标本瓶中,吸引管反复吹打混匀消化后,移入培养皿中,剪刀反复剪碎,剪成更小组织碎片,玻片反复研磨,10%FBS终止消化;吸引管反复吹打,重悬,混匀后200筛网过滤,然后将过滤后的液体于离心机上以1 000 r/min离心5 min,去上清。再用PBS液反复洗涤3次,离心后去上清。制成单细胞悬液,最后将细胞浓度调整为(0.5~1.0)×108个/mL,于多聚赖氨酸预处理过的六孔板上分别种植单细胞悬液,将细胞种植在每一孔中,加入含有神经生长因子(20 ng/mL,bFGF、20 ng/m,EGF;2%B27)和双抗无血清DMEM/F12培养液18 mL,放入含有5%的二氧化碳(CO2)、37 ℃常规培养箱中培养,据细胞的生长形态和速度以及培养基pH的高低来观察,进行换液(3 d~4 d 1次)。然后进行定期传代培养。取传代培养第3代生长良好的胶质瘤干细胞进行Nestin、CD133的免疫荧光化学检测,然后利用倒置荧光显微镜观察拍照。在胶质瘤干细胞的对数生长期,选取生长良好的细胞,制成胶质瘤干细胞悬液,然后将细胞悬液种植在预冷的无菌玻片上,依此制作6张玻片,室温下静置晾干。于75 ℃环境下烘烤玻片1 h,然后进行G带染色。显微拍照摄影,于放大后进行胶质瘤干细胞的染色体核型分析。利用CD133细胞磁珠分离技术使CD133正负细胞被洗涤分离。 取免疫磁珠分选系统分离的CD133+细胞,调整细胞计数为1×106个,加入40 μL 0.01 mol/L的PBS液和CD133抗体,混合均匀后放入4 ℃环境中静置10 min,加入300 μL 0.01 mol/L的PBS液,分9次送流式细胞仪检测CD133+细胞的表达。

2 结 果
2.1 培养出神经胶质瘤干细胞 细胞培养第3天开始出现细胞球(见图1),5 d~7 d之后逐渐形成大量细胞球,每个球包含(4~8)个细胞,细胞球呈现球形或椭圆形的外表,内部细胞排列整齐严密,并且折光性好。2周内,大多数区域的细胞球增加到它们直径的(5~10)倍。部分细胞球出现突起,呈放射状生长,形态多不规则,可见有星形、多角形、树枝状。3 d换液1次,然后视细胞球生长情况进行传代,(7~9)天/次(见图2)。每次传代前,于显微镜下培养皿中可见悬浮的结构在培养液中摇摆,此即神经胶质瘤干细胞,一般于每次传代后(1~2)d就可看到神经胶质瘤干细胞的形成,随着培养时间慢慢地延长,形态与原代大致相同。

图1 神经胶质瘤细胞原代培养第3天

图2 显微照相传代后形成的神经球(100×)
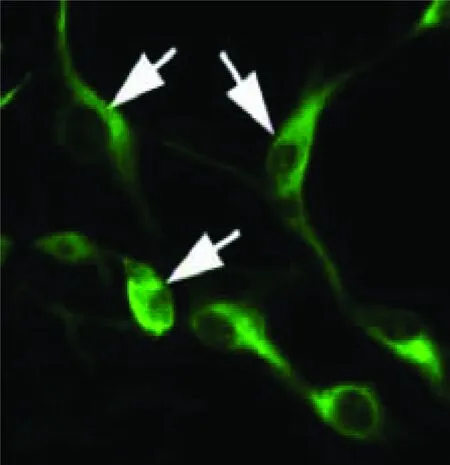
2.2 神经胶质瘤干细胞团的免疫荧光染色 悬浮的细胞免疫荧光染色检测结果显示Nestin、CD133染色阳性(见图3和图4),而培养皿底部贴壁的细胞Nestin、CD133染色均呈现阴性。

CD133染色为阳性,呈红色,用DAPI紫色复染
图3神经胶质瘤干细胞团的免疫荧光染色显示(100×)
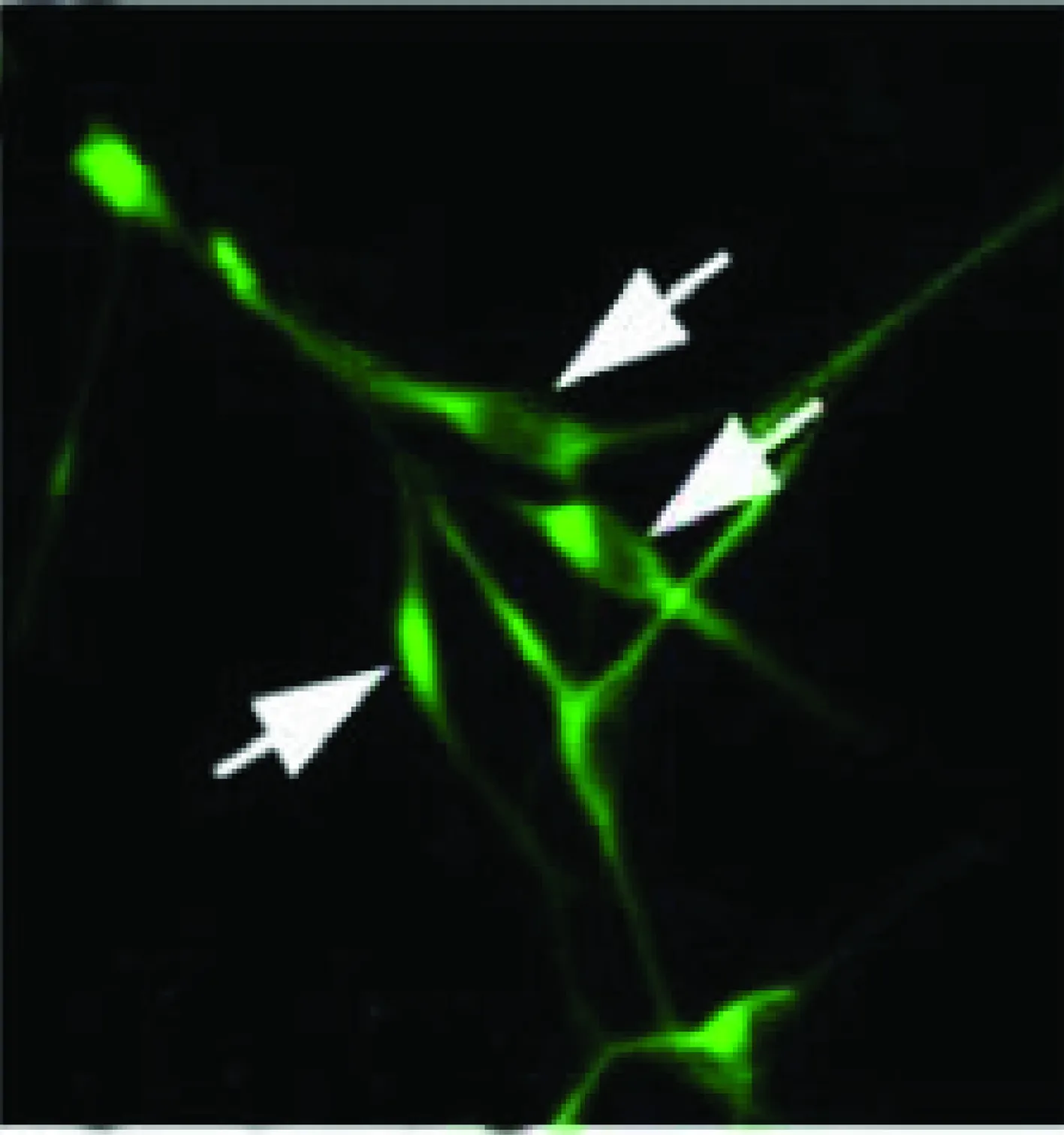
Nestin染色为阳性图4 神经胶质瘤干细胞团的免疫荧光染色(200×)
2.3 神经胶质瘤干细胞的染色体核型分析 神经胶质瘤干细胞和正常的神经干细胞在干细胞功能和生物学特征上有许多相似之处,为了对培养的细胞球进行区分,对所培养的胶质瘤干细胞球进行了染色体核型分析检测,进一步证实该细胞球的性质,结果显示胶质瘤干细胞球的细胞核染色体均为非整倍体,即异倍体,且其中有部分染色体呈现断裂现象,染色体上存在部分基因片段的缺失(见图5)。染色体核型分析结果为:45XY,-10,del(5)(p15),del(16)(p;q)。

图5 神经胶质瘤干细胞球的染色体核型检查G显带
2.4 流式细胞仪检测CD133+神经胶质瘤干细胞(见表1) 经免疫磁珠分选系统分离后,通过流式细胞仪得到CD133+细胞在总分离后细胞数的比例为(86.83±5.12)%,获得了高纯度的CD133+神经胶质瘤干细胞(见图6)。
3 讨 论
在神经胶质瘤的治疗中,新的治疗方法显得非常重要,神经胶质瘤干细胞是目前研究的热点,可能为治疗胶质瘤提供新的途径[3]。神经胶质瘤干细胞是一种在神经胶质瘤中罕见的具有肿瘤干细胞特点的族群,和干细胞很相似,胶质瘤干细胞具有自我更新复制、耐放疗及耐化疗能力,在大脑内有生长迅速、转移能力强等特点。神经胶质瘤干细胞是Ignatova等在使用一个神经细胞球进行实验时第一个分离出来的[4-6]。原发神经胶质瘤细胞(分离成单个细胞)在无血清培养基和神经干细胞生长因子bFGF、EGF和B27中进行原代培养,显示0.3%~25.1%的胶质瘤细胞肿瘤级别愈高越能够继续增殖,并随着时间的推移在培养皿中生长。这些神经球形成的细胞,即神经胶质瘤干细胞,它表达的标记物主要有巢蛋白Nestin和CD133。本研究中用巢蛋白Nestin和CD133抗体进行免疫荧光染色,对神经胶质瘤干细胞进行了鉴定。

表1 CD133+细胞的纯度 %
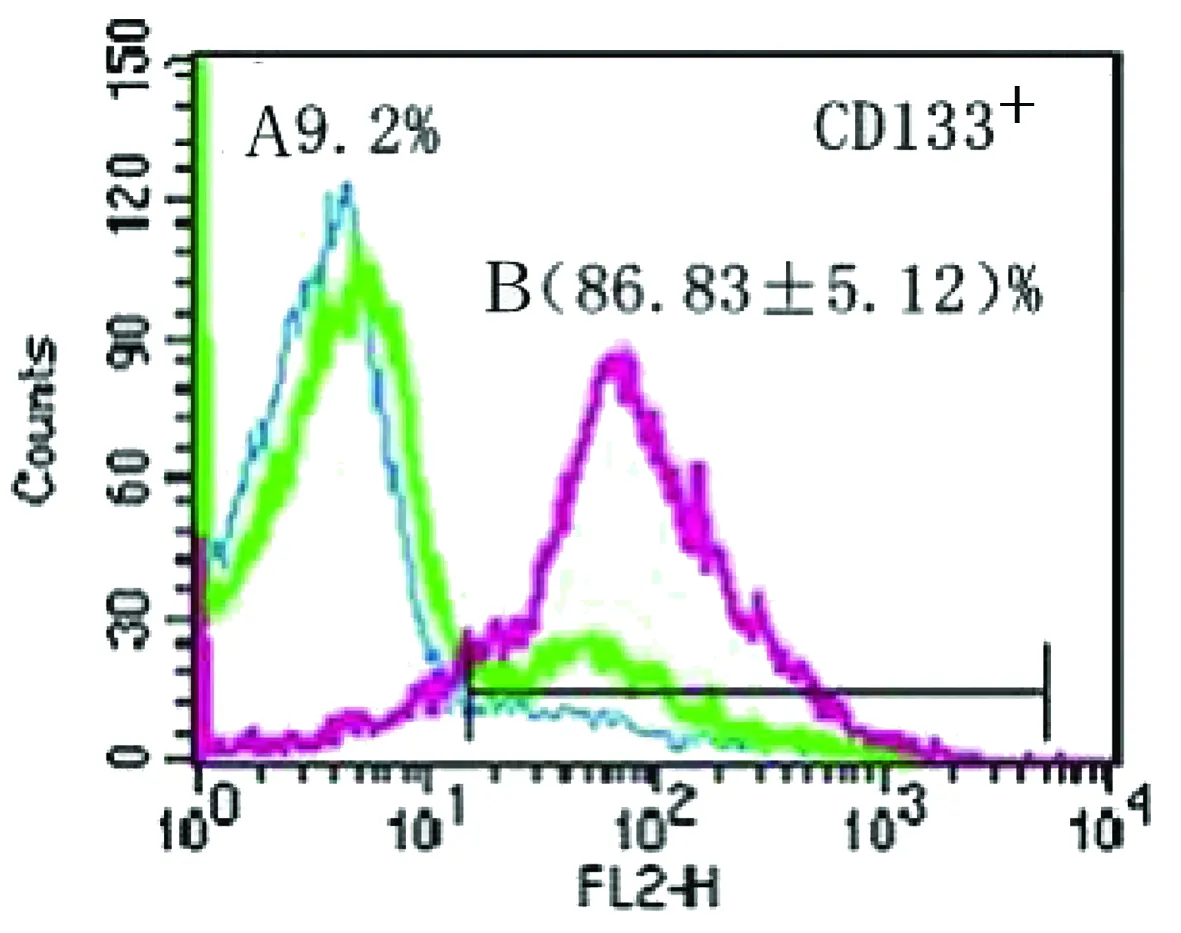
A曲线是分选之前CD133+的百分比,B曲线是分选之后CD133+的百分比
图6原代胶质瘤细胞培养的细胞总群中CD133+百分比
巢蛋白是一种新发现的第Ⅵ类中间丝蛋白,表达丰富,能够特异性地表达在神经上皮干细胞上的一种细胞标记物,也被广泛用作神经胶质瘤干细胞的标记物检测。在正常的细胞变成肿瘤细胞的过程中,巢蛋白的表达受其内在的细胞基因调控元件和激素受体-配基复合物以及转录因子等因素调控,可能对神经元的分化有作用。巢蛋白已经在原发的中枢神经肿瘤中检测到,而转移癌中则没有[7]。本研究对悬浮的细胞球进行了免疫荧光染色检测,结果显示Nestin染色阳性,说明所培养的细胞表达了Nestin,因此证明培养中的悬浮细胞具有干细胞源性。
CD133是干细胞表面抗原的一种,是一种糖蛋白,最早在造血干细胞中找到这种抗原,随后发现在许多实体肿瘤中如结肠癌、胰腺癌、肺癌、骨肉瘤以及脑肿瘤中均有发现[8]。许多研究表明,CD133可被用作神经干细胞和神经胶质瘤干细胞的共有细胞标记物,是目前在人类胶质瘤干细胞研究最多和经常使用的标记,被认为是神经胶质瘤干细胞最重要的标记物。CD133细胞分为CD133+和CD133-细胞两种,CD133+细胞在肿瘤中的比例与肿瘤的恶性程度呈正相关。CD133+神经胶质瘤干细胞具有很强的自我更新复制能力、致瘤能力、分化能力、耐药以及耐放化疗能力,而CD133-神经胶质瘤干细胞则没有这方面的能力[9],因此对研究神经胶质瘤干细胞具有很好的指导作用和研究前景。本实验在做流式细胞仪检测目标细胞时基本大部分为CD133+细胞,而CD133-细胞则很少或没有,由此说明CD133+细胞具有很强的生长能力,CD133+细胞的数量可能与肿瘤的恶性程度呈正相关的,其比例越高,预后则越差。
神经胶质瘤干细胞与正常的神经干细胞之间有许多相似之处。神经胶质瘤干细胞表达了标记物CD133,巢蛋白Nestin,Sox2MELK等等,所有这些在成人神经干细胞中也表达了。此外CD133+神经胶质瘤干细胞在培养中能够增殖形成神经球,与在相同培养条件下正常神经干细胞一样,而贴壁在培养皿的CD133-神经胶质瘤干细胞没有增殖形成神经球体[10]。神经胶质瘤干细胞和正常干细胞的一个共同特征是都具有自我复制更新功能。另一个的共同点是具有多分化潜能性。神经胶质瘤干细胞究其来源,多数学者们认为其源于发生基因突变的神经干细胞[11]。由于神经胶质瘤干细胞和神经干细胞同样都表达了细胞标记物CD133,巢蛋白Nestin。本实验对培养液中悬浮生长的细胞球进行了免疫细胞化学荧光染色,检测结果显示Nestin、CD133染色阳性,说明细胞球表达了细胞标记物Nestin、CD133,所以还不能完全肯定该细胞就是神经胶质瘤干细胞,有可能是神经干细胞,只是初步认为该细胞为神经胶质瘤干细胞,本研究对该细胞进行染色体核型检查及分析最终鉴定该细胞为人脑神经胶质瘤干细胞。
免疫磁珠分选法是目前最新的针对CD133+细胞的分选方法,利用磁力学的原理将目标细胞(CD133+细胞)进行分离出来,而且所选用的磁珠也是目前被广为接受的复合磁珠,即磁珠标记结合的CD133抗体,在传统的实验中需要将磁珠与CD133抗体进行结合,这种复合磁珠既加快了实验的进程,又提高了实验的准确性。通过免疫磁珠分选法成功分离得到高纯度的CD133+神经胶质瘤干细胞,在实验上具有很强的可行性,受外部条件影响较小,分离得到的纯度也很高,相比较其他如条件培养等分离方法更易获得目标细胞。但是目前在购买实验试剂和高新仪器上,如荧光染色剂结合的特异性抗体、免疫磁珠分选系统以及分离所选用的磁珠标记结合的CD133抗体价格较贵,实验研究的投入相对较大。
本实验从免疫荧光染色和染色体核型检查及分析上对神经胶质瘤干细胞进行了鉴定,后期将从基因水平的检测来对神经胶质瘤干细胞进行深入研究。神经胶质瘤干细胞的研究还有许多需要解决的问题,如神经胶质瘤干细胞的起源问题、特异性标志,对神经胶质瘤干细胞运用到临床上治疗神经胶质瘤等等。针对神经胶质瘤干细胞的研究,大部分还处在实验研究阶段的早期,更深入地研究神经胶质瘤的生物学特性非常必要,研究神经胶质瘤干细胞将为神经胶质瘤的治疗提供新的途径。
