阴地蕨、银粉背蕨总黄酮和总酚含量及其抗氧化能力分析
2019-01-14李懿宸张思嫔秦语真邬琦雯王嘉瑜戴锡玲
吴 帅, 李懿宸, 张思嫔, 秦语真, 邬琦雯, 王嘉瑜, 戴锡玲
(上海师范大学 生命科学学院,植物种质资源开发协同创新中心,上海 200234)
0 引 言
蕨类植物是维管束植物中较古老原始的类群[1],因其分布广泛,资源丰富,且具有多种活性物质,一直以来都是中草药资源,其主要含有生物碱、酚类、甾类、三萜类和黄酮类等物质[2].其中,黄酮类按其化学结构可分为原花青素类、槲皮素类、柑桔生物黄酮类和绿茶多酚类,它们能抑制糖酵解过程,降低线粒体琥珀酸氧化酶活性,从而减缓肿瘤细胞的生长,起到抗癌、防癌的作用[3-4],且抗癌作用通常随黄酮抗氧化作用的提高而略增强.酚类化合物含有酚羟基或者苯烯结构,也具有广泛的生理活性,如清除自由基、抗氧化、抗紫外光辐射、抑制细菌生长、抗病毒等,在日常生活、科学研究、医疗药品等方面都有着广泛用途[5].
阴地蕨[Botrychiumternatum(Thunb) Sw.]为阴地蕨科(Botrychiaceae)阴地蕨属(Botrychium)多年生草本[6],含有阴地蕨素、槲皮素、木犀草素、3-O-α-L-鼠李糖-7-O-β-D-葡萄糖甙等多种成分.齐建红[7]研究表明,阴地蕨具有清热解毒、消炎、祛风定惊、抑制自发性肿瘤转移和实验性肿瘤转移、抑制多种病原菌的生物活性等作用,常用于治疗痔疮、支气管炎、毒蛇咬伤、风湿麻痹、跌打损伤、痄腮、乳痈、痢疾等疾病.
银粉背蕨[Aleuritopterisargentea(Gmel.) Fee]为中国蕨科(Sinopteridaceae)粉背蕨属 (Aleuritopteris)植物[6],含有山奈酚、β-谷甾醇、鼠李柠檬素、鼠尾草素、3,5,4′-三羟基-7,8-二甲氧基黄酮等多种化合物,具有镇痛、利尿、止血、抑制金黄色葡萄球菌及大肠埃希菌等作用,用于治疗疮伤、骨折、脉筋损伤、活血调经、补虚止咳等疾病[8].
本研究测定了阴地蕨、银粉背蕨总黄酮和总酚含量及其对1,1-二苯基-2-三硝基苯肼(DPPH)自由基,2,2′-联氮基双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS)自由基的清除力和对Fe的还原力,分析了其抗氧化活性,为进一步开发利用阴地蕨和银粉背蕨的药用价值积累资料.
1 材料与方法
1.1 材 料
本实验中的阴地蕨于2016年12月采自湖北随州,银粉背蕨于2016年10月采自河南郑州市登峰县,选取生长良好的孢子体全株.实验材料由上海师范大学生命科学学院曹建国教授鉴定,凭证标本保存在上海师范大学蕨类植物标本室.
1.2 方 法
1.2.1 提 取
将阴地蕨和银粉背蕨全株洗净,分离地上部分与地下部分,放在阴凉通风处晾干,随后用粉碎机分别将其打至粉末状,于4 ℃的冰箱中保存备用.阴地蕨的地上和地下部分为样品1和样品2,银粉背蕨的地上和地下部分为样品3和样品4.打开水浴锅加热至60 ℃,精确称取样品粉末2.0 g,置于锥形瓶中,分别加入25 mL体积分数为75%的乙醇溶液,60 ℃水浴2 h,超声25 min,真空泵抽滤,收集滤液于预先称重的圆底烧瓶中,再向滤渣中加入25 mL体积分数为75%乙醇溶液,60 ℃水浴2 h,超声25 min,真空泵抽滤,收集合并两次滤液于对应圆底烧瓶中[9].滤液水浴旋干,再次称重圆底烧瓶,获得提取物干重,计算提取率.
1.2.2 总黄酮含量的测定
1.2.2.1 芦丁标准曲线的制作[10]
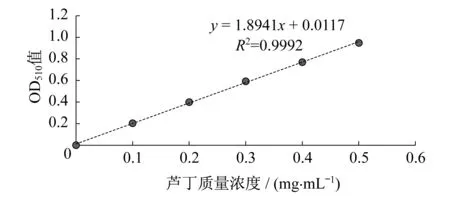
图1 芦丁标准曲线
芦丁标准液:配制质量浓度为0.2 mg·mL-1的芦丁标准液,准确称取芦丁10 mg加入体积分数为95%的乙醇中,定容至50 mL,摇匀.标准曲线的制作:取6支5 mL试管并编号,分别准确加入0,0.5,1.0,1.5,2.0,2.5 mL芦丁标准液和2.5,2.0,1.5,1.0,0.5,0 mL纯净水,再向每个试管中各加入0.15 mL质量分数为5%的NaNO2溶液,将试管摇匀,静置6 min;向每个试管中加入 0.15 mL 质量分数为5% 的Al(NO3)3溶液,摇匀后静置6 min;再向每个试管中加入2.2 mL 质量分数为4%的NaOH溶液,迅速摇匀,静置12 min后,测定在510 nm波长下的吸光度(OD)值.利用Origin 软件制作芦丁浓度与吸光度之间关系的标准曲线.对吸光度与芦丁标准品做回归处理,得回归方程,如图1所示.图1中R2为线性系数,可知两者相关性良好.
1.2.2.2 总黄酮含量的测定[11]
将提取的干样品加入甲醇溶液配制成质量浓度为1 mg·mL-1的待测样品.
取1 mL样品,加入1.5 mL水、0.15 mL质量分数为5%的 NaNO2溶液,摇匀,静置6 min;加入0.15 mL质量分数为5%的Al(NO3)3溶液,摇匀,静置6 min;加入2.2 mL质量分数为4%的NaOH溶液,摇匀,静置12 min.以芦丁空白液制作的标准曲线为空白对照,在510 nm波长下测定其OD值.植物中的总黄酮质量分数
(1)
其中,X为根据回归方程算出的测试样品质量分数,m为提取物质量,M为所用植物样品质量.
1.2.3 总酚含量的测定
1.2.3.1 没食子酸标准曲线的制作[12]

图2 没食子酸标准曲线
取12支4mL试管编号01~51和0~5,试管01~51中分别加入没食子酸0,0.2,0.6,1.0,1.4,1.8 mL,然后再分别加入甲醇溶液2.0,1.8,1.4,1.0,0.6,0.2 mL混匀,每管取60 μL加入到对应新的试管0~5中,再加入1.54 mL水,后再加入福林试剂与水的体积比为1∶2的溶液100 μL,振荡3 min,加300 μL 质量分数为20%的Na2CO3溶液,随后在30 ℃下黑暗处理1 h,以0号试管为空白对照,测定在750 nm波长处的OD值.对OD值与没食子酸标准品质量分数作回归处理,得回归方程,如图2所示.图2中R2为线性系数,可知两者相关性良好.
1.2.3.2 总酚含量的测定
将提取的干样品加入甲醇溶液配制成质量浓度为1 mg·mL-1的待测样品.
分别取60 μL的样品加入编号6~9的4 mL试管中,加入1.54 mL水,后面加入福林试剂与水的体积比为1∶2的溶液100 μL,振荡3 min,加入300 μL质量分数为20%的Na2CO3溶液,随后在30 ℃下黑暗处理1 h,以0号试管为空白对照,测定它们在750 nm处的OD值.植物中的总酚酸质量分数CP的计算方法同式(1).
1.2.4 DPPH自由基清除能力的测定
1.2.4.1 抗坏血酸(Vc)标准曲线的制作
取6支2 mL试管编号为0~5,分别加入0,10,20,30,40,50 μL质量浓度为0.1 mg·mL-1的Vc,再分别加入500,490,480,470,460,450 μL纯水,最后各加入500 μL 的DPPH溶液,摇匀,静置30 min.以0号试管为空白对照,测定517 nm波长下的OD值.
1.2.4.2 样品测定
将提取的干样品分别加入无水乙醇溶液配制成质量浓度为1 mg·mL-1的待测样品.
1)样品1、2:取7支2 mL的试管编号为0~6,分别加入0,50,100,150,200,250,300 μL样品溶液,再加入500,450,400,350,300,250,200 μL无水乙醇溶液,再各加入DPPH溶液500 μL,摇匀,静置30 min.以0号试管为空白对照,测定517 nm波长下的OD值.
2)样品3、4:取6支2 mL的试管编号为0~5,分别加入0,10,20,30,40,50 μL样品溶液,再加入500,490,480,470,460,450 μL水,再各加入DPPH溶液500 μL,摇匀,静置30 min.以0号试管为空白对照,测定517 nm波长下的OD值.DPPH自由基活性清除率
(2)
其中,A0为无样品溶液的OD值,A1为有样品溶液的OD值.
作图并求出样品对DPPH自由基的半清除能力IC50值,即DPPH自由基清除率为50%时的总黄酮及总酚含量,进行比较.
1.2.5 ABTS自由基清除能力的测定
1.2.5.1 ABTS溶液的制备
ABTS储备液的制备:将78 mg ABTS粉末和13.2 mg过硫酸钾溶于20 mL超纯水中,搅拌溶解,4 ℃下贮存,待16 h溶液稳定后使用.
ABTS工作液:取2 mL ABTS储备液加入150 mL无水乙醇,使其在734 nm波长下的OD值为0.700±0.010.
1.2.5.2 样品测定
将提取的干样品分别加入无水乙醇溶液配制成质量浓度为1 mg·mL-1的待测样品.
1)样品1、2:取9支5 mL试管编号为0~8,分别加入0,20,60,100,140,180,220,300,400 μL样品,用无水乙醇定容至1 mL,再加入3 mL ABTS工作液静置6 min,测定734 nm波长下的OD值.
2)样品3、4:取7支5 mL试管编号为0~6,分别加入0,30,60,90,120,150,180 μL样品,用无水乙醇定容至1 mL,再加入3 mL ABTS工作液静置6 min,测定734 nm波长下的OD值.
3)Vc作为阳性对照:取6支5 mL试管编号为0~5,分别加入0,10,20,40,60,80 μL样品,用水定容至1 mL,再加入3 mL ABTS工作液静置6 min,测定734 nm波长下的OD值.
ABTS自由基清除率CABTS计算方法同式(2).作图并求出IC50值,进行比较.
1.2.6 Fe还原力的测定
将提取的干样品分别加入无水乙醇溶液配制成质量浓度为1 mg·mL-1的待测样品.
分别取5支5 mL试管编号为1~5,加入100,300,500,700,900 μL样品,加入900,700,500,300,100 μL水,加入pH值为6的磷酸缓冲液各2.5 mL,加入2.5 mL 质量分数为1%的K3[Fe(CN)6]溶液,在50 ℃下水浴20 min,加2.5 mL三氯乙酸(TCA),以3000 r·min-1的转速离心10 min.
Fe还原力
(3)
其中,A1为2.5 mL上清液加2.5 mL水加0.5 mL FeCl3的混合液在700 nm波长处测定的OD值,A2为2.5 mL上清液加3 mL水的混合液在700 nm波长处测定的OD值.
作图并求出样品对Fe的还原力为15%时总黄酮及总酚含量,进行比较.
1.3 数据采集及分析
本实验采用DHG-9140A Infinite M200 PRO酶标仪(TECAN公司)测定溶液的OD值,实验数据使用Origin软件制作出标准曲线,利用Excel软件作图.每个实验均重复3次,数据取平均值,以减少误差.
2 结果与分析
2.1 阴地蕨和银粉背蕨乙醇提取物的提取率
材料的乙醇提取率可以用来分析蕨类植物中物质的积累量,还可以分析提取物的量与其生物活性是否存在相关关系[12].本研究中乙醇提取率是指样品体积分数为75%的乙醇中得到的提取物与材料粉末的比值.阴地蕨和银粉背蕨不同部位乙醇提取物的提取率存在差异,地上部分提取物的含量均明显高于其地下部分,如表1所示.

表1 样品乙醇提取率 %
2.2 两种蕨类植物总黄酮含量分析
两种蕨类植物中都含有黄酮化合物.银粉背蕨地上部分总黄酮质量分数为41.3 mg·g-1,其地下部分总黄酮质量分数为6.3 mg·g-1;阴地蕨地上部分总黄酮质量分数为9.7 mg·g-1,其地下部分总黄酮质量分数为4.2 mg·g-1(图3).从图3中可以看出:同种植物地上部分的总黄酮含量明显大于地下部分的;两种间总黄酮含量存在一定差异;总黄酮含量由高到低依次为银粉背蕨(地上)、阴地蕨(地上)、银粉背蕨(地下)、阴地蕨(地下),银粉背蕨(地上)的总黄酮含量(最高)大约是阴地蕨(地下)的(最低)10倍.
2.3 两种蕨类植物总酚含量分析

图3 提取物中总黄酮与总酚的含量比较
两种蕨类植物都含有酚酸物质(图3).银粉背蕨地上部分总酚质量分数为16.4 mg·g-1,银粉背蕨地下部分总酚质量分数为3.9 mg·g-1;阴地蕨地上部分总酚质量分数为7.1 mg·g-1,阴地蕨地下部分总酚质量分数为5.4 mg·g-1.两种蕨类植物的总酚含量间存在一定差异,由高到低依次为:银粉背蕨(地上)、阴地蕨(地上)、阴地蕨(地下)、银粉背蕨(地下),同种植物的地上部分的总酚含量大于地下部分的.
2.4 两种蕨类植物DPPH自由基清除率分析

图4 提取物DPPH自由基清除率与总黄酮质量浓度的关系
DPPH是一种很稳定的以氮为中心的自由基,实验中样品将DPPH自由基清除,表明样品的总黄酮及总酚质量浓度达到能降低羟基自由基、烷基自由基、过氧化自由基的有效浓度,或者能打断脂质过氧化链的有效浓度[13].银粉背蕨和阴地蕨都具有一定的DPPH清除能力,如图4所示.由图4可知,DPPH自由基清除率能力最强的是银粉背蕨地上部分,最小的是阴地蕨地下部分.利用软件OriginPro计算不同样品的IC50值,由于阴地蕨地下部分对DPPH自由基清除效果太差,未能算出其IC50值[14].

图5 各提取物对DPPH自由基清除能力的IC50值
由图4还可知,银粉背蕨地下部分在较低的总黄酮浓度下即可达到较高的DPPH自由基清除率,当总黄酮质量浓度为50 μg·mL-1时,其清除率已经超过70%,而在小于40 μg·mL-1时清除率随样品总黄酮含量的增加呈线性增长;银粉背蕨地上部分的DPPH自由基清除率也较高,与地下部分的差异不明显,因此在应用时不必特意区分地上与地下部分.阴地蕨中总黄酮浓度增加与DPPH自由基活性清除率增大呈线性趋势,但其清除率较低,地上部分与地下部分差异明显.地下部分的DPPH清除效果差,当总黄酮质量浓度为300 μg·mL-1时DPPH自由基清除率只有20%,在应用时应区分其地上部分与其地下部分,以达到更高的使用效率.图5为各提取物对DPPH自由基清除能力的IC50值.由图5可知,银粉背蕨对DPPH自由基清除率明显高于阴地蕨的.比较图4、5可知:DPPH自由基的清除能力由高到低依次为银粉背蕨(地上)、银粉背蕨(地下)、阴地蕨(地上)、阴地蕨(地下);在一定范围内,阴地蕨和银粉背蕨的DPPH自由基清除率随总黄酮和总酚浓度的增加而逐渐增加.
2.5 两种蕨类植物ABTS自由基清除率
在ABTS自由基清除体系中,ABTS+离子基团被氧化后生成相对稳定的ABTS水溶性自由基,溶液呈蓝绿色,抗氧化剂与ABTS+离子基团反应后使溶液颜色变浅,特征峰值降低,因此溶液褪色越明显则表明所检测物质的总抗氧化能力越强[15].图6为各提取物ABTS自由基清除率随总黄酮及总酚质量浓度的变化.由图6可知,阴地蕨和银粉背蕨都有一定的ABTS自由基清除能力,且地下部分较地上部分清除效果更好,但差异不明显.因此,在应用时不用特意区分地上部分与地下部分.图7为各提取物对ABTS自由基清除能力的IC50值.由图6和IC50值(图7)的数据可以看出,银粉背蕨地下部分ABTS自由基清除力最大,阴地蕨地上部分ABTS自由基清除力相对最小,银粉背蕨对ABTS自由基清除力明显高于阴地蕨.清除DPPH自由基的能力由高到低依次为:银粉背蕨(地下)、银粉背蕨(地上)、阴地蕨(地下)、阴地蕨(地上),且随总黄酮和总酚浓度的增加而增加.

图6 各提取物ABTS自由基清除率随总黄酮及总酚质量浓度的变化

图7 各提取物对ABTS自由基清除能力的IC50值
2.6 两种蕨类植物Fe还原力的测定
在Fe还原力测定过程中,样品中的还原物质将赤血盐[K3Fe(CN)6]还原成黄血盐[K4Fe(CN)6],黄血盐再与 Fe3+作用,生成普鲁士蓝,从而使样品溶液变色,在 700 nm波长处测定OD值,可以检测普鲁士蓝的生成量以评价试样的还原力[16].图8为各提取物铁还原力随总黄酮及总酚质量浓度的变化关系.由图8可知,测定的阴地蕨和银粉背蕨都存在一定的Fe还原力,其种间差异十分明显,银粉背蕨的效果远强于阴地蕨.银粉背蕨地上部分与地下部分效果良好,与样品含量呈明显正相关的线性关系.但银粉背蕨地上效果明显优于地下部分,在应用时可考虑区分对待.而阴地蕨的抗氧化活性较差,虽然随样品含量增加,清除率有一定的增长,但增长幅度较小,地上部分与地下部分差异不明显.由图9可知,Fe还原力达到15%时所需样品的量各有不同,其中银粉背蕨地上部分所需样品的量最少,为84.9 μL,阴地蕨地下部分最多,需要881.6 μL.Fe还原力由高到低依次为银粉背蕨(地上)、银粉背蕨(地下)、阴地蕨(地上)、阴地蕨(地下).从图8和9可知,在一定范围内随阴地蕨和银粉背蕨总黄酮和总酚浓度的增加,Fe还原力逐渐增大.
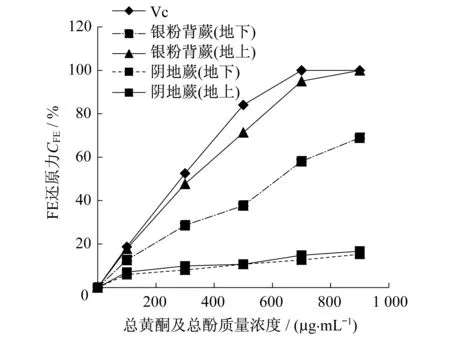
图8 各提取物铁还原力随总黄酮及总酚质量浓度的变化关系
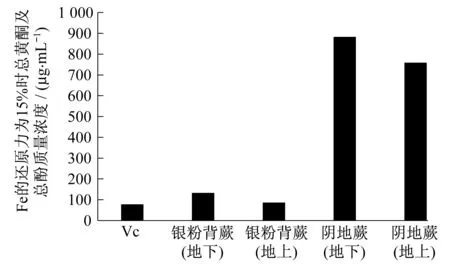
图9 Fe还原力为15%时样品中总黄酮及总酚质量浓度
3 讨 论
3.1 蕨类植物总黄酮含量及其影响因素
黄酮类化合物广泛存在于蕨类植物中,不同的蕨类植物中黄酮含量和种类不尽相同.乌毛蕨科、鳞毛蕨科、水龙骨科、叉蕨科植物中黄酮含量相对丰富,而凤尾蕨科、铁角蕨科、瘤足蕨科植物中黄酮含量相对较低[15].蔡建秀等[17]研究发现,鳞始蕨科乌蕨(Stenolomachusans)地上部分中的黄酮质量分数最高,达34.24%.本研究中银粉背蕨和阴地蕨种间总黄酮质量分数为0.42%~4.12%,存在一定差异.不同蕨类植物总黄酮含量不同的原因可能有:基因组不同导致表达产物不同,生长环境和对环境的适应不同造成的次生代谢产物不同[18].
田兰兰等[19]研究表明:蕨类植物不同部位中总黄酮含量存在差异.里白科芒萁不同部位中黄酮含量具有明显差异,其中根部的黄酮质量分数达28.06%,而干燥老叶中的黄酮质量分数为22.05%,黄酮在嫩茎中含量最低.银粉背蕨和阴地蕨地上部分的总黄酮含量均明显大于地下部分的,同种植物不同部位的总黄酮含量不同的原因可能有:1) 植物细胞在分裂分化过程中,基因选择性表达不同,各器官在生长发育过程中功能不同,具有不同的生理代谢反应,从而使不同部位代谢物含量存在明显差异[18];2) 由于植物呼吸和光合作用水平不一,在光敏反应、能量转运、形态形成过程中,在植物生长激素、生长调节剂的影响下,同一植株的不同部位总黄酮含量不同;3) 从生理活性角度讲,黄酮类化合物具有消炎、抗病毒、防止过敏等作用,银粉背蕨和阴地蕨植株的地上部分长期暴露于外界环境,植物易遭受虫害以及食草动物伤害,而地下部分的生长环境单一且根系不发达,在植物提高自身保护能力和生存能力、协调环境关系中起重要作用,次生代谢产物产生和变化比初生代谢产物与环境有着更强的相关性[20].本研究结果显示:银粉背蕨和阴地蕨不同部位总黄酮含量不同的现象,与机体不同部位的组织特异性,以及针对环境不同而产生的防御、信号传导、适应调节和生长发育等因素息息相关[21].
3.2 蕨类植物总酚含量及其影响因素
研究表明,鳞毛蕨科植物的总酚质量分数为5%~20%,扇叶铁线蕨的总酚质量分数为7.8%~13.2%,乌蕨的总酚质量分数为1.6%~3.6%,且它们不同部位的总酚含量均有所不同[12,22-23].本研究测得银粉背蕨和阴地蕨总酚的质量分数为0.39%~1.64%,银粉背蕨地上和地下部分的总酚质量分数分别为16.4 mg·g-1和3.9 mg·g-1,阴地蕨的地上和地下部分的总酚质量分数分别为7.1 mg·g-1和5.4 mg·g-1.由此可见不同蕨类植物及其不同部位中总酚含量不同,具有组织特异性,推测其原因与总黄酮含量差异原因相似.
3.3 蕨类植物总黄酮和总酚含量与抗氧化活性之间的相关性
蕨类植物总黄酮和总酚含量与ABTS、DPPH自由基清除能力、Fe还原力及总抗氧化能力之间具有一定的相关性.本研究中在一定范围内,随着两种蕨类中总黄酮和总酚含量的增加,它们的DPPH自由基清除率、ABTS自由基清除率、Fe还原力等抗氧化能力都呈上升趋势,即提取物抗氧化活性与总黄酮和总酚含量存在浓度依赖,但不同蕨类植物、不同部位之间效果具有明显差异.可能原因有:1) 由于银粉背蕨和阴地蕨的遗传因素、生态环境、生存条件等不同,其体内黄酮和酚酸种类和结构存在差异;2) 本实验使用的是粗提取物,除总黄酮和总酚外,还有其他抗氧化物质,如多糖的存在.
4 结 论
测定了阴地蕨、银粉背蕨总黄酮和总酚含量及其对DPPH自由基、ABT自由基的清除率和对Fe的还原力,分析了其抗氧化活性,结果表明:
1) 阴地蕨和银粉背蕨乙醇提取物的总黄酮质量分数在4.2~41.2 mg·g-1之间,总酚质量分数在3.9~16.4 mg·g-1之间,两者地上部分总黄酮和总酚含量均高于地下部分,阴地蕨与银粉背蕨的总黄酮和总酚含量存在一定差异;
2) 在一定范围内,随着两种蕨类中总黄酮和总酚含量的增加,其DPPH自由基、ABTS自由基清除率和Fe还原力等抗氧化能力都呈上升趋势,即阴地蕨与银粉背蕨提取物抗氧化活性与总黄酮和总酚含量间存在浓度依赖.
