miR-45-5p在结直肠癌的表达及其生物学特性
2019-01-09鲁杨王金秋郭宇张乐鸣
鲁杨,王金秋,郭宇,张乐鸣
作者单位: 315211宁波,宁波大学医学院(鲁杨、王金秋);宁波市第一医院(郭宇、张乐鸣)
结直肠癌(CRC)是常见的恶性肿瘤,占全球恶性肿瘤死亡原因的第3位[1]。CRC的发展是一个多步骤、多因素过程,而对于其发病机制目前尚未有一个明确的结果[2]。微小RNA(miRNAs)是一类长度为22~25个核苷酸的内源性非编码小分子RNA,其广泛存在于真核生物中[3]。研究证明miRNA在细胞的增殖、凋亡及侵袭等生物学活动中都发挥了重要的作用,是肿瘤潜在的治疗靶点和预后预测指标[4]。miR-455-5p位于第6条染色体上,它在间变性大细胞淋巴瘤[5]、食管癌[6]及胃癌[7]等呈现低表达。Yang等[8]发现miR-455-5p在结肠癌细胞中通过作用于靶基因 galectin-9起着癌基因的作用。但由于该研究入组的组织标本只包含结肠癌组织,缺乏组织学方面的验证,并且只在一株结肠癌细胞株进行研究,不够全面,也并未全面探讨miR-455-5p在CRC中的作用。本研究拟探讨miR-455-5p在CRC的表达及其生物学特性,报道如下。
1 材料与方法
1.1 标本
1.1.1 组织标本 收集2016年3―7月宁波市第一医院收治的行手术治疗的CRC患者的组织标本40例,分别切取CRC组织标本与其癌旁正常黏膜组织(≥10 cm),其中结肠癌标本19例,直肠癌标本21例。40例患者中男24例,女16例;年龄43~85岁,≥60岁28例,<60岁12例,平均(65±11)岁;采用TNM分期法,Ⅰ期6例,Ⅱ期17例,Ⅲ期13例,Ⅳ期4例;病理分化程度为低分化7例,中低分化5例,中分化28例。所有患者术前未行放、化疗或免疫治疗,无其他肿瘤病史,术后病理检查均由2名病理医师诊断。组织标本离体后立刻放入RNA保存液中,于―80℃冰箱中保存。所有过程告知患者并与患者签署知情同意,此研究经宁波市第一医院伦理委员会批准。
1.1.2 细胞株 人结肠癌 SW-480、HCT-116及HT-29细胞株,均购买于上海诺百公司。
1.2 主要试剂 携带有miR-455-5p-mimics的重组质粒和 miR-455-5p-inhibitor的重组质粒及对照miR-455-5p-mimicscontrol和miR-455-5p-inhibitorcontrol由上海吉玛公司合成。反转录试剂盒以及实时荧光定量PCR试剂盒购自南京金斯瑞生物科技公司。转染所需Hieff TransTM脂质体核酸转染试剂购自上海翊圣生物科技有限公司,PBS购自美国Invitrogen公司;Rnase Inhibitor购自上海拜力生物科技有限公司。培养基DMEM购自中国Thermo公司。AnnexinⅤ-PE/7-AAD凋亡试剂盒购自凯基生物公司。鼠抗人 Brdu单克隆抗体购自武汉博士德生物工程有限公司。山羊抗小鼠IgG荧光二抗购自美国美国AAT Bioquest公司。划痕试验所需Protein Marker(DM111-01)购自北京全式金生物技术公司。
1.3 方法
1.3.1 组织标本RNA提取 将组织标本在液氮中研磨,采用Trizol法提取组织总RNA,紫外线分光光度计 NanoDrop ND-1000(NanoDrop,Wilmington,DE)用于评估RNA的浓度和纯度。所有RNA样品置于―80℃保存备用。
1.3.2 CRC细胞转染 选择细胞状态良好的3株CRC细胞株进行培养。采用Hieff TransTM脂质体核酸转染试剂转染3株细胞株,选取1、2和2l的NegativecontrolFAM转染3株细胞,分别用PBS清洗,加入胰蛋白酶清洗消化,离心,弃上清液,再重复上述过程2次,观察细胞转染效率。
1.3.3 miR-455-5p的定量分析 按照试剂盒说明书对总RNA进行逆转录反应制备cDNA。收集的细胞沉淀进行反转录到cDNA后,用sybr染料法进行相对定量检测 miR-455-5p基因的表达水平。检测miRNA表达量的引物序列见表1。
1.3.4 Brdu增殖检测 将转染 miR-455-5p-inhibitor、miR-455-5P-mimics、mimics-NC 及 inhibitor-NC 48h后的SW480、HT-29、HTC-116细胞株收集细胞制成细胞悬液并计数。在24孔板中添加培养基并加入生长细胞的盖玻片,将制备好的细胞悬液分别以2×104接种到24孔板中。加Brdu孵育,浓度10mol/L,时间1h。用PBS清洗3次,加入1%BSA/PBS稀释Brdu抗体,37℃,2 h或者4℃过夜。用PBS洗5min,重复3次。再次加入1%BSA/PBS稀释荧光二抗,37℃下避光孵育45 min。用PBS洗5min,重复 3次。用DAPI或 hoechst染核(1:10000稀释),室温避光10 min。用PBS洗5 min,重复2次。荧光显微镜观察荧光比例。
1.3.5 凋亡检测 将转染 miR-455-5p-inhibitor、miR-455-5P-mimics、mimics-NC 及 nhibitor-NC 48 h后的CRC细胞接种至细菌培养板中,培养条件改为2%FBS的完全培养基,过夜处理第2天,将细胞重悬于100l Binding Buffer中,加入5l 7-AAD染液。轻轻混匀,室温、避光、反应5~15min;再加入400lBindingBuffer、1lAnnexinV-PE混匀;室温、避光、反应5~15 min,最后在1 h内用流式细胞仪和荧光显微镜检测。AnnexinV-PE荧光信号呈橙红色;激发波长546nm,发射波长647nm,观察7-AAD荧光信号呈红色,并统计检测结果。
1.3.6 划痕实验 将转染 miR-455-5p-inhibitor、miR-455-5P-mimics、mimics-NC及inhibitor-NC48h后的HT-29细胞收集后制成细胞悬液并计数备用。用marker笔在12孔板背后,均匀得划横线。用PBS洗细胞3次,去除划下的细胞,加入无血清培养基。放入37℃5%CO2培养箱,培养。按0、6、12及24h取样,拍照。使用ipwin32软件进行面积和长度的分析计算宽度值。通过细胞间距比例进行数据分析。
1.4 统计方法 数据采用SPSS18.0统计软件分析,计量数据以均数±标准差表示,采用t检验。P<0.05为差异有统计学意义。
2 结果

表1 检测miRNA表达量的引物序列
2.1 miR-455-5p在组织中的表达情况及临床病理因素分析 用QPCR方法检测40对配对CRC组织中的miR-455-5p的表达,miR-455-5p在CRC癌组织中相对表达量为(0.59±0.34),在相对应的癌旁组织中相对表达量为(2.45±1.60),差异具有统计学意义(t=3.46,P< 0.01)。
miR-455-5p的表达量与患者的性别、年龄、肿瘤部位,有无淋巴转移、病理类型、肿瘤分期及淋巴结转移数目无明显关系(均P>0.05),与肿瘤的分化程度有关(P<0.05),见表2。
2.2 Brdu检测miR-455-5p对细胞增殖的影响 将未转染的细胞作为空白对照组,转染 miR-455-5p mimics的细胞作为阳性组,转染miR-455-5p-inhibitor的细胞作为阴性对照组。转染miR-455-5p-inhibitor后3株CRC细胞(HT-29、HCT-116、SW-480)的增殖百分比分别为40%、60%和53%;而过表达miR-455-5p-mimics后的 CRC细胞增殖率受到抑制,其中 HT-29、HCT-116及 SW-480 3株细胞的增殖百分比分别为20%、23%和21%,3株细胞的增殖活性均减弱。阳性组与空白对照组及阴性对照组增殖率变化趋势差异均有统计学意义(均P<0.05)。
2.3 流式细胞仪检测细胞凋亡的结果 FCM(A-F)显示转染了 miR-455-5p-mimics的 CRC细胞株(HT-29、HCT-116)的凋亡率分别为 41.43%和48.3%,较miR-455-5p-mimics control组细胞凋亡率(34.82%和39.3%)明显增加(均P<0.05);而在SW-480细胞株中,转染miR-455-5p-5p-mimics凋亡率为11.3%,较转染miR-455-5p-mimicscontrol组的凋亡率(11.81%)无明显变化。见封二彩图3。
鲁杨,王金秋,郭宇,等.miR-45-5p在结直肠癌的表达及其生物学特性(见正文第1572页)
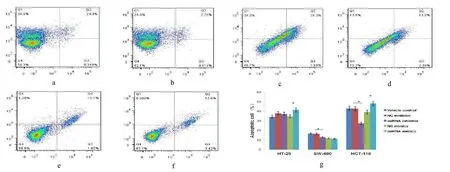
图3 流式细胞仪检测细胞凋亡的结果
2.4 划痕实验检测miR-455-5p对HT-29细胞迁移能力的影响 对HT-29细胞划痕处理后,间隔6 h连续观察细胞的迁移运动,转染miR-455-5pinhibitor组划痕24h,细胞已基本完全覆盖划痕区域。见封二彩图4。

图4 划痕实验检测:miR-455-5p抑制HT-29细胞株迁移
3 讨论
研究发现,miRNA能够在转录水平调节基因的表达。由于它们在肿瘤中起着癌基因或抑癌基因的作用[9],如今已经成为了肿瘤研究的热点。随着miRNA在肿瘤研究方面的不断深入,人们逐渐发现miRNA与某些抗肿瘤药物疗效密切相关,并参与肿瘤对药物敏感性的调控,这也预示其在临床上具有指导作用。研究证实,miRNA在肿瘤早期诊断方面具有独特的优势[10]。miR-21作为首个在人体体液中发现的miRNA,Toiyama等[11]通过对比分析186例肠癌组织、43例高级别腺瘤及53例对照组发现,血清miR-21表达水平随临床分期呈阶梯状升高,且其灵敏度及特异度都很高,认为其可作为CRC的筛查手段。该研究还发现miR-21表达水平可作为影响CRC患者生存的独立预后因素。Slaby等[12]发现,在CRC组织中miR-145表达水平明显下调,且其表达水平与肿瘤体积和TNM分期有临床相关性,认为miR-145作为抑癌因子在肠癌发展过程中起到重要作用,尤其在腺瘤恶变为腺癌过程中尤为显著。miRNA与CRC的相互关系,为CRC的预防、诊断和治疗提供了新的思路。
miR-455-5p作为miR-455家族中的一员,研究已证明其在肿瘤中起着重要作用。Shoshan等[13]在黑色素瘤中发现 miR-455-5p负调控肿瘤抑制因子CPEB1基因,从而促进肿瘤的生长及转移。Hudson等[14]证明miR-455-5p在甲状腺髓样癌呈现低表达状态,其在甲状腺髓样癌的发生发展中起着重要作用。在其他肿瘤,如弥漫性大B细胞淋巴瘤[15]、胸腺上皮肿瘤[16]中也进一步证明miR-455-5p起着抑癌基因的作用,在肿瘤的发生过程中起着重要的生物学作用。
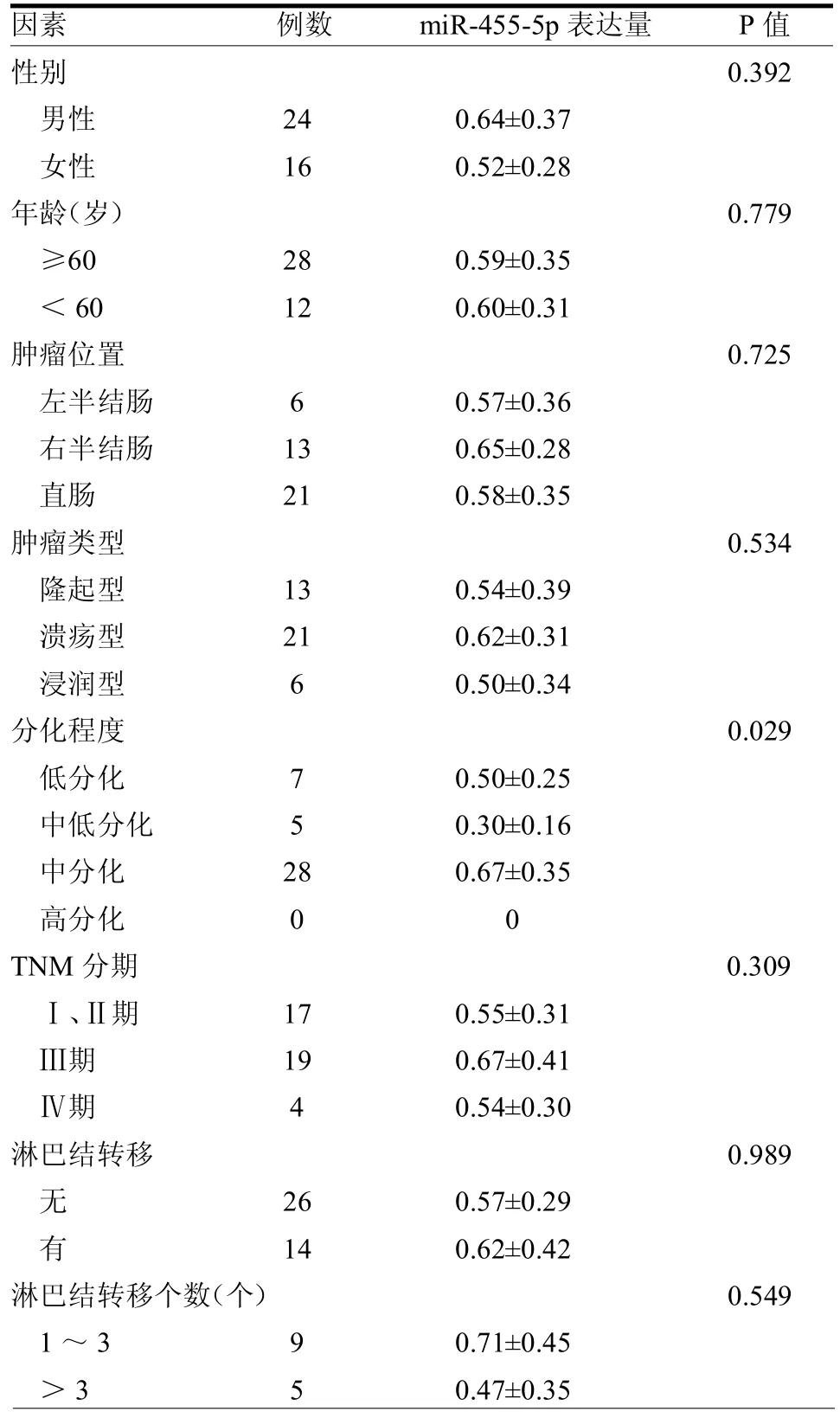
表2 CRC患者的临床病理因素
miRNAs表达的改变可以导致遗传信息表达的改变,从而导致相应的病理生理状态,而处于一定病理生理状态的组织常伴有特定的miRNAs表达[17]。在本研究中,笔者首先证明了miR-455-5p在CRC患者癌组织中表达显著低于癌旁组织;通过miR-455-5p与CRC患者临床病理因素进行分析发现,miR-455-5p的表达量与肿瘤的分化程度有关。这一结果也证明了 miR-455-5p可能起着抑癌基因的作用,参与CRC的发生发展过程。
本研究通过转染CRC细胞,通过Brdu检测、流式细胞仪检测、划痕实验等发现miR-455-5p可影响CRC细胞的生长,其与肿瘤细胞增殖活性有关,也与肿瘤细胞凋亡活性的增强密切相关,由此证实miR-455-5p在CRC中可以作为一个抑癌基因来发挥抑制肿瘤细胞增殖和促凋亡的作用。而本研究的结果也与miR-455-5p在其他肿瘤的研究一致[13-16]。
目前miR-455-5p在CRC的研究中机制尚不清楚,Yang等[8]在结肠癌组织中发现miR-455-5p的相对表达较癌旁组织是升高的,并且进一步在HT-29细胞株中发现其抑制细胞的凋亡,促进细胞的增殖,起着一个癌基因的作用,而这一结果与本研究的结果存在差异。笔者认为,两个研究在实验设计方法及研究目的上存在不同,Yang等[8]的研究是采用CCK方法进行增殖实验,且研究miR-455-5p与galectin-9之间的关系;而本研究是采用Brdu方法进行检测,另外该研究在组织样本量的检测中只有10例,且均为结肠癌组织,较本研究数量上存在差距,并且本研究入组的标本组织种包含了结肠癌组织和直肠癌组织;在细胞实验中Yang等[8]的研究也只是在一种细胞株中进行实验,结果可能存在偏倚,所以两个研究结果出现了差异。本研究与Yang等[8]的研究结果的差异,也提示miR-455-5p在CRC中可能存在异质性,并不像其在其他肿瘤中只表现抑癌作用,可能起着癌基因和抑癌基因的作用,对于以后通过miR-455-5p治疗CRC,其治疗方式可能不同于其他肿瘤。因此对于miR-455-5p在CRC中的研究还将继续。
综上所述,miR-455-5p在CRC组织中低表达,具有类似抑癌基因的作用,降低了CRC细胞的增殖、迁移能力,为CRC的治疗提供了一个新的靶点,但是miR-455-5p是如何在CRC细胞中发挥作用,以及与其所针对的下游靶基因所介导的通路尚不明确,同时考虑到本研究中所搜集的标本量较少,在样本数据与临床病理分析中得到的结论可能缺乏一定的科学性。
