大豆苷元对大鼠心室肌细胞INa的影响
2019-01-04沙毛毛马宏昕任静娜饶本龙薛文君王嘉仪许正新
匡 怡,沙毛毛,马宏昕,任静娜,饶本龙,薛文君,王嘉仪,许正新
(扬州大学医学院药理学教研室,江苏 扬州 225000)
心肌细胞通过各离子通道调节跨膜离子的电位差,保持心脏功能状态[1]。一旦心肌离子通道发生病变或动态平衡被打破,容易诱发多种心脏疾病,心律失常是最常见的表现形式。钠、钾、钙等常见离子通道在心肌细胞膜上分布最为广泛[2]。其中,电压门控性钠通道(voltage-gated sodium channel,VGSC)亦称快钠通道,该通道可引发心肌细胞动作电位,并完成心脏传导,在维持心脏电生理过程中不可或缺[3]。钠通道作为Ⅰ类抗心律失常药物的作用靶点,但其治疗效果不到60%,因此,寻求疗效较好的抗心律失常新药并揭示其机制,始终是热点研究方向。
葛根是多年生落叶藤本豆科药用植物野葛[Puerarialobate(Willd.) Ohwi]的干燥根[4],始载于《神农本草经》,位列中品,性凉,味甘、辛,具有“解肌热、止烦渴、泻胃火”之效,作为中药方剂的经典配伍沿用至今,其发挥药理活性的主要成分是异黄酮类化合物,包括葛根素、大豆苷元、染料木黄酮等[5]。文献报道,大豆苷元(daidzein,DD)具有提高免疫、抗癌症、抑制骨质疏松、抗氧化、改善妇女经期等多种药理作用[6]。另有一些研究结果表明,在整体动物实验中,DD可对抗异丙肾上腺素[7]、乌头碱[8]、心肌缺血/再灌注损伤[9]等多种原因诱发的心律失常,能明显缩小心肌梗死面积和抑制心肌肥厚。临床使用黄豆苷元片治疗高血压病及症状性高血压、冠心病和眩晕症,但作用机制未明。有人推测DD的以上作用与其影响钠通道有关[10],但缺乏证据支持。本实验运用全细胞膜片钳技术,以急性分离的心肌细胞为样本,直接观察DD对大鼠心室肌细胞INa的影响,以期为其今后的进一步开发及其临床应用提供理论依据。
1 材料
1.1实验动物SPF级成年SD大鼠,体质量(250±50)g;出生d 1~3的SD乳鼠(♀♂兼用),均由扬州大学比较医学中心供应,实验动物生产许可证号:SCXK(苏)2012-0004,使用许可证号:SYXK(苏)2012-0029。
1.2药物与试剂DD (纯度≥98%,成都德思特生物技术有限公司);牛磺酸、HEPES、葡萄糖(美国Sigma公司);胶原酶II(美国Worthington Biochemical公司);河豚毒素(tetrodotoxin,TTX) (上海克拉玛尔试剂公司);DMEM、胎牛血清FBS(美国HyClone公司)。
1.3试剂配制无钙台式液(mmol·L-1):NaCl 136.0、KCl 5.4、HEPES 5.0、NaH2PO4·2H2O 0.33、MgCl2·6H2O 1.0、葡萄糖 10.0,pH值用NaOH调至7.34~7.38;台式液:50 mL无钙台氏液中加1.8 mmol·L-1CaCl2即可;酶液:无钙台式液中加入0.5 g·L-1的胶原酶Ⅱ、1 g·L-1的BSA和30 μmol·L-1的CaCl2;细胞保存液(KB液,mmol·L-1):L-谷氨酸70.0、牛磺酸10.0、KCl 25.0、EGTA 0.5、HEPES 5.0、NaH2PO4·2H2O 10.0、葡萄糖 11.0、HEPES 5.0、KOH 89.0,pH值用KOH调至7.35~7.40;钠电流电极外液(mmol·L-1):NaCl 135.0、CsCl 5.4、CaCl22.4、MgCl22.1、CdCl20.35、HEPES 5.0、葡萄糖 11.0,pH值用NaOH调至7.40;钠电流电极内液(mmol·L-1):CsCl 133.0、NaCl 5.0、EGTA 10.0、TEACl 20.0、HEPES 5.0、MgATP 5.0,pH值用CsOH调至7.37~7.38;DD溶于DMSO,其终浓度控制低于千分之一。
1.4仪器Patch clamp EPC 10膜片钳仪(德国HEKA Instrument公司);P-97微电极拉制仪、MP-225三维操纵器(美国Sutter Instrument公司);IX71倒置显微镜(日本 Olympus公司);BSA124S电子天平(美国Sartorius公司);DIGIDATA-1440 A/D-D/A 转换器(美国Axon Instruments公司);Multiskan FC型酶标仪(美国Thermo公司)。
2 方法
2.1乳鼠心肌细胞的分离和培养取SD乳鼠,浸泡75%乙醇中消毒,于无菌条件下开胸,取其心脏,在预冷的PBS中冲洗2~3次,将心肌组织剪成1 mm3的小块,转移至离心管中。加入0.25%的胰酶液,置37 ℃水浴箱中分4次消化,至出现拉丝絮状白色组织块。收集除第1次消化以外的细胞悬液于离心管中,离心5 min,弃上清液,加入含有胎牛血清的培养基终止对胰酶的消化,200目滤网过滤。再离心5 min,弃上清液,收集细胞,加入含有10%胎牛血清DMEM,制成单细胞悬液,静置在37 ℃、5% CO2孵箱中,差速贴壁1.5 h,获得高纯度心肌细胞。后接种于培养皿中,隔24~48 h换液。
2.2MTT法检测细胞活性于96孔板中每孔接种8 000~10 000个乳鼠心肌细胞,每孔100 μL。待细胞贴壁后,长满至80%开始实验。吸弃培养液,分别加入不同浓度的DD溶液(0、1、3、10、30、100、300 μmol·L-1),平行5孔。药物分别作用24、48 h后,每孔加入10 μL MTT溶液(5 g·L-1),置孵箱中培养4~6 h,弃上清液,每孔加入100 μL DMSO溶液,经摇床低速晃板10 min后。在酶联免疫分析仪上490 nm波长处测A490,实验重复3次,取平均值。
2.3心肌细胞的分离SD大鼠ip肝素钠2000 IU·kg-1,约10 min后ip 1%戊巴比妥钠(10 mL·kg-1)。待麻醉显效后,将大鼠仰位固定于鼠台,剪开胸腔充分暴露心脏,于降主动脉段快速剪下,置于4 ℃无钙台式液清洗,去除多余脂肪结缔组织,用缝线结扎主动脉,固定在Langendorff灌注架上。用台式液灌流,待心脏复跳2~3次后,随后加预先以100% O2饱和的无钙台式液灌流5~10 min,再用酶液循环灌流20~30 min,直至心脏明显胀大,触感较软,滴液浑浊微黄,即刻停止消化。实验过程灌流液温度维持在(37±0.5) ℃。在KB液中剪碎心肌组织,过滤,得单个游离心室肌细胞。于室温中静置10 min,弃上清液,加入KB液复悬,反复3次。
2.4INa记录吸取细胞悬液于倒置显微镜培养皿中(皿中储存1 mL细胞外液),静置5~10 min,待细胞贴壁后,选择横纹清晰、表面光滑、立体感强、静息舒展的长杆状心肌细胞进行后续实验操作,实验温度保持(22~25) ℃,湿度20%~40%。为除去细胞间大小误差,INa幅值用电流密度(pA/pF)来表示。
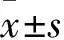
3 结果
3.1DD对乳鼠心室肌细胞活性的影响用酶解法急性分离乳鼠心肌细胞,培养24、48 h后,给予终浓度1、3、10、30、100 μmol·L-1的DD,MTT法测定细胞活力。如Fig 1所示,与对照组(0 μmol·L-1)相比,不同浓度的DD对乳鼠原代心肌细胞活力均有影响。当细胞培养至24 h时,细胞活力在DD 1~100 μmol·L-1时有所降低,其中10 μmol·L-1时与对照组比较,细胞活力明显降低(P<0.05);当细胞培养时间延长至48 h,与对照组相比,DD在1~10 μmol·L-1时,随药物浓度增加,心肌细胞活力明显降低(P<0.05),当浓度增至30~100 μmol·L-1时,对心肌细胞活力的影响强度更明显(P<0.01);与24 h相比,细胞在48 h时,0~10 μmol·L-1DD差异无显著性,30~100 μmol·L-1差异有显著性,且随药物浓度增加,细胞活力明显降低(P<0.05)。由此提示,此浓度范围内的药物对细胞产生的毒性较大,DD的IC50在30~100 μmol·L-1。
3.2DD对心室肌细胞INa的影响为记录DD对INa的影响,本实验使用方波单刺激方案,给予指令电压-80 ~20 mV,刺激脉宽30 ms,持续刺激时间20 ms的方波单刺激。Fig 2结果表明,可引出快速激活快速失活的的内向电流,该电流几乎可被15 μmol·L-1的高特异性钠通道阻滞剂TTX阻断,证实所记电流为INa。0.3 μmol·L-1DD作用后,INa明显减小,待电流趋于稳定后,用细胞灌流槽冲洗5 min,该电流逐渐恢复,表明INa的减小确是由药物作用引发的。
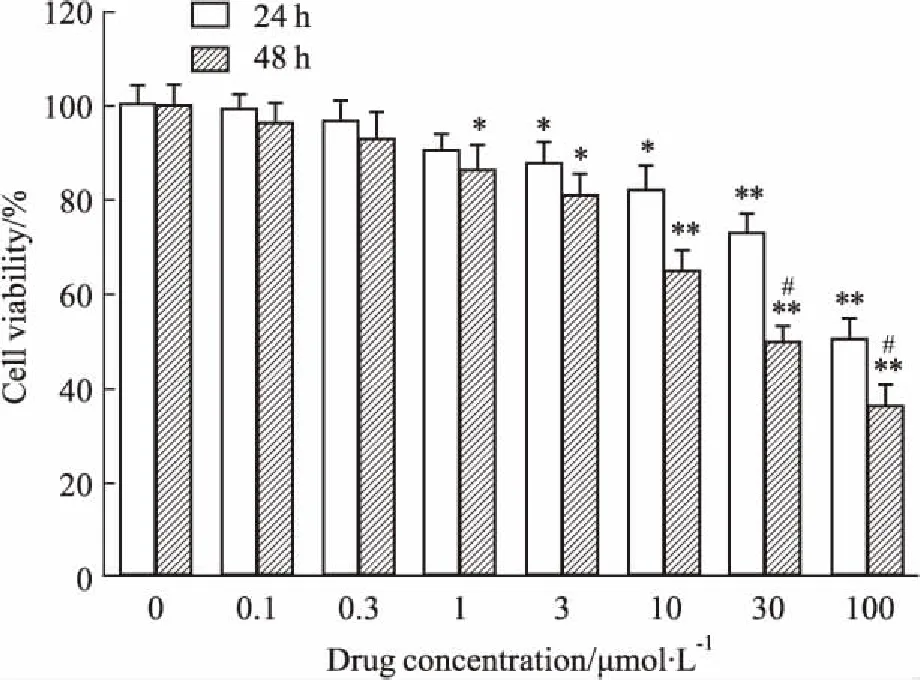
Fig 1 Effects of different concentrations of daidzein on viability
*P<0.05,**P<0.01vscontrol group;#P<0.05vs24 h

Fig 2 Effects of daidzein on single stimulation of INa
3.3不同浓度的DD对心室肌细胞INa的影响运用膜片钳的全细胞模式,刺激方案同“3.2”,使用细胞累积加药法,分别观察DD在0.1、0.3、1、3、10 μmol·L-1浓度下对心室肌细胞INa的作用。Fig 3结果表明,当给予DD 0.1 μmol·L-1后,其对INa影响微弱,而0.3、1、3、10 μmol·L-1的DD使得大鼠心室肌细胞INa从给药前(-53.9±6.35) pA/pF分别降至(-33.78±3.24) pA/pF、(-25.16±4.24) pA/pF、(-22.28±3.54) pA/pF和(-17.96±4.56) pA/pF;与对照组相比,0.3、1 μmol·L-1低浓度的DD就具备抑制效果,且效果明显(P<0.01),其对INa的抑制率分别约为37%和53%,具有统计学意义(P<0.05)。提示DD呈浓度依赖性抑制Na+通道电流,随浓度增加,抑制作用愈强。
3.4DD对心室肌细胞INa时间过程的影响为探究DD对心室肌细胞INa时间过程的影响,采用刺激方案同“3.2”。当0.3 μmol·L-1DD作用5 min后(Fig 4),INa,peak明显降低(a段),并随时间延长而减弱,后趋于稳定,电流幅值几乎不变(b段)。而在随后的洗脱过程中(c段),INa,peak逐渐恢复,其INa,peak在随后的洗脱过程也是可逆的。
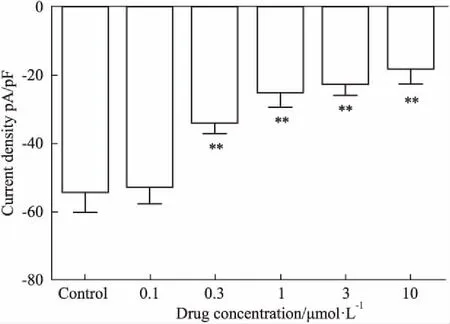
Fig 3 Effects of daidzein on INa,peak

**P<0.01vscontrol group

Fig 4 Effects of 0.3 μmol·L-1 daidzein
3.5DD对INa电压(I-V)关系曲线的影响在电压钳模式下,保持初电位-80 mV,给予-70~90 mV、阶跃5 mV、持续时间30 ms的方波串刺激,刺激频率0.5 Hz,记录给药前后INa。以膜电位为横坐标,对应的钠通道最大电流密度为纵坐标绘制I-V曲线。Fig 5结果表明,1、3、10 μmol·L-1DD作用后,使I-V曲线明显上移,INa渐渐减少,但不改变曲线形态、激活阈电位(-50 mV)、最大激活电压(-20 mV)和反转电位(95 mV)。给药前,INa的最大电流密度在-20mV时为(-44.90±1.05) pA/pF,而在1、3、10 μmol·L-1DD的作用下,最大电流密度是(-22.30±2.03) pA/pF、(-15.41±1.58) pA/pF、(-12.45±2.35) pA/pF (P<0.01)。可见,随浓度增加,最大电流密度明显减小。
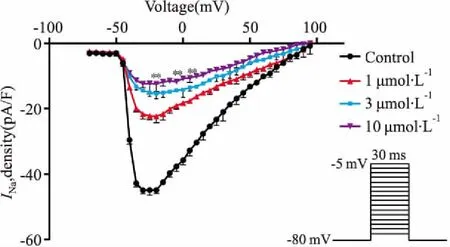
Fig 5 Effects of daidzein on I-V curve of INa before
**P<0.01vscontrol group


Tab 1 Effects of daidzein on recovery-related kinetic parameters after INa

Fig 6 Effects of daidzein on activation kinetics of
A:The effect of 1,3,10 μmol·L-1daidzein and daidzein eluted by extracellular fluid on the activated primary currents ofINa; B: The effect of 1,3,10 μmol·L-1daidzein on the steady-state activation curve ofINa.**P<0.01vscontrol group.
3.8DD对INa失活后恢复动力学的影响在电压钳模式下,采用双脉冲刺激法,保持电位为-80 mV,给予去极化至-30 mV的刺激,刺激时间持续30 ms,回到保持电位持续5 ms后,再给予一系列去极化至-30 mV,30 ms的刺激,其中前后两个脉冲的间隔时间以5 ms的幅度逐渐增加,共计15个脉冲,来引出钠通道失活后恢复电流,以相对电流I/Imax为纵坐标,各膜电位为横坐标作图。依据One-phase association指数方程I/Ipre=1-exp(-t/τ)拟合,I/Ipre为后一个脉冲与前一个脉冲电流的比值,t为两脉冲间的时间间隔,τ为通道失活后再激活至电流最大值的恢复时间。Fig 8、Tab 1结果显示,DD使INa的失活后恢复曲线右移,而1 μmol·L-1DD使τ由给药前(11.31±0.13) ms变为(13.30±0.24) ms;同样给予3、10 μmol·L-1DD后,τ为(15.49±0.32) ms和(21.35±0.22) ms,恢复时间明显延长(P<0.01)。结果表明,DD可改变INa的失活后恢复动力学特征,呈浓度依赖性延缓INa从失活态向激活态转变。

Fig 7 Effects of daidzein on inactivation kinetics of
A:The effect of 1,3,10 μmol·L-1daidzein and daidzein eluted by extracellular fluid on the inactivated primary currents ofINa; B: The effect of 1,3,10 μmol·L-1daidzein on the steady-state inactivation curve ofINa.**P<0.01vscontrol group.

Fig 8 Effects of daidzein on recovery kinetics after INa
A:The effect of 1,3,10 μmol·L-1daidzein and daidzein eluted by extracellular fluid on the recovered primary currents ofINa; B: The effect of 1,3,10 μmol·L-1daidzein on the steady-state recovery curve ofINa.**P<0.01vscontrol group.
4 讨论
根据WHO统计,在2015年,有70%的人死于非传染性疾病,其中心血管疾病死亡人数达1 770万(31%),且约25%的患者死亡是由心律失常引起的[11]。我国传统中医药中也有许多关于心律失常的记载和描述,如《伤寒杂病论》中的“脉浮、心动悸、怔忡”,中医脉学上的“促、结、迟、涩、芤脉”等,并留下了一些治疗经验方,如炙甘草汤、安神丸、葛根芩连汤等。DD作为葛根芩连汤君药葛根的有效活性成分,可对多种类型心律失常有治疗作用[12]。众所周知,心律失常发生的主要机制是心肌细胞自律性升高、心肌组织内形成折返和出现后除极[13],钠通道是目前治疗心律失常的主要靶点之一[3]。
MTT实验结果显示,DD的IC50在30~100 μmol·L-1,本实验给药终浓度设定为0.3~10 μmol·L-1。采用膜片钳技术记录DD对大鼠心室肌细胞INa特性,结果表明,DD对I-U曲线的幅值具有抑制作用,呈剂量依赖性阻滞Na+内流;同时使其Na+通道激活过程缓慢,使通道开放程度降低,加快失活过程,明显延长Na+通道从失活态到静息态的恢复过程,即可延缓心室复极时INa的恢复,通过延长有效不应期来抑制快速性心律失常,降低钠通道的间隙兴奋性,这与I类抗心律失常药物钠通道阻滞剂特性相关[3],此分子水平的实验结果也与整体动物实验中DD的作用一致。因此,可以部分解释其抗心律失常作用机制。
有研究证实[14],DD溶液在体内吸收迅速,表明其在急性心肌缺血和脑缺血等疾病中实用性较强,主要优先分布于心、脑、肝等脏器中,显示其在治疗心脑血管疾病较高特异性。另有文献报道[6],DD也是一类天然植物雌激素,与哺乳动物雌激素17-β雌二醇的结构特征存在共性:有一对间距相近的羟基基团及一个酚环,这类结构的相似性决定了DD具有一定雌激素效应,雌激素在体内和体外可调节心肌细胞存活、抑制细胞凋亡等相关蛋白质的表达和激活,从而产生心脏保护作用,尤其可对过氧化物所致心肌缺血/再灌注的损伤起到保护作用。心肌缺血/再灌注损伤时,由于缺血心肌ATP生成减少,使得细胞膜上钠泵功能减弱,致大量Na+内流至细胞内,易引起细胞水肿,此时Na+可激活细胞膜上的Na+-Ca2+交换,造成Ca2+跨膜通透性增加和内流超负荷。而且由于缺血心肌内酸中毒,在此过程中产生氧自由基(主要是OH-),使得Na+-H+交换系统被激活,Na+-H+交换在排出细胞内H+的同时,大量Na+内流至细胞内,由此又在后除极达到阈电位水平后引起新的动作电位[15]。已知,目前的心脏活性药物几乎没有对一种离子通道具有绝对选择性,科学家通过构建Cav1.2和Nav1.5通道蛋白模型,发现钠钙通道之间存在结构相似性,很好地解释其发生交叉反应的可能性[16]。
综上所述,DD可能是对大鼠心室肌细胞Na+通道电流具有抑制效应,从而发挥抗心律失常的作用。后期可在古方基础之上继续深入挖掘,从心室肌细胞钙通道和钾通道等多种途径,系统探究该药能影响离子通道的哪些亚型,为该药的进一步开发、利用及更好地指导临床用药提供理论依据。
(致谢:本实验在扬州大学医学院细胞膜片钳室和药学实验中心完成,感谢本课题组老师和全体同学的指导与帮助)
