20-HETE在苯扎贝特保护糖尿病肾病中的作用
2019-01-04丁淑梅邱红梅蒋青松
丁淑梅,张 杰,邱红梅,黄 波,吴 芹,蒋青松
(1. 重庆医科大学药理学教研室,重庆市生物化学与分子药理学重点实验室,重庆 400016;2. 遵义医学院基础药理教育部重点实验室暨特色民族药教育部国际合作联合实验室,贵州 遵义 563003)
糖尿病是临床最常见的慢性疾病之一,常伴有严重的并发症。糖尿病肾病(diabetic nephropathy,DN)是糖尿病患者最主要的并发症,也是导致终末期肾脏疾病的重要原因。DN病理改变包括肾小球肥大、肾小球基底膜增厚、肾小管间质纤维化、蛋白尿大量增加等[1]。过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptors,PPARs)属于核受体家族,包括α、β、γ 3种受体亚型,具有调节脂质和葡萄糖代谢、抗炎、抗纤维化等作用,其选择性激动剂已用于临床相关疾病的治疗[2]。PPARs的3种亚型在肾脏均有表达[3]。临床研究发现,PPARα受体激动剂非洛贝特可使糖尿病患者的蛋白尿减少,改善糖尿病肾损伤[4];PPARγ激动剂噻唑烷酮类对DN足细胞损伤有保护作用,从而改善肾功能,减少蛋白尿[5]。而PPARβ的研究相对较少,目前无选择性PPARβ激动剂上市。苯扎贝特(bezafibrate,BEZ)是目前唯一上市的PPARs泛激动剂,对PPARα、PPARβ和PPARγ都有激活作用[6]。研究发现,BEZ也能减少DN患者的微量白蛋白尿[7]。目前,BEZ主要用于血脂紊乱的治疗,而对于其在DN的保护作用及可能机制研究较少。
20-羟-二十烷四烯酸(20-hydroxy eicosatetraenoic acid,20-HETE)是花生四烯酸(arachidonic acid,AA)ω-羟化酶途径经细胞色素P450(cytochrome P450,CYP)4A/4F催化生成的代谢产物,对正常生理功能具有广泛的调节作用,参与多种疾病的病理过程[8],如糖尿病、心血管疾病、肿瘤等。近年研究发现,PPARs的作用与20-HETE有关。在DN大鼠的肾小球,PPARα受体激动剂氯贝特可上调CYP4A表达,增加20-HETE而产生肾保护作用[9]。在DOCA-盐诱导的高血压大鼠模型,另一个PPARα受体激动药非洛贝特也可以上调CYP4A表达,增加20-HETE而产生降压作用[10]。那么,在糖尿病引起的肾脏损伤中,BEZ的作用是否也与CYP4A-20-HETE的变化有关?目前国内外未见相关报道。本研究拟利用高糖高脂饮食联合链脲佐菌素(streptozocin,STZ)建立糖尿病模型,以尿素氮(urea nitrogen,BUN)、血肌酐(serum creatinine,Scr)、尿白蛋白、肾脏病理变化为DN形成指标,观察BEZ对DN的保护作用,以及20-HETE的变化情况。
1 材料与方法
1.1材料
1.1.1实验动物 6~8周龄清洁级♂昆明小鼠,由重庆医科大学实验动物中心提供,许可证号:SCXK(渝)2012-0001。
1.1.2试剂 BEZ购自Sigma公司(纯度98%,用0.5%羧甲基纤维素钠制成混悬液),批号:BCBK4044V;STZ购自Sigma公司,批号:WXBC2544V;兔抗CYP4A、PPARα、PPARβ、PPARγ多克隆抗体、鼠抗GAPDH单克隆抗体,均购自美国Protein Tech公司;小鼠20-HETE ELISA检测试剂盒,购自上海江莱生物科技有限公司;ECL化学发光试剂盒购自美国Thermo公司;其余试剂均为国产分析纯。
1.1.3仪器 AU5811全自动生化分析仪(美国贝克曼库尔特有限公司);ONETOUCH Ultra血糖仪(美国强生公司);Bio-Rad化学发光成像系统(美国伯乐公司);DENLEY DRAGON Wellscan MK 3酶标仪(美国Thermo公司)。
1.2方法
1.2.1DN模型的建立 小鼠适应性喂养1 周后,用高糖高脂饮食喂养4 周,腹腔注射STZ(溶于pH 4.5的柠檬酸缓冲液中,现用现配)40 mg·kg-1·d-1,连续5 d。7 d后,用血糖仪测空腹血糖值(fasting blood glucose,FBG)。从40只小鼠中选取FBG≥11.1 mmol·L-1小鼠30只,继续给予高糖高脂饮食4 周。随机选择10只小鼠处死进行病理学检测,证实DN改变,提示DN模型形成,即为DN模型组。其余糖尿病小鼠随机分成2组(每组10只),分别为,DN形成4 周组(DN4W):给予等剂量的羧甲基纤维素钠缓冲溶液;BEZ组(BEZ):BEZ 75 mg·kg-1·d-1灌胃,持续4周。正常对照组(NC):另取小鼠10只,给予正常饲料喂养4周,连续5 d腹腔注射等剂量的枸橼酸缓冲溶液,7 d后测血糖值,然后继续用正常饲料饲养4周后,灌胃给予等剂量的羧甲基纤维素钠缓冲溶液4周。
每周检测小鼠的FBG,并用代谢笼收集尿液(检测尿液体积和尿白蛋白含量)。给药4周后,眼眶取血,处死小鼠。立即取出肾脏并称重。计算肾脏指数(肾质量/体质量)。分装标本,液氮速冻后,保存于-80 ℃冰箱备用。
1.2.2肾功能指标检测 将血液分装后,室温静置30 min,4 ℃、3 000 r · min-1离心15 min,取血清冻存于-80 ℃冰箱备用。尿液于4 ℃、3 000 r · min-1离心15 min,取上清冻存于-80 ℃冰箱备用。用自动生化分析仪检测Scr、BUN和尿白蛋白的水平。
1.2.3Masson染色 肾脏组织置于4%的多聚甲醛中固定24 h,75%乙醇脱水,石蜡包埋,制作组织切片。用Masson染色进行病理学检查。使用Image J 1.43软件测量肾小球横断面面积(glomerular cross-sectional area,GA),计算平均肾小球体积(glomerular volume,GV)。每只小鼠取20个肾小球的面积,计算GV:GV=β/κ×GA3/2,其中β=1.38,为球体形状系数;κ=1.1,为粒径分布系数。每组取5只小鼠。
1.2.4透射电镜 用冷刀片切取0.5 mm3肾组织置于4%的戊二醛固定液中,4 ℃固定2 h,用PBS清洗3次,后经1%的四氧化锇固定2 h,常规乙醇和丙酮梯度脱水,环氧树脂浸透、包埋、聚合、切片,醋酸铀和拘椽酸铅双重染色,置于透射电镜下观察。
1.2.5Western blot检测肾脏组织PPARα、PPARβ、PPARγ、CYP4A蛋白的表达 称取50 mg肾脏组织,加入0.5 mL RIPA裂解液,4 ℃匀浆。于4 ℃、12 000×g离心15 min,提取肾脏组织蛋白,BCA 法测定蛋白浓度。蛋白上样量为40 μg。SDS-聚丙烯酰胺凝胶电泳,转膜,封闭,加入一抗GAPDH (1 ∶2 000)、CYP4A (1 ∶1 000)、PPARα (1 ∶1 000)、PPARβ (1 ∶1 000)、PPARγ (1 ∶1 000),4 ℃过夜;TBST 洗膜,5 min×3次,二抗室温孵育2 h,洗膜后加ECL发光试剂显影,采用Image Lab 4.1进行检测分析,蛋白相对表达量=目的蛋白条带灰度/GAPDH条带灰度,每组重复3次。
1.2.6ELISA检测20-HETE含量 按照试剂盒说明书操作,用酶标仪于450 nm波长检测各样品OD值,根据标准曲线计算血清20-HETE的水平。
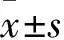
2 结果
2.1BEZ对DN小鼠FBG的影响如Fig 1所示,给予STZ 7 d后,DN小鼠 FBG升高至(19.98 ± 2.21) mmol·L-1(P<0.01)。在整个实验期间,DN小鼠的FBG维持在较高的水平。BEZ给药FBG水平略有下降(P<0.05),但仍远高于11.1 mmol·L-1的糖尿病的诊断标准。
2.2BEZ对DN小鼠肾功能的影响如Tab 1所示,糖尿病形成4周后,模型小鼠BUN、Scr、尿白蛋白明显升高(P<0.01),且尿白蛋白比正常组高23.22倍,提示糖尿病小鼠出现了DN。实验结束时,即DN形成4 周后,模型小鼠BUN、Scr、尿白蛋白升高更加明显(P<0.01),尿白蛋白比正常组增加36.21倍,提示模型小鼠DN加重。BEZ治疗给药4周后,使糖尿病小鼠上述指标水平明显下降(P<0.01),尿白蛋白降低了71.02%。

Fig 1 Effect of bezafibrate on FBG level in mice
*P<0.05,**P<0.01vsDN4W

Tab 1 Effect of bezafibrate on BUN,SCr and urinary albumin
**P<0.01vsNC;##P<0.01vsDN4W.
2.3BEZ对DN小鼠肾脏病理的影响与正常组比较,糖尿病形成4周后,小鼠肾脏指数(Fig 2C)、肾小球体积(Fig 2D)明显增大(P<0.01);Masson染色可见,肾小球中出现胶原纤维、肾小管扩张、空泡变性(Fig 2A);电镜检查可见,小鼠肾脏基底膜不均匀增厚、足突部分融合、系膜基质增加(Fig 2B)。上述病理改变提示DN形成。DN形成4周后,小鼠肾脏指数(Fig 2C)、肾小球体积(Fig 2D)进一步增大(P<0.01);肾小球中出现大量胶原纤维,相互交联成网,细胞间质胶原纤维增生,肾小管扩张,空泡变性明显(Fig 2A);小鼠肾脏基底膜局部增厚或变薄,微血管瘤形成,足突消失溶解,系膜基质增加(Fig 2B)。BEZ给药4周后,与DN4W组比较,小鼠的肾脏肥大(P<0.01)、胶原纤维增生、肾小管扩张、空泡变性、基底膜增厚等病理明显改善。
2.4BEZ对DN小鼠PPARα、PPARβ、PPARγ蛋白表达的影响如Fig 3所示,与正常组比较,DN4W小鼠肾脏PPARα、PPARβ、PPARγ蛋白表达分别减少了31.77%、26.09%、38.71%(P<0.01);BEZ给药则使其分别增加了0.27、0.15、0.27倍 (P<0.01)。

Fig 2 Effect of bezafibrate on pathological changes of kidney tissues in mice with diabetic
A: Masson staining (×400); B: Transmission electron microscopic examination (×10 000); C: Kidney index; D: Glomerular volume.**P<0.01vsNC;##P<0.01vsDN4W.

Fig 3 Effect of bezafibrate on PPARα,PPARβ,PPARγ protein expression of kidney in mice with diabetic
**P<0.01vsNC;##P<0.01vsDN4W
2.5BEZ对DN小鼠CYP4A蛋白表达和血清中20-HETE的影响如Fig 4所示,与正常组比较,DN4W小鼠肾脏CYP4A蛋白表达减少了32.00%(P<0.01),血清20-HETE的含量降低了29.89%(P<0.01);BEZ给药则使二者分别增加了0.21倍和0.26倍(P<0.01)。
3 讨论
DN是糖尿病最常见和最严重的一种并发症,目前仍然缺乏有效的预防和治疗措施。临床研究表明,BEZ能减少DN患者微量白蛋白尿[7];联合小剂量螺内酯治疗,BEZ除了降低DN患者血脂水平外,也使尿白蛋白大幅度下降[11]。本研究利用高糖高脂饲料联合STZ诱导形成糖尿病4周后,糖尿病小鼠的BUN、Scr和尿白蛋白均升高,且尿白蛋白高出正常组10倍以上,达到糖尿病并发症联盟网站(AMDCC)所提出的DN动物模型建立标准;同时,模型小鼠出现肾脏肥大、胶原纤维增加、基底膜不均匀增厚、足突部分融合等病理改变。肾脏结构和功能检测结果均提示,糖尿病小鼠出现明显肾脏损伤,DN模型建立。BEZ治疗给药4周,明显改善DN小鼠肾脏结构和功能的受损,延缓DN小鼠的肾脏损伤。另外,给予BEZ治疗后,DN小鼠的FBG虽然有所降低,但仍远大于11.1 mmol·L-1的糖尿病诊断标准,提示BEZ虽然能一定程度降低血糖水平,但对血糖的控制不是其产生肾脏保护作用的根本原因。

Fig 4 Effect of bezafibrate on CYP4A protein expression of kidney (A) and 20-HETE levels in serum (B)
**P<0.01vsNC;##P<0.01vsDN4W
目前,对于BEZ作用的研究仍然主要集中于PPARs受体的激动,尤其是PPARα受体激动后对血脂异常及相关疾病的改善。本研究结果也显示,BEZ使DN小鼠肾脏组织PPARα、PPARβ和PPARγ蛋白表达均上调。现有研究发现,PPARs的作用可能与激活20-HETE有关[9-10]。20-HETE是AA CYP氧化酶途径代谢产物之一。AA代谢网络产生的生物活性物质具有重要的生理及病理作用,参与调节细胞分化增殖、凝血及纤溶系统动态平衡、体温及血压等相关过程。过去研究认为,AA主要经环氧酶途径和脂氧酶途径代谢,分别产生前列腺素及白三烯类物质,发挥其对炎症及代谢等的调控作用。近十余年研究发现,AA的“第三条代谢途径”——CYP氧化酶途径产物环氧二十碳三烯酸(epoxyeicosatrienoic acids,EETs)和20-HETE在正常生理状态的维持和病理过程的进展中也具有重要作用[8]。
20-HETE在肾脏高度表达[12]。在糖尿病的离体和整体模型,其肾脏的微粒体、近端肾小管上皮中CYP4A表达和20-HETE生成增加,抑制20-HETE的生成对DN有保护作用[13-14]。但也有相反的研究结果。在DN大鼠的肾脏及肾小球,CYP4A表达和20-HETE产生减少;给予内源性和外源性的20-HETE对肾小球通透性屏障有保护作用,减轻蛋白尿,延缓肾纤维化的进程[9,15]。本实验结果与后者一致,在高脂饮食联合STZ诱导DN模型,肾脏组织CYP4A表达下调,20-HETE产生减少。给予BEZ治疗4周后,糖尿病肾损伤改善同时,CYP4A上调,20-HETE增加。本实验结果提示,CYP4A-20-HETE的活化可能参与了BEZ对糖尿病肾损伤的保护作用。
综上所述,在本实验条件下,BEZ对DN小鼠的肾损伤有保护作用,该作用的发生可能与BEZ上调CYP4A表达,增加20-HETE含量有关。由于DN参与因素的复杂性和BEZ作用的广泛性,BEZ对DN保护作用的参与机制仍需要进行更深入研究。
(致谢:本文实验在重庆医科大学药学院生物化学与分子药理学重点实验室完成,特此致谢!)
