13-甲基十四烷酸对大鼠脑缺血后脑水肿的影响
2019-01-04陈世妹张文荣
冯 晓,陈世妹,张文荣
(1. 厦门大学附属第一医院思明分院大内科,福建 厦门 361000;2. 厦门市社会福利中心,福建 厦门 361000;3. 三明医学科技职业学院基础医学部,福建 三明 365000)
恶性脑缺血中风在脑血管疾病中以高死亡率(80%)和严重临床症状为特点,而缺血后脑水肿的形成使神经功能损伤加速恶化,颅内压升高,脑血流量减少,最终导致脑疝和病人死亡[1]。然而脑缺血后脑水肿发生的机制尚不十分清楚,因此,目前临床治疗仅限于对症处理。现有研究认为,脑缺血后脑水肿的发生机制有脑微循环障碍、脑能量代谢障碍、血脑屏障(blood brain barrier,BBB)障碍、自由基增加、钙超载、膜分子结构紊乱等学说。脑缺血后造成BBB 结构的完整性破坏,使其通透性增加,引发脑水肿,导致BBB进一步破坏,扩大脑梗死体积,造成严重的神经功能损伤,这是缺血性脑损伤的重要病理基础[2]。13-甲基十四烷酸(13-methyltetradecanoic acid, 13-MTD)是一种末端支链饱和脂肪酸,天然存在于细菌和某些真菌的细胞膜上,是细菌胞膜的重要成分[3]。13-MTD被首次发现存在于Bacillus subtilis菌属胞膜的脂肪酸组成成分中,有维持膜的流动性和膜功能作用。13-MTD作为细胞膜成分能嵌入膜脂质结构中,可通过调节膜的组成而影响细胞功能,在脂质双分子层中脂肪酸含量较高时,对哺乳动物细胞膜有膜稳定作用。然而,13-MTD对脑缺血后大鼠BBB是否也具有膜稳定作用,从而抑制脑缺血后脑水肿的形成,进而抑制大鼠脑缺血后神经功能损伤尚不清楚。本研究拟通过观察13-MTD对大鼠脑缺血后脑水肿的形成和BBB功能改变相关蛋白表达的影响,从水通道蛋白4(aquaporin 4,AQP4)角度探讨其机制。
1 材料与方法
1.1材料
1.1.1实验动物 Sprague-Dawley (SD)大鼠,♂,体质量230~270 g,购自上海斯莱克实验动物有限责任公司,动物合格证号:SCXK(沪)2007-0005。
1.1.2试剂 13-MTD由厦门大学药学院合成,浓度10 g·L-1,以脂质体包裹;伊文思蓝(Evan’s blue, EB),厦门泰京生物技术有限公司;2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazolium chloride,TTC),分析纯,上海化学试剂公司生产,用PBS配制成2% TTC工作液,4 ℃避光保存;AQP4多克隆抗体(H-19),Santa Cruz公司;SABC-羊抗兔IgG试剂盒,武汉博士德公司;引物由上海生工生物工程技术公司合成;TRIzol,Invitrogen公司;免疫组化试剂盒,福州迈新。
1.1.3仪器 光学显微镜及摄像系统(日本Olympus公司);LGR16-W型低温高速离心机(北京医用离心机厂);超低温冰箱(日本SANYO);酶标仪(美国Bio-Rad公司);凝胶成像分析系统(Syngene Genius公司);9700型PCR扩增仪(ABI公司)。
1.2制备大鼠大脑中动脉闭塞(middlecerebralarteryocclusion,MCAO)模型线栓法制备大鼠MCAO模型[4-5]。动物术前禁食12 h,自由饮水。10%水合氯醛0.3 mL·kg-1腹腔麻醉,仰卧固定后颈部酒精消毒,正中切口约3 cm,分离两侧甲状腺,暴露右侧胸锁乳突肌和胸骨舌骨肌间的三角区,钝性分离颈总动脉、颈内动脉及颈外动脉,并小心分离迷走神经。分离颈外动脉分支甲状腺上动脉,颈内动脉分支枕动脉,分别电凝。充分游离颈外动脉,将颈外动脉吊线,在距离颈总动脉分叉大约1 cm处结扎近心端,电凝远心端。用无创小动脉夹夹闭颈总动脉和颈内动脉远心端,将颈外动脉残端牵向外下方,使之与颈内动脉呈一条直线,在颈外动脉残端距颈总动脉分支约3 mm处剪一小口,将栓线自颈外动脉插入颈内动脉,将栓线与血管稍作结扎防止血液溢出,打开颈内动脉上的动脉夹,轻柔缓慢的将栓线向前推进约(18.5±0.5)mm(自分叉处计),遇阻力时即停止进线,再次将栓线与颈外动脉共同结扎以固定栓线,松开颈总动脉上的动脉夹,缝合切口。此时封闭了大脑中动脉(middle cerebral artery,MCA)开口,阻断了MCA的血流,制成MCAO模型。动物在手术中及手术后注意保温。模型成功的标志为,动物清醒后出现以左前肢为主的偏瘫和行走时的追尾症。
1.3实验设计与分组大鼠适应性喂养7 d后,随机分为假手术组(Sham)、空白脂质体对照组(Vehicle)、13-MTD 40、80、120 mg·kg-1组(M40、M80、M120)。按缺血时间分为6、12、24 h组,即Sham-6、12、24 h组,Veh-6、12、24 h组,M40-6、12、24 h组,M80-6、12、24 h组,M120-6、12、24 h组,每组5只。Sham组除不插入线栓,其它相同。插入栓线前30 min分别尾静脉注射脂质体包裹的13-MTD 40、80、120 mg·kg-1,Vehicle组给予等体积空白脂质体。各组大鼠均于相应缺血时间处死取材。
1.4神经功能缺失评分参照Longa等[6]建立的神经功能缺失评分标准,判断模型是否成功。0分:无明显神经缺损症状,活动正常;1分:垂直提起时不能完全伸展对侧前肢(轻度局灶性神经功能缺损);2分:行走时身体向偏瘫侧转圈(中度局灶性神经功能缺损);3分:行走时向偏瘫侧倾倒(重度局灶性神经功能缺损);4分:不能自发行走或有意识障碍。缺血术后评1~3分者为手术成功的标志,手术中出血过多的动物弃去。
1.5脑梗死体积测定于相应的缺血时间迅速断头取脑,将脑组织置于生理盐水冰盘上去除嗅球、小脑和低位脑干,冠状切片,每片厚约2 mm。切4刀,成5片。第1刀在脑前极与视交叉连线中点处;第2刀在视交叉部位;第3刀在漏斗柄部位;第4刀在漏斗柄与叶尾极之间。迅速将脑片置2% TTC磷酸盐缓冲液(pH 7.4)中避光染色,37 ℃温孵30 min,其间每隔7~8 min翻动1次。温孵完毕后,将脑片置10%福尔马林中避光保存过夜。将固定后的染色结果拍照输入计算机,利用AutoCAD图像处理软件求出梗死区域(白色)占大脑总体积的百分比(梗死灶体积不包括其周边的的缺血半暗带),以此作为统计参数。
1.6脑水肿测定
1.6.1AutoCAD软件测定脑水肿程度 于相应缺血时间,处死大鼠,迅速取出脑组织,切成等厚度的5片脑冠状切片拍照后输入计算机,利用图像处理软件AutoCAD,计算损伤侧脑水肿程度:脑水肿=(损伤侧脑半球体积-非损伤侧脑半球体积)/非损伤侧脑半球体积×100%[7]。
1.6.2脑干湿重测定脑含水量 于相应缺血时间,处死大鼠,迅速取出脑组织,切成等厚度的5片,准确称量湿重后,将脑片放入烤箱内110 ℃烤24 h,将脑片烤至恒重,取出称量脑片干重。公式:脑水肿=(湿重-干重)/ 湿重×100%[7]。
1.7脑组织EB含量测定BBB通透性EB是一种常用的脑血管通透性指示剂,正常情况下EB与血清白蛋白结合而不能通过BBB。BBB受损时,EB-白蛋白可通过内皮细胞的吞饮作用或经细胞间隙,从血管内进入脑组织。因此,通过计算脑组织EB的含量可以了解BBB的损伤程度。本实验观察MCAO各缺血时间点,各组大鼠脑组织EB的渗出情况,并计算其含量。于处死时间点,以10%水合氯醛半量麻醉动物后将线栓取出,从尾静脉注射2% EB 2 mL·kg-1,几秒钟后,大鼠眼球结膜、四肢等处显示蓝色,表示注入成功。用生理盐水250 mL从左心室灌注冲洗直至流出清亮液体,迅速断头取脑,在电子分析天平上称湿重,损伤侧置于装有3 mL甲酰胺的匀浆器进行匀浆,54 ℃水浴孵育24 h后,3 000 r·min-1离心30 min,取200 μL上清置于96孔板,用酶标仪(λ=630 nm)测定各组的光密度值。根据标准曲线,计算出EB含量,依据所测得浓度计算出BBB对EB的通透率,以每克湿重脑组织内所含EB的量(mg·kg-1)来表示。
1.8RT-PCR检测脑组织AQP4mRNA表达取冻存于-80 ℃冰箱的各组脑组织,取脑皮层处100 mg组织液氮研磨,TRIzol法提取总 RNA,TaKaRa公司PrimeScriptTM RT reagent Kit逆转录合成cDNA。AQP4引物:256 bp,上游引物:5′-AGAACCAAGGCGTAAACCG-3′,下游引物:5′-TCCCTGGAAATGACTGAGAAA-3′;β-actin:698 bp,上游引物:5′-ACCTCCAACACCCCAGCCATG-3′,下游引物:5′-CTGATCCACATCTGCTGGAAGGTGG-3′。取1 μL cDNA 进行 PCR 反应, 反应条件: 94 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,28个循环; 循环后均72 ℃终延伸7 min,4 ℃保存。PCR产物用2%琼脂凝胶电泳分析。电泳后在紫外灯下拍摄照片,用图像处理软件 Phoretix 1D分析目标条带的灰度值。
1.9免疫组化检测脑组织AQP4蛋白表达脑组织常规制备石蜡切片,58 ℃~60 ℃烤片1 h,二甲苯脱蜡,梯度乙醇水化,抗原修复,3% H2O2室温孵育10 min,PBS冲洗,正常山羊血清封闭10 min,一抗4 ℃过夜,PBS冲洗,加入二抗,37 ℃孵育10 min,PBS冲洗,加入SP复合物孵育10 min,PBS冲洗,DAB显色,苏木精复染,梯度乙醇脱水,中性树胶封片。使用同等对比度和曝光时间,在40×10倍普通显微镜下观察并拍照。
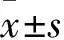
2 结果
2.113-MTD对大鼠脑缺血后神经功能的影响各组大鼠于脑缺血6、12、24 h时分别处死,并进行神经功能缺失评分比较。如Fig 1所示,Sham组评0分,不同缺血时间组均有不同程度的神经功能缺失症状,表现为右侧眼睑下垂,提尾悬空时左前肢内收及躯干向左侧扭转,运动时出现向左侧转圈式行走为追尾征,神经功能缺失严重时向左侧倾倒,各缺血时段神经功能评分有明显差异(P<0.05);与Vehicle组比较,13-MTD 40、80、120 mg·kg-1均可降低各缺血时段的神经功能缺失评分(P<0.05),且存在剂量依赖性(P<0.05),以M80组改善最为明显(P<0.05)。

Fig 1 Effect of 13-MTD on neurological deficit score in different groups after 6, 12 and 24 h MCAO in rats n=6)
#P<0.05vsvehicle;△P<0.05vsM40;▲P<0.05vsM120
2.213-MTD对大鼠脑缺血后脑梗死面积的影响如Fig 2所示,各缺血时间Sham组切片经2% TTC染色后脑片全红,色泽均匀;Vehicle组、缺血6 h损伤侧脑组织尚可色泽度,整体完整,切片经2% TTC染色后,缺血侧脑片可见皮层部分有白色梗死灶,缺血12 h组白色梗死灶明显,累及整个缺血侧的大脑皮层,缺血24 h组白色梗死灶最为明显,可累及到整个缺血侧脑半球,并伴有轻度的糜烂;13-MTD 40、80、120 mg·kg-1组损伤侧脑组织外观均有所改善,白色梗死灶范围均有所减少(P<0.05),尤其以M80组治疗效果最好(P<0.05),各剂量组间存在剂量依赖性(P<0.05)。
2.313-MTD对大鼠脑缺血后脑水肿的影响
2.3.113-MTD对大鼠脑缺血后脑组织体积的影响 如Fig 3所示,各缺血时间Sham组大脑体积均匀;Vehicle组两侧脑组织体积不均等,缺血侧脑组织体积稍大,与Sham组比较水肿明显(P<0.05);与Vehicle组相比, M40、M80、M120组脑组织水肿减轻(P<0.05),以M80组效果最好(P<0.05),各剂量组之间差异有显著性(P<0.05)。
2.3.213-MTD对大鼠脑缺血脑组织含水量的影响 如Fig 4所示,与Sham组比较,各缺血时间Vehicle组脑组织含水量明显增加(P<0.05)。与Vehicle组相比,M40、M80、M120组脑组织含水量均明显下降(P<0.05),并有量效差异,以M80组效果最好(P<0.05)。
2.413-MTD对大鼠脑缺血后BBB通透性的影响如Fig 5所示,与Sham组比较,各缺血时间Vehicle组可见明显的蓝色区域(P<0.01)。与Vehicle相比,M40、M80、M120组损伤脑EB渗出明显减少(P<0.05),以M80组效果最好,并有量效差异(P<0.05)。
2.513-MTD对大鼠脑缺血后AQP4表达的影响Fig 6的RT-PCR结果显示,脑缺血12 h后,Sham组有极少量的AQP4 mRNA表达,Vehicle组脑组织

Fig 2 Comparison effect of 13-MTD on infarct size in different groups after MCAO 6, 12 and 24 h in rats n=6)
#P<0.05vsvehicle;△P<0.05vsM40;▲P<0.05vsM120

Fig 3 Effect of 13-MTD on cerebral edema in different groups caused by cerebral ischemia after MCAO 6, 12 and 24 h in rats n=6)
#P<0.05vsvehicle;△P<0.05vsM40;▲P<0.05vsM120
AQP4 mRNA表达水平升高(P<0.05),M40、M80组均可使脑组织AQP4 mRNA表达降低(P<0.05),各剂量之间差异有显著性(P<0.05),以M80组效果最好。
Fig 7的免疫组化结果显示,脑内AQP4蛋白表达呈阳性的细胞,胞膜上呈均匀分布的棕黄色颗粒。

Fig 4 Effect of 13-MTD on dry and wet weight in different groups caused by cerebral ischemia after MCAO 6, 12 and 24 h in rats n=5)
*P<0.05vssham;#P<0.05vsvehicle;△P<0.05vsM40;▲P<0.05vsM120
AQP4蛋白主要表达于星形胶质细胞(astroglia,AST)胞膜上。Sham组有少量AQP4表达;Veh-6、12、24 h组AQP4表达升高;M80-6、12、24 h组AQP4蛋白表达下降。
3 讨论
脑缺血后脑水肿的发生主要涉及两个类型:细胞毒性脑水肿和血管源性脑水肿。细胞毒性脑水肿产生于脑缺氧或者是水中毒,脑细胞缺氧后能量代谢发生障碍,故不能维持细胞内外离子平衡,使水和离子进入细胞而产生脑水肿。细胞膜Na+的主动迁移过程依赖于Na+,K+-ATP酶(钠泵),对细胞容量起到维持作用,任何影响三磷酸腺苷(adenosine triphosphate, ATP)代谢的化合物都会导致钠泵的调节障碍,使Na+和水内流,细胞发生肿胀[8]。Ca2+稳态失衡也是细胞毒性脑水肿的重要原因,亦可使细胞肿胀和死亡,Ca2+浓度升高可激活磷脂酶类,促进膜磷脂的分解,使细胞膜及细胞器膜结构受损[9]。血管源性脑水肿主要是BBB受损,导致水分子由血管内向细胞外间隙移动,与血管通透性增高有关,水肿液为富含血浆蛋白的血浆滤液。其在白质是细胞外间隙扩大,在灰质则是细胞容积增大,细胞组分中变化最突出的是星形胶质细胞(AST),AST有明显的胞饮现象。过去认为中枢神经系统中信息的整合与传递是由神经元承担的,胶质细胞只是起到被动的辅助角色,但近来研究发现,AST在神经系统中不仅是支持、提供营养及代谢等作用,其在神经元的保护、BBB的形成、疼痛机制的调节过程中也发挥着积极作用,并参与免疫功能和神经干细胞功能[10]。脑缺血发生早期,缺血区域毛细血管内皮细胞和周围的AST、神经元开始肿胀,随着缺血时间延长,AST上的AQP4大量表达,使AST持续肿胀,并引起BBB的破坏和毛细血管通透性的增加[11-12]。脑缺血后脑水肿发生时,MAPK信号通路激活能够诱导AQP4表达[13]。研究发现,13-MTD可作为细胞膜成分嵌入膜脂质结构中,通过调节膜的组成而抑制MAPK信号激活[14]。

Fig 5 Effect of 13-MTD on EB in different groups caused by cerebral ischemia after MCAO 6, 12 and 24 h in rats n=6)
*P<0.05vssham; #P<0.05vsvehicle;△P<0.05vsM40;▲P<0.05vsM120

Fig 6 Change of ratio of AQP4/β-actin mRNA in different groups after MCAO 12h in rats n=6)
*P<0.001vssham;#P<0.01vsvehicle;△P<0.01vsM40

Fig 7 Comparison of expression of AQP4 protein in cerebral cortex detected by immunohistochemistry after MCAO 6, 12 and 24 h in rats (×400)
A : Sham-6 h; B: Veh-6 h; C: M80-6 h; D: Sham-12 h; E: Veh-12 h; F: M80-12 h; G: Sham-24 h; H: Veh-24 h; I: M80-24 h.
本实验采用MCAO模型复制大鼠局灶性脑缺血6、12、24 h,证实13-MTD 40、80、120 mg·kg-1尾静脉给药可明显减轻各时段MCAO后的脑损伤,以脑缺血12 h以内的保护作用最好,各时段均以M80组改善更好,13-MTD能够抑制大鼠脑缺血后脑水肿的形成。同时我们在实验中发现,13-MTD的保护作用与脑内AQP4表达相关。其机制可能与13-MTD抑制MAPK信号激活,进而下调脑内AST中AQP4基因和蛋白表达,改善细胞性脑水肿有关。
(致谢:感谢厦门大学药学院、实验动物中心和附属第一医院中心实验室提供的实验条件和技术支持!)
