微小核糖核酸与抗血小板药物反应异质性的相关研究进展
2018-12-26刘军尹彤
刘军,尹彤*
(1解放军总医院心血管内科,2国家老年疾病临床医学研究中心, 北京 100853)
血小板在血栓形成和延续的过程中发挥重要作用[1],血小板异常激活会导致一系列血栓风险事件发生,如脑卒中、心肌梗死等,而血小板功能异常还会导致严重出血。因此,抗血小板药物在心脑血管血栓性疾病的防治过程中发挥核心作用。目前,临床应用的抗血小板药物主要包括阿司匹林和P2Y12受体拮抗剂(如氯吡格雷、替格瑞洛)等。抗血小板药物是一把双刃剑,抗血栓不足会导致严重心脑血管缺血性事件发生, 抗血栓过度又会导致严重出血事件。研究发现,抗血栓不足和过度所导致的严重缺血和出血事件均会导致患者预后不良,并增加死亡事件的发生风险[2,3]。新型抗血小板药物(如P2Y12受体拮抗剂替格瑞洛)能够提供更快、更强有效的抗栓效果,但由于抗血小板反应性的个体差异,仍有近10%的高危患者因高血小板反应性发生严重的心血管事件[3,4]。因此,如何预测抗血小板药物的抗栓疗效,实现个性化抗血小板药物治疗,一直是心脑血管领域研究的热点和亟待解决的难题。
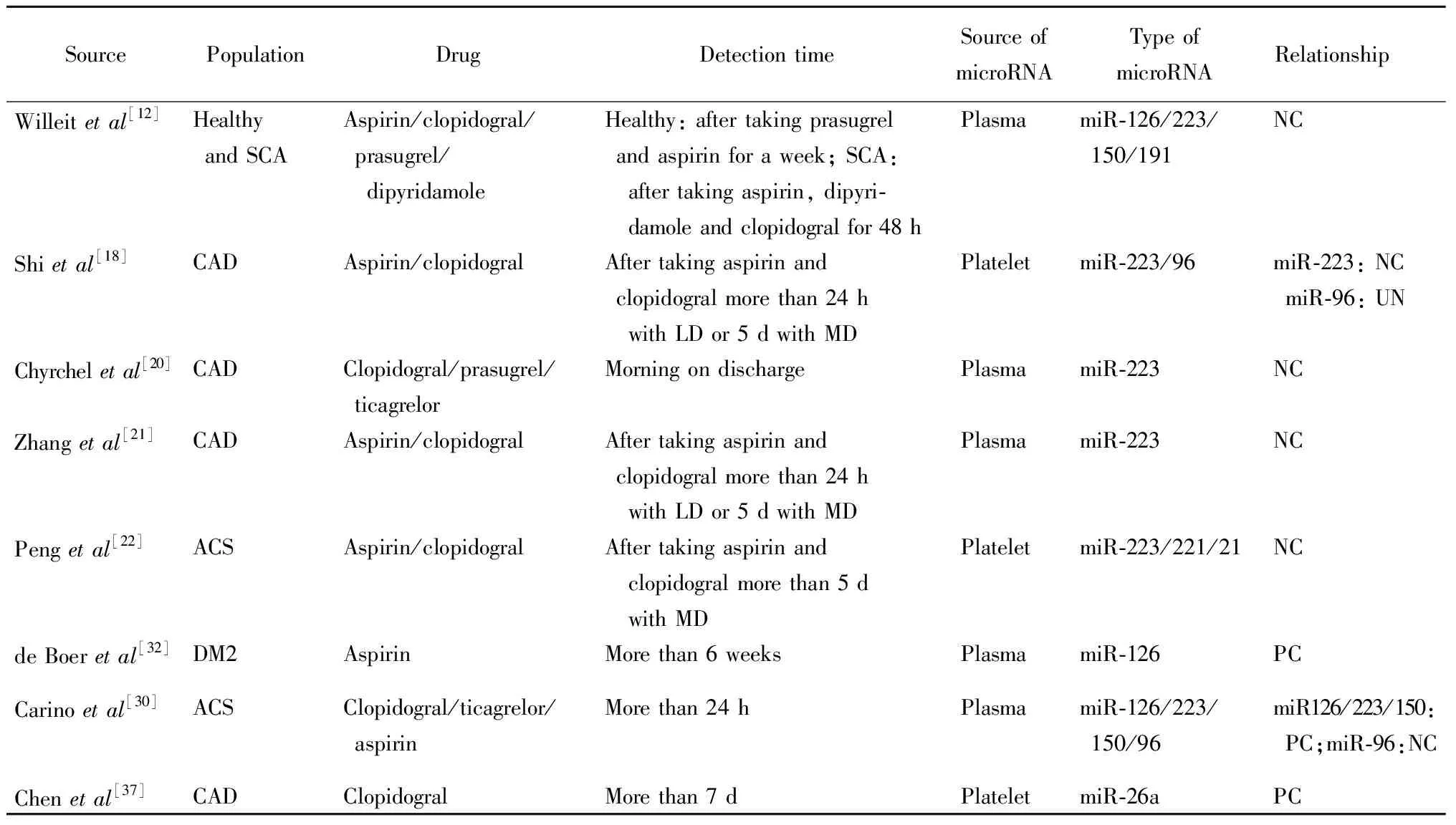
表1 血小板miRNA与抗血小板药物反应性相关研究
ACS: acute coronary syndrome; CHD: coronary heart disease; SCA: symptomatic atherosclerosis; CAD: coronary artery disease; DM2: type 2 diabetes mellitus; LD: loading dose; MD: maintaining dose; NC: negative correlation; UN: uncorrelated; PC: positive correlation
目前,临床应用的预测抗血小板反应性的方法主要包括血小板功能检测(如光密度比浊法、血栓弹力图等)和药物基因组学检测,但这些方法均有局限性,尚无法充分预测抗血小板药物反应性的差异。血小板是由巨核细胞胞质片段脱落而形成,尽管没有细胞核,但血小板中存在大量微粒,其中包括核糖核酸(ribonucleic acid,RNA)等物质[5,6],尤其是存在丰富的微小RNA(micro ribonucleic acid,microRNA)[7]。microRNA是非编码RNA家族中的一员,通过影响信使RNA(messenger ribonucleic acid,mRNA)的稳定性,负性调控mRNA转录,对信号通路和细胞间作用发挥调节功能。近年来多项研究显示,血小板microRNA与抗血小板药物反应性密切相关,其中包括能够调控P2Y12受体编码基因(P2RY12)表达的miR-223和miR-126,这为寻找能够预测抗血小板药物反应性个体差异的生物标志物提供了新的线索。鉴于此,本文将针对血小板microRNA与抗血小板药物反应性的相关性进行如下综述。
1 microRNA在血小板中的表达情况
microRNA在血小板中表达极为丰富,目前通过各类研究方法(包括芯片筛查、逆转录聚合酶链式反应等)发现人类血小板中约有250~375种microRNA[7,8]。而早在2011年,Nagalla等[8]对19名健康志愿者的外周血进行血小板提纯后,通过芯片分析发现,血小板中总共存在284种microRNA,其中以miR-223的含量最为丰富,其次为miR-126,miR-21,let-7f等,这与随后的几个研究结果一致[10]。这些microRNA在血小板中发挥着多种功能,包括血小板mRNA翻译和表达的调控、血小板反应性的生物标志物、成熟的巨核细胞microRNA水平的标志物等[9,11-13]。
2 血小板microRNA与抗血小板药物反应性的相关研究
自从2009年Landry等[7]首先报道了血小板中miR-223与血小板P2Y12受体通路相关后,一系列关于血小板microRNA与抗血小板药物反应性之间的关联性和潜在机制的研究开始问世(表1)。其中,miR-223和miR-126与P2Y12受体拮抗剂抗血小板反应性的相关性备受关注。
2.1 miR-223与抗血小板药物反应异质性的相关性及作用机制
miR-223是一类小的非编码RNA,其编码基因位于X染色体的Q12基因位点[14,15]。最初研究发现其在造血系统中发挥着重要作用[16],能够促进粒细胞分化和抑制红系细胞分化[15,17]。随后研究发现,在血小板和巨核细胞中其表达同样十分丰富,因此在血栓形成过程中可能具有重要的调控作用,其能靶向调控位于X染色体上的7个mRNA的表达,包括与编码腺苷二磷酸(adenosine diphosphate,ADP)受体P2Y12的mRNA 结合,抑制P2Y12受体表达[18,19]。
由于血小板中的miR-223-P2Y12 mRNA通路在血小板功能调控方面具有重要的作用[7],因此P2Y12受体及miR-223也成为临床研究的重要分子,特别是miR-223与血小板对P2Y12受体拮抗剂氯吡格雷反应性的相关研究较多。Willeit等[12]首次发现抗血小板治疗能够降低血小板源性microRNA的表达,他们通过对9名男性健康志愿者进行普拉格雷联合阿司匹林抗血小板药物干预,采用TaqMan定制探针,测定血浆中92种microRNA含量,结果发现,其中包括miR-223在内的8种microRNA发生显著变化。随后,作者选取了33例颈动脉粥样硬化患者,其中随机选取8例服用阿司匹林联合双嘧达莫,4例服用阿司匹林+氯吡格雷,其余单用阿司匹林。结果发现,随着抗血小板治疗的加强,血浆中血小板miR-223表达降低。国内Shi等[18]对冠心病患者血小板中microRNA与氯吡格雷抗血小板反应性的关系进行研究,他们选取了33例需行经皮冠状动脉介入术(percutaneous coronary intervention,PCI)治疗的冠心病患者,给予300 mg负荷剂量的氯吡格雷后,通过血小板反应指数和血小板聚集区别高血小板反应性和低血小板反应性。在提取血小板microRNA后,通过聚合酶链式反应(polymerase chain reaction,PCR)观察2组microRNA的表达差异,结果发现,低表达miR-223与氯吡格雷抗血小板反应性减低相关。随后的几项研究也同样证实,血小板miR-223的表达水平与抗血小板药物反应性相关。波兰亚捷隆大学开展的一项包括21例非ST段抬高急性冠脉综合征(acute coronary syndrome,ACS)患者血浆中miR-223表达情况的研究[20],以及后续一项包括62例不稳定心绞痛患者的研究进一步证实,miR-223具有独立预测氯吡格雷低反应性的能力,并且随着血小板抑制率增高其表达增加[21]。我们课题组前期研究还发现,在氯吡格雷低反应性ACS患者的血小板中,miR-223比高反应性组表达降低,但是上述相关性仅见于携带CYP2C19*2的患者中,提示miR-223对氯吡格雷抗血小板反应性的影响受氯吡格雷代谢相关基因CYP2C19的影响[22]。
前期研究证实,血小板P2Y12受体是miR-223的靶点之一,能够调节血小板功能(包括血小板聚集和颗粒分泌),且能被ADP激活,是一类G蛋白偶联受体。miR-223能够稳定地与人类P2Y12受体mRNA的3′非翻译区(untranslated region,UTR)端结合,并且血小板P2Y12受体mRNA能够与Ago2形成免疫共沉淀,miR-223还可调控P2Y12受体水平,进而影响血小板功能[7]。miR-223降低可能会促进P2Y12表达,增加血小板对ADP的敏感性。因此,血小板中miR-223的降低可用于预测P2Y12受体拮抗剂抗血小板的反应性[18]。如果在新生血小板中上调miR-223表达,将会减少ADP受体表达,从而维持血小板的稳定状态。而另一项动物实验显示,miR-223对血小板产生及其功能的影响并不明显[23]。Leierseder等[23]对miR-223基因敲除小鼠与野生型小鼠进行对比发现,二者血小板的数量、形态、寿命及血小板表面活性物质均无明显差异。血小板聚合度实验显示,敲除miR-223基因并没有对小鼠血凝块回缩速度、血小板聚集等产生影响。原因可能在于miR-223基因敲除小鼠的P2Y12受体编码基因P2RY12 mRNA的3′UTR端并没有miR-223的结合位点。前期研究显示,miR-223正是通过结合基因P2RY12 mRNA的3′UTR端,调控P2Y12受体表达,从而影响血小板活性。
miR-223还可能是通过其直接作用于凝血因子相关蛋白,进而导致血小板聚集和血栓风险增加,削弱抗血小板药物的反应性。在条件性敲除miR-223基因的小鼠中,凝血酶诱导的血小板聚集增加,大块稳定血栓形成,血块回缩时间延迟,血小板扩散增加,同时血小板之间或者血小板与白细胞之间会自发性聚集。蛋白组学分析显示,上述功能性改变与一系列蛋白表达增加相关,包括β1整合蛋白、kindlin-3以及凝血因子XⅢ-A。凝血因子XⅢ-A是miR-223的直接靶向结合物,参与维持纤维蛋白凝血块的稳定性,延迟血块回缩时间。在miR-223敲除小鼠中,血块回缩减弱,但用腐胺抑制凝血因子XⅢ-A后,血块回缩正常(图1)[24]。
总之,血小板miR-223能够通过靶向结合人类P2Y12受体mRNA的3′UTR端,或者与凝血相关蛋白结合而影响血小板的活性,其中,与P2Y12受体结合在血小板活化过程中发挥着重要作用,是多种抗血小板药物的作用靶点。因此,降低血小板miR-223的表达可能会引起P2Y12受体活性增加,进而引起血小板活性增加。推测降低血小板miR-223的表达可能会增加血栓疾病风险,如心肌梗死等。多项观察性研究也证实降低血小板miR-223的表达与P2Y12受体拮抗剂作用减弱相关。
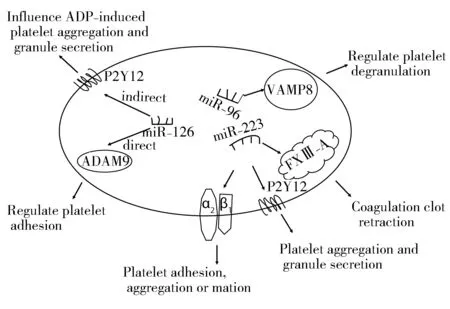
图1 血小板microRNA影响血小板反应性信号通路机制
2.2 miR-126与抗血小板药物反应异质性的相关性及作用机制
2002年,Lagos等[25]通过测序首次在小鼠的心脏中发现了miR-126。从动物到人类,miR-126序列非常保守,在脊椎动物中,miR-126来源于编码内皮细胞特异分泌肽的Egfl7基因的第7个内含子[26,27],可以调控新生血管内皮芽细胞的移动和定位[28]。miR-126具有内皮细胞特异性,在内皮细胞中表达异常丰富,对维持细胞完整性具有重要作用。但循环中的miR-126并不完全来源于内皮细胞。巨核细胞同样表达miR-126,而循环中的miR-126则更多来源于血小板[12,29]。
Willeit等[12]首次发现抗血小板治疗能够降低血小板源性microRNA的表达,其中包括miR-126。无论在健康人还是颈动脉粥样硬化患者中,随着抗血小板治疗的加强,血浆中血小板miR-126表达降低。Carino等[30]研究发现,将抗血小板治疗药物从氯吡格雷换成强效抗血小板药物替格瑞洛后,血浆中的miR-126表达水平下降。
一系列研究显示,血浆中血小板miR-126能够作为生物标志物预测PCI术后患者心血管不良事件的发生[31]。但是,由于抗血小板治疗能够降低血浆中miR-126的表达,因此在以血浆miR-126作为冠心病生物标志物时,应考虑血小板抑制剂如阿司匹林对其表达的影响[32]。
前期研究发现,在小鼠中抑制miR-126的表达能够降低花生四烯酸诱导的血小板聚集[12]。骨髓巨核细胞中含有丰富的miR-126,miR-126的过表达能够降低靶基因去整合素样金属蛋白酶9(A disintegrin and metalloproteinase domain 9,ADAM9)的表达,而ADAM9能够降低胶原诱导的血小板聚集[33]。上述研究证实,miR-126可能通过直接作用于ADAM9,导致血小板聚集功能改变,进而导致抗血小板药物反应异质性的发生。还有研究发现,在miR-126-3p敲除小鼠的全血中,P2Y12受体表达显著降低,由于P2Y12受体在血小板中的表达远远超过其在白细胞[34]和红细胞[35]中的表达,因此,miR-126还可能通过间接作用于P2Y12受体的表达,导致抗血小板药物反应的异质性(图1)。
总之,抗血小板治疗能够影响血浆中miR-126的表达水平,随着抗血小板强度的增加,miR-126的表达水平降低。同时,血浆miR-126还可作为心肌梗死及其他心血管不良事件的生物标志物,但是需要考虑抗血小板药物的影响。动物实验初步证实,miR-126对抗血小板药物反应异质性的影响机制可能与其对血小板靶基因ADAM9的直接作用和对P2Y12受体的间接作用有关,但是确切机制仍需进一步探索。
2.3 其他microRNA与抗血小板药物反应性的相关研究
除了miR-223和miR-126以外,血小板来源的其他microRNA也被证实能够与血小板活性相关基因相互作用,进而影响抗血小板药物的反应性。Kondkar等[36]研究证实,过表达miR-96能够通过靶向结合囊泡相关膜蛋白8(vesicle-associated membrane protein 8,VAMP8)-mRNA,抑制血小板活性,但在氯吡格雷治疗的冠心病患者中,并没有发现miR-96与抗血小板反应性相关[18]。Chen等[37]发现,血小板中过表达miR-26a与PCI术后患者氯吡格雷抵抗引起的高血小板反应性相关。Wang等[38]发现,miR-31能够通过抑制血小板活化过程中的重要分子信号血栓素A2(thromboxane A2,TBXA2)受体起到抗血小板作用。本课题组前期研究发现,在服用氯吡格雷抗血小板治疗的ACS患者中,高血小板反应性组血小板miR-221和miR-21的表达均显著低于低血小板反应性组,表明血小板microRNA的表达与ACS患者氯吡格雷抗血小板疗效相关[22]。Willeit等[12]研究发现,抗血小板药物能够影响miR-150和miR-191的表达。
3 展望
在生物学和病理生理学领域,人们对血小板microRNA重要性的认识正在逐渐增加,这为血小板microRNA的临床转化应用提供了重要的科学依据。越来越多的研究证实,microRNA的表达量能够反映循环中血小板的反应性。目前对血小板活性的评估主要基于血小板的体外活性检测,因此难以反应体内抗血小板药物的疗效。血小板microRNA表达水平的变化能够反应体内抗血小板药物的反应性,未来有必要深入探讨血小板microRNA指导下的个体化抗栓治疗是否能够改善临床预后。目前,microRNA仍需人工提取,因此有必要发展快速提取和监测microRNA的手段,加速microRNA的临床转化应用。除此之外,由于样本分离及样本组成会对microRNA的表达产生影响,因此,有必要对血小板microRNA的检测流程进行标准化。随着生物医疗技术的不断进步,相信将来有望通过对血小板microRNA的实时监测,实现对抗血小板药物的个体化选择和应用。
