PTEN、CPT1A、COX4在高原鼠兔脂代谢相关组织中的表达和意义※
2018-12-14白振忠格日力
李 佳,白振忠,格日力
(青海大学高原医学研究中心;青海省高原医学应用基础重点实验室;青海-犹他联合重点实验室,青海 西宁,810001)
高原土著动物具有良好的抵御外在环境压力的能力。本文将从与脂代谢和能量平衡相关的三种蛋白(PTEN、CPT1A和COX4)为着眼点,研究它们在白色脂肪(fat)、棕色脂肪(bfat)、肝脏(liver)和骨骼肌(muscle)的表达水平,从而探讨高原鼠兔在高原生存的策略及可能的适应机制。
1 资料与方法
1.1 一般资料
研究对象为同一时间在青海门源地区(海拔3250m)捕捉的高原鼠兔,雄性12只,雌性8只,平均体重为(133.245±12.816)g。排除体弱及寄生虫感染的实验个体。
1.2 实验方法
1.2.1 标本采集与处理:所有实验动物应用乌拉坦麻醉,下腔静脉采血后,断颈处死,分别取腹股沟区白色脂肪组织,肩胛区棕色脂肪组织,肝脏,比目鱼肌肌肉组织。所有组织置于-80 ℃低温保存,统一提取蛋白,用BCA试剂盒定量后备用。
1.3 统计学方法
本实验采用SPSS 24.0医学统计软件进行数据分析,结果以均数±标准差表示,不同组织间比较采用单因素方差分析,两两比较采用事后检验分析(boferroni检验),P<0.05表示差异有统计学意义。
2 结果
2.1 PTEN在四种组织中的表达
Western blotting结果显示,PTEN在高原鼠兔肝脏组织的表达明显高于其他组织,差异具有统计学意义。同时在肌肉组织中的表达最低(图1,表1)。
2.2 CPT1A在四种组织中的表达
蛋白电泳结果显示,CPT1A在肝脏和肌肉组织高表达,且在肝脏表达最高。与此同时,在两种脂肪组织中,发现其在棕色脂肪组织略有表达,但差异无统计学意义(图2,表1)。
2.3 COX4在四种组织中的表达
实验结果显示,COX4在肝脏、肌肉及棕色脂肪组织高表达,且在肝脏表达最高。在两种脂肪组织中,棕色脂肪组织的表达显著高于白色脂肪组织,差异有统计学意义。与此同时,我们发现COX4在四种组织中表达的趋势与CPT1A一致(图3,表1)。
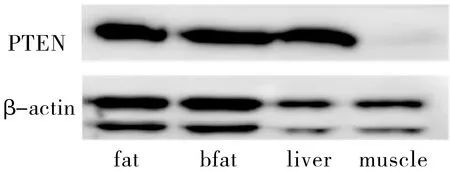
图1PTEN在高原鼠兔四种组织中的表达图
Figure1PTENexpressioninthefourkindsoftissueinPika
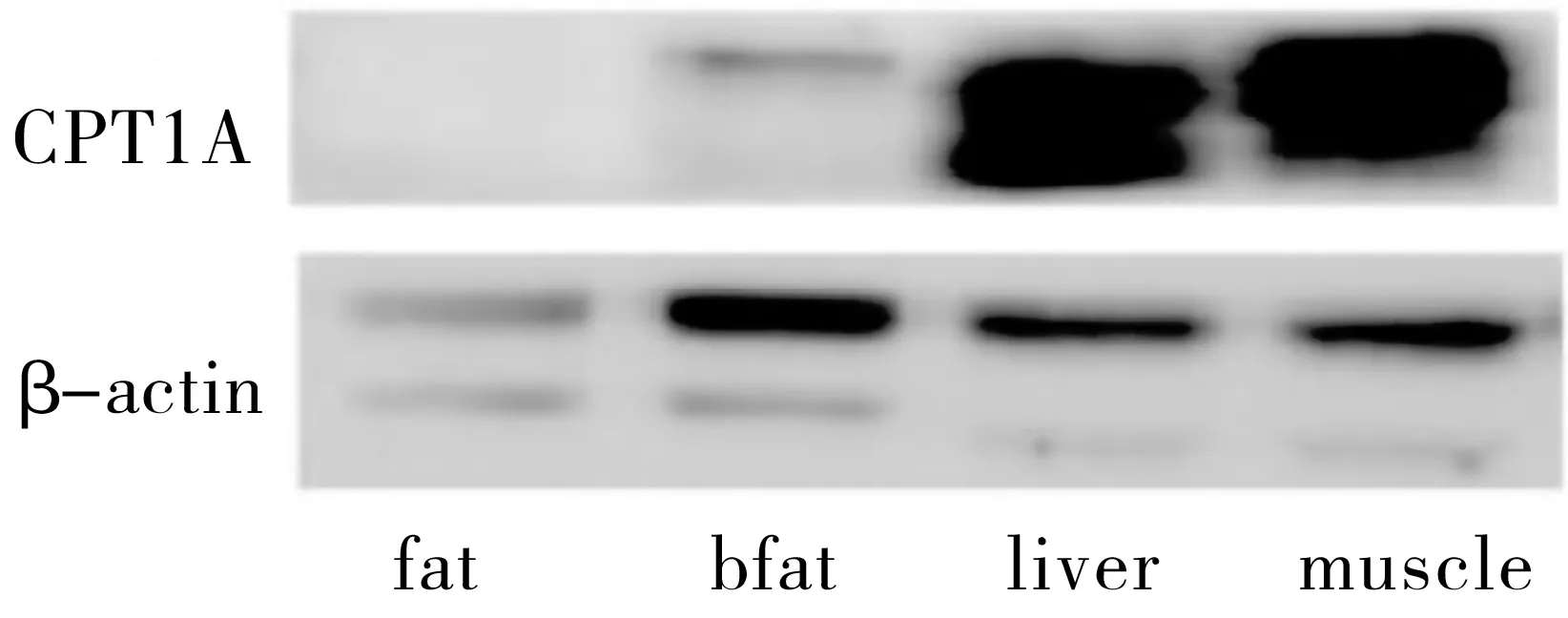
图2 CPT1A在高原鼠兔四种组织中的表达图

图3 COX4在高原鼠兔四种组织中的表达图

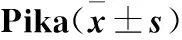
Table 1 PTEN, CPT1A and COX4 expression in the four kinds of tissue in
*:与fat比较P<0.05;#:与liver比较P<0.05;△:与bfat比较P<0.05.
3 讨论
第10号染色体缺失性磷酸酶及张力蛋白同源基因(phosphatase and tensin homolog deleted on chromosome ten,PTEN)在细胞生长、发育等方面发挥重要作用,其主要作用是抑制增殖和促进凋亡[1]。PTEN在机体组织和器官中广泛表达。近年来发现,PTEN基因多态性与脂代谢紊乱相关[2],可负性调节胰岛素信号,其上调可能导致胰岛素抵抗的发生[3]。作用机制可能是通过负向调节PI3K/Akt途径[4],并诱导细胞凋亡[5]。研究表明,特异性敲除小鼠PTEN基因可增加胰岛素敏感性。然而,可同时增加肝肿大、肝脂肪变、肿瘤的机率。本研究发现PTEN基因在高原鼠兔与胰岛素作用的靶器官广泛表达,但在肝脏组织表达最高,可能与其调节胰岛素以及脂肪酸合成有关。由于本研究的局限性,未做季节性比较,不能更加有效地探讨高原鼠兔面对高原极端环境挑战的不同策略和适应性改变。以往的研究证实PTEN基因受寒冷刺激后在脂代谢相关组织的表达下调。因此,需要更加完善的实验设计,进而从组织水平探讨高原土著物种的适应策略。
肉碱脂酰转移酶-1A(carnitine palmitoyltransferase 1A,CPT1A),是脂肪酸β氧化的限速酶[6,7]。CPT1A介导脂肪酸β氧化是通过将脂肪酸在细胞内的长链酯酰CoA催化为长链酯酰肉碱,继而转运进入线粒体,进行氧化供能。人类CPT1A主要在肝、肾、肺等组织中表达,且不同组织中CPT1A的活性不同,以肝脏最强。一项新的发现表明,CPT1A基因可促进细胞的运动性能[8],且长时耐力运动对CPT1基因表达具有重要影响,这可能是由于长时耐力训练的能量主要由脂肪酸氧化供给导致。高原鼠兔CPT1A基因在不同组织的表达差异可能与其所面临的高原极端环境有关,比如,在极端寒冷条件下捕食以及避免其他动物的猎杀等需要消耗过多的能量和体力。因此,CPT1A在高原鼠兔肝脏、骨骼肌组织表达较高,通过CPT1A脂肪酸氧化,从而及时补充能量。CPT1A在高原鼠兔与脂代谢及胰岛素相关的组织中广泛表达,且在不同组织中存在明显的差异,即在肝脏中表达最高,这一点与人类相一致。近年来的研究表明,CPT1A对脂肪细胞中游离脂肪酸诱导的胰岛素抵抗(IR)起保护作用[9]。CPT1A在肝脏中表达最高,可能由于肉碱主要在肝脏中合成,所以肉碱转移酶基因高表达。Gao等[10]研究表明,CPT1A表达上升可抑制JNK因子,从而阻断大量游离脂肪酸引起的IR效应及炎症反应,维持脂肪细胞的正常功能。同时,Bruce等[11]发现增强CPT1A活性或提高CPT1A表达量均可促进脂肪酸β氧化,从而间接增强胰岛素的活性,改善高脂饮食诱导的IR效应。一项在肥胖小鼠及瘦鼠的体内实验也表明,CPT1A表达增加,可显著降低肝脏甘油三酯的含量[12]。因此,通过提高CPT1A的表达加快脂肪酸氧化,可改善代谢紊乱、及时进行能量补给,从而调节机体能量代谢平衡。
线粒体是脂肪酸氧化、ATP合成的重要场所,细胞色素C氧化酶亚单位IV(cytochrome c oxidase subunit IV,COX4)是线粒体氧化呼吸的关键酶,对线粒体氧化磷酸化具有重要作用。COX4表达的增加为机体提供更多的热量,从而保持体温及维持能量代谢平衡。有研究表明,耐力运动可提高脂膳食大鼠趾长伸肌COX4mRNA表达。高原鼠兔在广阔的高原草场喜奔跑,通过这种方式进行捕食及避免天敌的猎杀。COX4在高原鼠兔肝脏、骨骼肌、棕色脂肪组织中高表达表明,高原鼠兔面临周围环境的挑战时主要通过线粒体氧化呼吸产热、供能,从而在低温环境下维持体温及保持能量平衡。一项针对高原鼠兔的研究表明,将其从高海拔转移至低海拔后,通过模拟高海拔环境,发现与对照组相比,其产热相关基因解偶联蛋白-1(UCP-1)、过氧化物酶体增殖-激活受体-1α (PGC-1α)表达明显增加,同时线粒体活性基因表达增加[13]。另一项研究表明,运动可激活PGC-1α的表达,促进线粒体增殖,改善线粒体代谢酶活性,证明COX4是PGC-1α介导的线粒体适应性改变的靶基因[14],运动可上调PGC-1α的表达,促进线粒体增殖,增加COX4的表达和活性,从而提高线粒体的功能。由此可见,高原鼠兔在应对高原高寒低氧环境挑战时,可能是通过增强线粒体活性及脂肪酸氧化,从而增加产热,补充能量,维持体温,避免低体温损伤。高原鼠兔COX4基因在脂代谢及胰岛素作用相关组织广泛表达,揭示高原特殊环境可能为脂代谢紊乱、胰岛素抵抗相关疾病提供潜在的治疗策略。
综上所述,PTEN 、CPT1A和COX4基因在高原鼠兔不同组织表达的差异,可能揭示高原这一土著物种面临高原特殊环境的策略与适应性改变,譬如高原鼠兔的瘦素(leptin)基因发生了适应性改变[15],从而更好地适应高原极端环境。PTEN在介导胰岛素通路所呈现的负向作用揭示,可通过下调或特异性敲除PTEN基因,从而改善脂代谢紊乱、胰岛素抵抗等代谢性疾病。CPT1A和COX4基因在高原鼠兔与代谢相关组织的表达水平相一致,揭示它们可能是高原鼠兔面临环境压力的对抗策略,或许它们的某些基因已经发生特异性改变,因此,需要更多的实验来验证这一假说。同时,CPT1A和COX4基因介导的脂肪酸β氧化和线粒体氧化呼吸作用,可能为代谢相关性疾病提供靶向治疗,从而减少肥胖、胰岛素抵抗、心血管疾病等的发生。
