人参二醇组皂苷保护内毒素血症小鼠肾脏的机制研究※
2018-12-12韩雨橦史文婷杜艳伟吕雪娇
付 双 宋 伍 韩雨橦 刘 芳 史文婷 杜艳伟* 吕雪娇 孟 艳
(1 长春中医药大学基础医学院病理教研室,吉林 长春 130117;2 吉林大学第二医院呼吸科,吉林 长春 130041)
脓毒症是德国和美国重症监护病房最常见的并发症之一[1-2],由于这种免疫学综合征的极端复杂性,死亡率仍居高不下。目前还没有这一免疫学综合征特征预测的生物标志物,因此也没有能够针对病人的免疫状态进行个体化治疗。有研究报道称,水通道蛋白 (AQPs)是调节脓毒症机制的关键,而被视为有希望的药物靶标或生物标志物[3]。AQPs参与的一些炎症过程,表明了它们在保护和应对不同的有害刺激(包括细菌感染)方面的新作用[4]。人参二醇组皂苷(Panaxadiol Saponin,PDS) 是人参茎和叶的提取物,大量的研究表明,人参二醇组皂苷(PDS)具有类似地塞米松的抗炎特性以及保护脂多糖(Lipopolysaccharide,LPS) 诱导的感染性休克大鼠的心肺功能[5-8]。内毒素血症导致肾小管功能障碍和尿渗透压发生改变,影响尿的浓缩。这时水通道蛋白发挥对尿浓缩的调节机制,调节尿素转运,排泄含氮废物,同时可能参与抗炎作用,从而保护肾脏。
本实验通过观察PDS对内毒素血症小鼠肾脏保护作用、炎症因子水平以及肾脏组织水通道AQP-1和AQP-2的表达情况,初步探讨PDS抗内毒素的可能机制。
1 材料与方法
1.1 实验动物 C57BL/6小鼠32只,雌雄小鼠各半,体质量18~22 g,购于中国科学院北京实验动物中心,由吉林大学实验动物中心SPF级动物饲养室繁殖与饲养。小鼠饲养于吉林大学实验动物中心,安置在一个12 h光照/黑暗周期的房间,保证房间温度为(22±2)℃,确保饲养环境恒温、恒湿、清洁,允许自由获取食物和水。
1.2 药物及试剂 人参二醇组皂苷(PDS)由吉林大学天然药物研究室提供的专利产品,专利号ZL98100070.3,使用时用生理盐水配制;地塞米松是临床用药,生产厂家为山东新华制药有限公司;LPS为Sigma公司产品;AQP抗体购于Abcam;其他常规化学试剂均为进口或国产分析纯产品。
1.3 造模及实验分组 32只C57BL/6小鼠,将它们随机分为4组(n=8):对照组、LPS组、PDS+LPS组和Dexa+LPS组。对照组经腹腔注射0.5 mL 0.9%氯化钠。LPS组、PDS+LPS组和Dexa+LPS组小鼠分别经腹腔注射LPS (10 mg/kg)[6-7]。PDS+LPS组和 Dexa+LPS组小鼠在LPS注射前1 h分别经腹腔注射PDS(25.0 mg/kg) 或地塞米松 (2.5mg/kg)[6-7]。
1.4 检测方法
1.4.1 生化指标检测 LPS注射12 h后,经戊巴比妥钠麻醉后,采用BL420仪器记录心率和平均动脉压,眼球采血处死动物。①称量小鼠体质量和肾脏重量,并计算肾脏系数;②收集血液,用于生化指标的检测;③取肾组织,其中一部分冻存,用于蛋白检测。血液尿素氮(BUN) 和肌酐(CREA) 试剂盒购于南京建成生物技术有限公司,检测步骤按照试剂盒说明书操作。
1.4.2 HE染色及免疫组织化学染色 肾脏组织经4%多聚甲醛固定,自动脱水,浸蜡,包埋,切片,常规HE染色。应用SABC法进行免疫组织化学染色,兔抗鼠AQP-1和AQP-2抗体浓度1∶500作为一抗。
2 结果
2.1 PDS对小鼠动脉血压和心率的影响 见表1,与LPS组相比,给予地塞米松后能够有效升高LPS处理后小鼠的血压和心率,同样,给予PDS后也可有效维持LPS处理后小鼠的血压和心率。
表1 PDS和Dexa对LPS处理小鼠平均动脉血压和心率的影响(,n=8)
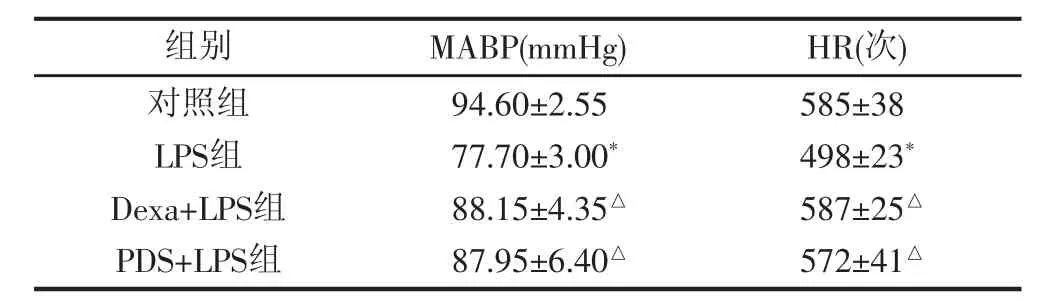
表1 PDS和Dexa对LPS处理小鼠平均动脉血压和心率的影响(,n=8)
注:与对照组比较,*P<0.05 ;与LPS组比较,△P<0.05
585±38 498±23*587±25△572±41△组别 MABP(mmHg) HR(次)对照组LPS组Dexa+LPS组PDS+LPS组94.60±2.55 77.70±3.00*88.15±4.35△87.95±6.40△
2.2 PDS对小鼠肾脏指数的影响 急性肾损伤模型复制成功12 h之后,处死小鼠,分离肾脏组织称重,计算肾脏指数。结果显示LPS组腹腔注射LPS(10 mg/kg)12 h后肾脏指数(0.0081±0.0010) 与对照组(0.0055±0.0008)相比显著增加(P<0.01),提示小鼠肾脏发生急性水肿。在模型复制前,给予PDS(25.0 mg/kg)和Dexa(2.5 mg/kg) 预处理,PDS+LPS组和Dexa+LPS组肾脏指数 (0.0060±0.0010)、(0.0064±0.0002) 均较LPS组明显减轻(P<0.05),说明PDS能够减轻肾脏水肿。见表2。
表2 PDS和Dexa对LPS处理小鼠肾脏系数的的影响(,n=8)
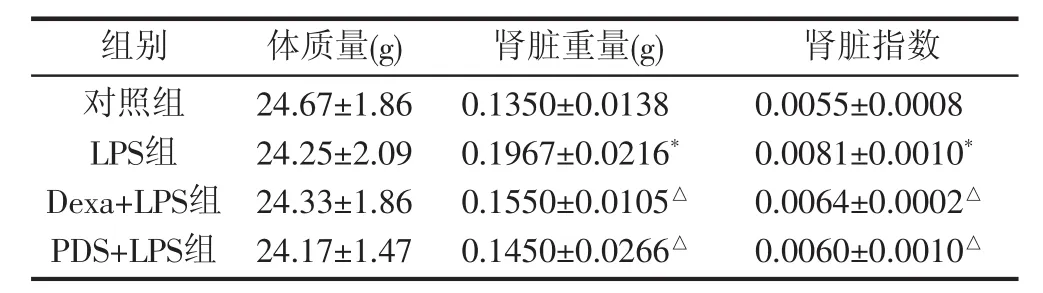
表2 PDS和Dexa对LPS处理小鼠肾脏系数的的影响(,n=8)
注:与对照组比较,*P<0.05 ;与LPS组比较,△P<0.05
组别 体质量(g)对照组LPS组Dexa+LPS组PDS+LPS组0.0055±0.0008 0.0081±0.0010*0.0064±0.0002△0.0060±0.0010△24.67±1.86 24.25±2.09 24.33±1.86 24.17±1.47肾脏重量(g) 肾脏指数0.1350±0.0138 0.1967±0.0216*0.1550±0.0105△0.1450±0.0266△
2.3 PDS对小鼠血清尿素氮和肌酐含量的影响 急性肾损伤模型复制成功12 h后处死小鼠,收集血清,经BUN试剂盒检测BUN的含量。血清BUN含量:对照组为 (13.18±3.05) mmol/L,LPS组为 (39.14±5.25) mmol/L,LPS组血清BUN含量显著高于对照组(P<0.01)。然而,PDS+LPS组的BUN含量 (26.47±5.55) mmol/L和Dexa+LPS组的BUN含量 (23.96±4.60) mmol/L均显著低于LPS组 (P<0.05)。血清的肌酐含量以LPS组为最高 (46.18±4.35)μmol/L,与对照组 (18.75±2.95) μmol/L比较差异显著 (P<0.01)。PDS+LPS组 (31.04±7.62) μmol/L和 Dexa+LPS组(28.58±6.05) μmol/L血清肌酐含量均明显低于LPS组(P<0.05)。见表3。
表3 PDS和Dexa对LPS处理小鼠血清尿素氮和肌酐含量的影响(,n=8)

表3 PDS和Dexa对LPS处理小鼠血清尿素氮和肌酐含量的影响(,n=8)
注:与对照组比较,**P<0.05 ;与LPS组比较,△P<0.05
组别 BUN(mmol/L)对照组LPS组Dexa+LPS组PDS+LPS组13.18±3.05 39.14±5.25**23.96±4.60△26.47±5.55△CREA(μmol/L)18.75±2.95 46.18±4.35**28.58±6.05△31.04±7.62△
本结果表明腹腔注射LPS 10 mg/kg 12 h成功地复制了LPS诱导的ARF小鼠动物模型。此外,PDS和地塞米松有类似的逆转LPS诱导的ARF肾功能的作用。
2.4 各组肾脏组织形态学变化 采用HE染色的方法观察肾脏组织形态学改变。通过光学显微镜观察,发现LPS组肾小管上皮细胞肿胀、变性、脱落,管腔缩小,管腔内有管型及渗出物,肾间质水肿,有少量炎细胞浸润,与 LPS组比较,PDS+LPS组及 Dexa+LPS组上述表现明显减轻(如图1)。提示注射 LPS(10 mg/kg)12 h后小鼠发生肾脏明显损伤,且PDS+LPS组和Dexa+LPS组肾脏损伤明显减轻。

图1 各组肾脏组织形态变化(200×)
2.5 PDS对小鼠血清TNF-α和IL-6产生与释放的作用 本实验主要检测了前炎症因子TNF-a、IL-6的含量,结果如表4所示,与对照组相比,LPS组血清TNF-α和IL-6的含量均显著增高(P<0.01)。然而,PDS组的TNF-α和IL-6含量与LPS组比较均明显降低(P<0.05),地塞米松组与LPS组比较TNF-α有下降趋势,IL-6显著降低(P<0.05)。说明PDS与地塞米松具有类似抑制NF-κB信号通路的作用,从而实现降低LPS注射后小鼠血清内前炎性因子TNF-α和IL-6的含量。
表4 PDS和Dexa对LPS处理小鼠血清TNF-α和IL-6含量的影响(,n=8,ng/L)

表4 PDS和Dexa对LPS处理小鼠血清TNF-α和IL-6含量的影响(,n=8,ng/L)
注:与对照组比较,**P<0.01 ;与LPS组比较,△P<0.05
组别 TNF-α对照组LPS组Dexa+LPS组PDS+LPS组71.45±5.15 112.37±10.61**80.45±8.77△91.12±6.01△IL-6 63.28±6.56 79.14±10.05 58.62±7.84△65.08±12.58
2.6 PDS对小鼠肾脏组织水通道表达的影响 采用免疫组化的方法检测内毒素血症小鼠肾脏组织AQP-1和AQP-2的表达。LPS组AQP-1表达明显少于对照组。而给予PDS或地塞米松时,AQP-1的表达明显高于LPS组,其中Dexa+LPS组增加明显,如图2所示,肾脏髓尖(400×)、髓质 (400×) 和皮质 (400×) AQP-1的表达情况。
相较于对照组LPS组AQP-2表达减少。而PDS+LPS组及Dexa+LPS组AQP-2的表达较LPS组增加,如图3所示,肾脏髓尖 (400×)、髓质 (400×) 和皮质(400×) AQP-2的表达情况。注射 LPS(10mg/kg) 12 h后小鼠肾脏功能障碍,PDS可以改善小鼠BUN和CREA水平,上述结果提示PDS的调控机制可能是通过调节肾脏组织AQP-1和AQP-2的表达实现的。

图2 各组肾脏组织AQP-1的表达(400×)

图3 各组肾脏组织AQP-2的表达(400×)
3 讨论
内毒素引起的脓毒血症主要机制是LPS介导信号转导,参与免疫防御和炎症损伤。通过Toll样受体4(TLR4) 引起核因子 kB(NF-κB)活化,并最终引起促炎症因子TNF-α,IL-6等为中心的激活,从而引发肾脏炎症反应[9]。有研究表明,内毒素血症小鼠肾脏功能障碍,严重的内毒素血症几乎接近急性肾衰竭状态,其中血清BUN和CREA含量明显增高[10],这与本实验中取得的结果相一致。内毒素血症所致的急性肾脏损伤病理特征为肾脏上皮和间质细胞水肿,组织间隙有炎细胞浸润,肾脏特征性改变主要是肾小管功能障碍,表现在肾脏对尿素的浓缩障碍[11]。
水通道蛋白参与尿浓度、体液平衡、大脑功能、腺体分泌等过程,其功能的缺陷与各种疾病状况和病理状态有关。目前已知的在哺乳动物中共有13个水通道,分布在大多数组织中。在肾脏组织中共有8种,其中AQP1-4在调节水的运输中起到重要作用,AQP2分布在集合管顶端膜,是抗利尿激素调节集合管对水通透的主要分子,在尿液浓缩中起关键作用。此外,最近研究表明AQPs参与一些炎症过程,表明了它们在保护和应对不同的有害刺激(包括细菌感染)方面的新作用[4]。文献报道AQPs参与了脓毒症的不同生理过程,脓毒症时肾脏的AQP2表达下调,并可导致肾功能衰竭[3],这与本实验中研究结果相一致。
在本研究中,给小鼠腹腔注射内毒素成功地复制了脓毒血症肾脏损伤动物模型,造成了炎症介质的大量释放和肾脏组织的损伤,从而引起肾脏间质水肿、血液BUN和CREA水平增加,组织AQP-1和AQP-2表达减弱。经PDS和Dexa治疗后,能够一定程度地抑制炎症介质TNF-α和IL-6的过度释放,上调AQP-1和AQP-2表达,明显改善了肾脏间质水肿程度及血液BUN和CREA水平。通过实验研究推测,PDS具有与Dexa相类似的作用,可以通过降低内毒素血症模型小鼠促炎因子的含量,升高肾脏组织AQP-1和AQP-2的表达,改善肾脏功能,从而有效防治内毒素血症肾脏损伤。
综上所述,人参二醇组皂苷具有类似地塞米松抗内毒素血症保护肾脏的作用,具体机制可能是通过降低炎症水平,调节肾脏水通道蛋白的表达,改善肾脏功能的机制,然而中药人参二醇皂苷的开发以及其作用机制需要进一步研究。
