激素处理后绵羔羊和成年母羊卵巢颗粒细胞miRNA特征分析
2018-12-11林嘉鹏吴阳升李晓林汪立芹刘明军黄俊成
林嘉鹏,吴阳升,韩 冰,李晓林,汪立芹,刘明军,黄俊成*
(1.农业部草食家畜遗传育种与繁殖重点开放实验室,新疆维吾尔自治区畜牧科学院生物技术研究所,新疆 乌鲁木齐 830000;2.石河子大学动物科技学院,新疆石河子 832003)
【研究意义】外源注射FSH早已用来诱导如绵羊[5],山羊[6]和马[7]等成年雌性动物的超数排卵。与传统胚胎移植相比,绵羔羊的体外胚胎生产技术具有广阔应用前景,能显著缩短世代间隔,提高生产效率。研究表明使用激素处理羔羊可以提高卵母细胞发育的能力进而提高幼畜超排的效率[8-10]。虽然以羔羊为供体可以得到大量的卵母细胞,但从性成熟前的动物收集卵母细胞显示出较低的发育能力和有限的利用效率[11]。在卵泡发育中,细胞分化是由多个基因调控,这些基因产物的相互作用可以调节颗粒细胞、卵泡膜细胞和卵母细胞的发育[12]。因此,从分子和细胞水平探究转录后羔羊和母羊卵泡差异基因的表达和调控将帮助我们了解卵泡的发育机制和影响因素。【前人研究进展】哺乳动物卵巢卵泡发育是一个高度复杂的生理过程,经历起始、募集、选择、优势化、排卵和黄体化等过程[1-2]。该过程受下丘脑-垂体-卵巢轴(HPG axis)内分泌激素调节系统控制,同时环境、光照等因素也可以调节促性腺激素释放激素(GnRH)从而影响卵泡的发育进程。垂体接收到GnRH的刺激而分泌促卵泡激素(FSH)、促黄体素(LH)等促性腺激素。FSH和LH在卵巢中共同促进卵泡的生长发育,并合成和释放雌激素和孕酮[3-4]。【本研究切入点】MicroRNAs(miRNAs)是一种高度保守的非编码小RNA,长度约为22个核苷酸。MicroRNAs的分子功能主要在转录后水平调节基因表达,通过与3’非翻译区(3’UTR)结合影响特定的目标mRNA[13]。这种相互作用可导致翻译抑制或目标mRNA的降解[14]。越来越多的证据表明,miRNA在多种生物学过程中发挥着重要的调节作用,包括细胞的增殖、分化、凋亡、代谢和雌二醇的生产等[15-16]。研究证实在不同的物种的卵巢和卵泡中,一些miRNAs可以影响卵巢及卵泡内分泌细胞的功能。目前,miRNA对绵羔羊和成年母羊超排后卵泡发育影响的相关机制仍不清楚,需要深入了解miRNAs在绵羊卵泡发育中的作用。【拟解决的关键问题】在本研究中,我们采用深度测序方法揭示羔羊和母羊激素处理后颗粒细胞miRNA表达模式的差异。通过生物信息学的方法进行识别和预测miRNA靶基因以及参与羔羊和母羊卵泡发育的潜在途径。
1 材料与方法
1.1 动物处理
9只1月龄健康新疆美利奴细毛羔羊(体重15~18 kg)和9只其对应的母亲(3~4岁,体重40~45 kg)选自新疆畜牧科学院绵羊繁育基地。每只羔羊分4次,间隔12 h,肌肉注射共160 IU FSH(宁波三生)。第4次注射FSH后12 h,将羔羊进行全身麻醉后手术摘除卵巢,记为LFF。每只成年母羊放置阴道海绵栓(记为第0天),分别在第10、11及12天,每天早晚2次共6次肌肉注射FSH,剂量每天依次递减,即每天分别注射100、80和60 IU,共240 IU(图1)。第6次注射FSH后12 h,手术摘除母羊两侧卵巢,记为EFF。所有实验均按照国卫生研究院和国家研究委员会实验动物使用指南执行。
1.2 卵泡颗粒细胞收集
用剪刀将卵巢周围结缔组织剪去,用含1%青、链霉素的PBS冲洗3次。根据有腔卵泡直径大小,选择血管壁清晰、透明和琥珀色的健康卵泡,用眼科剪和小镊子剥离3~4 mm完整卵泡。最后用镊子将卵泡撕开,让颗粒细胞分离到含1%青、链霉的PBS 中,用于后续 RNA 提取[17]。
1.3 总RNA的提取及质量控制
按照miRNAeasy(QIAGEN,Germany)试剂盒说明书提取颗粒细胞总RNA。对总RNA进行以下各项检测:用1%琼脂糖凝胶电泳检查RNA降解程度;用Nodrop 8000分光光度计(NanoDrop Technologies,USA)测定RNA浓度;用Agilent 2100生物分析仪(Agilent Technologies,USA)进行RNA完整性检测。
1.4 文库制备和miRNA测序

图1 羔羊和成年羊激素处理示意图Fig.1 A schematic of experimental protocol including the timing of treatments and the pictures of lambs’and ewes’ovary after FSH treatment
样品质量检测合格后,miRNA文库构建及高通量测序由北京诺禾致源生物信息有限公司完成。每3只羔羊和母羊的颗粒细胞总RNA分别混为一个样品池,每个样品取总 RNA做为起始原料来建miRNA文库。共2个miRNA库:FSH处理羔羊卵泡组和FSH处理母羊卵泡组,所有总 RNA的 RIN(RNA integrity number,RNA完整数)值都达到7~8。选取不同的index标签通过Illumina?(NEB,美国)建库,之后采用Illumina HiSeq 2500仪器进行深度测序得到50 bp的单端测序 reads。为了提高测序的质量,需要对原始序列去除其中的低质量reads,即缺乏3’的序列、5’污染的序列和小于18个核苷酸的序列。
1.5 保守和新miRNA的预测
通过高质量reads与NCBI中发表在miRBase 20.0(http://www.miRBase.org)中的前体 miRNA的绵羊基因组BLAST,以注释保守的miRNA,尽可能发现和去除样品中来源于它们的miRNA片段。
基于miRNA前体的标志性发夹结构相邻60 nt的基因组序列可以进行预测新的 miRNA。通过miREvo(http://evolution.sysu.edu.cn/software/mirevo.htm)和 mirdeep2这2款miRNA预测软件来进行 novel mi RNA 的分析[16-17]。
1.6 表达分析比较,靶向基因预测和功能分析
对所有miRNA与各类RNA的比对、注释情况进行总结。用TPM对reads数进行表达量归一化处理:(miRNA Read/Clear× Total Read Count)[18]。利用degseq包来检测之间差异表达的miRNAs库。2个样品池间的P<0.05和|log2ratio|≥1表明miRNA的表达水平是差异显著的。此外,根据已知的人类mRNA和miRNA之间的相互作用进行预测。
针对差异表达miRNA的靶基因进行GO(goseq)富集分析,对差异表达 miRNA与其靶基因的功能进行限定和描述,与P<0.05的显著富集。用KOBAS软件来进行 KEGG通路的富集分析。最后用IPA软件建立miRNA与其靶基因的相互作用网络图。
1.7 实时定量PCR
随机选5个miRNAs用实时定量PCR(qRTPCR,Roche LightCycler 480)验证。以1 ng miRNAs为模板,25 μl体系另外包括:Green qPCR SuperMix 12.5 ul,RNase-free H2O 9 μl ,上下游引物各 1 μl。PCR反应条件为:95℃预变性30 s;然后95℃ 5 s,引物特异Tm 15 min,55℃ 3 min,循环40次。熔解曲线分析:95℃ 1 min,55℃ 1 min,然后以0.5℃/10 s的速率从55℃缓慢递增到95℃。
2 结果与分析
2.1 miRNA深度测序数据分析
分别从羔羊和母羊的miRNA文库中获得6602564和8539915 reads。去除低质量的数据后,共6467661和8366926条纯净序列(clean reads)被用于进一步的分析(表1)。这些纯净序列大多数对应长度为21~24个核苷酸(图2)。在羔羊和成年羊的文库中,纯净的miRNA(22 nt)分别占32.7%和32.8%。读取相应的RNAs发现很多长度为31和33 nt的RNA,可能与PIWI蛋白质相互作用的RNA(piRNA),这是一种继miRNA之后在大鼠睾丸[20]和绵羊卵巢[21]中发现的一类起调控作用的单链RNA。

表1 测序数据过滤情况Table 1 The filtering of sequencing data

图2 Small RNA长度分布Fig.2 The length of RNA sequencing data
2.2 保守的和新的miRNA的识别
从2个miRNA库获得保守miRNA,与miRBase中已注释的pre-RNA和成熟miRNA进行比对。共有238个已知的miRNA和92个新的miRNA,这些新的miRNA也可能是由于绵羊miRNA数据库数据不全导致的。表2中列出表达量较高的miRNA序列。
2.3 羔羊和母羊的miRNA之间的比较分析
共出现9个差异性显著的miRNAs,其中4个新的miRNA(图3)。由表3所示,在其他5个已知的miRNA,羔羊中oar-miR-106a相比母羊上调超过1.5倍。在下调的miRNA中,相比母羊,羔羊oar-miR-10a显著下降2.2倍。oar-miR-150、oar-miR-136和miR-143 的表达也降低,分别为 1.22-fold、1.19-fold和 1.17-fold,见表 3。

表2 高丰度表达的miRNAsTable 2 The most abundantly expressed miRNAs
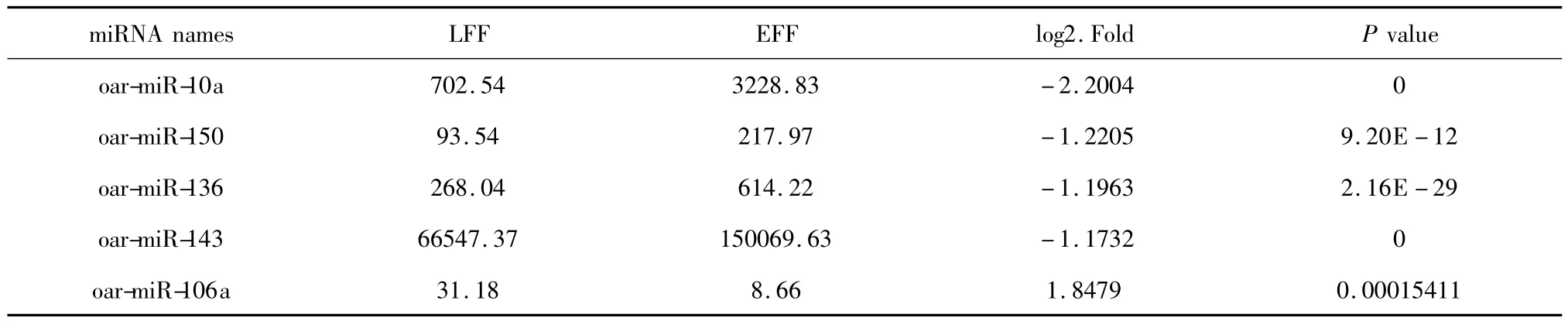
表3 羔羊和成年羊差异表达miRNAsTable 3 Differentially expressed miRNAs among lamb and ewe

图3 差异表达miRNA散点图Fig.3 The Scatter chart of differences of miRNAs

图4 部分靶基因GO富集分析Fig.4 Part GO classification annotated for the predicted target genes.
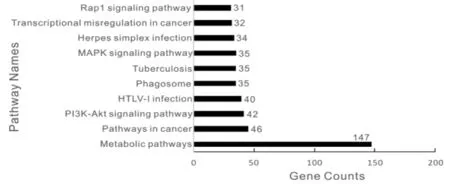
图5 部分靶基因KEGG通路Fig.5 Part KEGG passway annotated for the predicted target genes
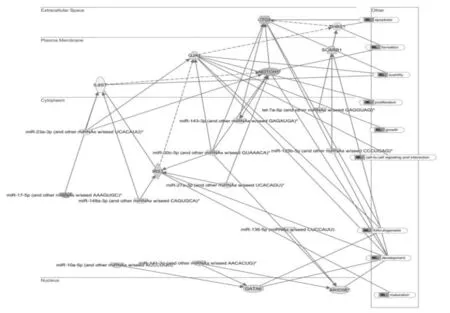
图6 miRNA与靶基因互作关系网络图Fig.6 Network pathway analysis of miRNA and their targets gene
预测2688个获取的基因,可能涉及271个信号通路可能调节这9个miRNAs差异表达。GO富集分析显示这些miRNAs的靶基因作用集中在调节代谢过程、细胞组分和催化活性(如图4所示)。
KEGG通路分析显示,包括细胞增殖(MAPK信号通路,Wnt信号通路和细胞周期),细胞存活(TGF-β信号通路),细胞粘附(轴突导向和缝隙连接),代谢(GnRH和胰岛素信号通路)和发生等通路(图5)。
了解差异表达的miRNA及其靶基因的生物学功能,笔者应用IPA分析其和人类基因之间可能的相互作用,揭示目标miRNAs和靶向基因之间的关系。为了了解这些靶基因影响颗粒细胞的机制,笔者将它们映射到分子网络(图6)。在这个调控网络中,Notch1,IL6ST和IRS1可确定为主要节点。其他还有与细胞周期和细胞凋亡、cAMP介导的信号转导、G-蛋白偶联受体信号转导、细胞间信号传导以及示踪和血管生成发生相关网络。

图7 miRNAs qRT-PCR验证Fig.7 The results of the miRNA qRT-PCR
3.4 差异miRNA qRT-PCR验证
随机抽取的5个 miRNA(miR-106a,miR-10a、miR-143、miR-136和miR-150),采用 qRT-PCR 验证在羔羊和母羊颗粒细胞中表达水平。结果表明,oar-miR-10a,oar-miR-136,oar-miR-143和 oar-miR-150在颗粒细胞中表达上调,oar-miR-106a在颗粒细胞中表达上调的。这个结果与测序结果一致(图7)。
3 讨论
卵泡生成和发育是一个复杂的过程,涉及不同的卵巢组织,如卵母细胞、颗粒细胞、膜细胞以及卵泡液。在各种组织,如卵巢和睾丸、卵泡-黄体以及颗粒细胞和膜细胞中[23],基因的表达受miRNA的调节。因此,这些miRNA调控的基因可能导致羔羊和成年羊之间的表达差异。卵母细胞与体细胞(颗粒细胞和膜细胞)间的信号转导通路会影响激素分泌和卵泡发育相关基因的表达[2-3]。本研究使用Illumina测序平台研究激素处理后羔羊和成年母羊卵巢颗粒细胞的miRNA特征和表达模式,获得了9个差异表达的miRNA。
在羔羊和成年羊激素处理后我们收集处于相同发育阶段的卵泡(3~4 mm)中的颗粒细胞。经small RNA测序分析,获得了238个成熟的miRNA。其中9个(包括4个新的)miRNA在二者之间差异表达。说明这9个差异表达miRNAs可能与羔羊和成年羊卵泡发育的差异有相关性。这与Ling等在山羊卵巢中的研究结果相似[24]。
在获得的238个成熟miRNA中,oar-miR-148a和oar-miR-21是表达丰度最高的2个miRNA。同时,let-7 miRNA家族中,let-7f表达量最高。研究表明,miR-148a在鸡卵巢卵泡和性腺中高表达[23],miR-21的表达在FSH处理后大鼠颗粒细胞中上调[14]。同时这2个miRNA的表达水平在绵羊卵泡和黄体中发生动态改变。而本研究中,oar-miR-148a(0.04)和 oar-miR-21(0.09)在成年羊和羔羊中表达量没有显著差异。let-7 miRNA家族被研究最多的肿瘤功能抑制因子,在牛和小鼠卵巢及睾丸中高表达,能促进体体外培养猪颗粒细胞的调亡[22]。这些miRNAs可能在雌性生殖生理中起着重要的作用。
KEGG通路分析表明:差异表达miRNAs的一些靶基因富集繁殖相关的途径,如新陈代谢途径、PI3K/Akt、MAPK、TGF-β 等经典信号通路,以及细胞周期和卵母细胞的减数分裂等。PI3K/Akt通路是受FSH调控的一个关键的信号转导通路。同时Akt能靶向基因发挥作用,包括FoxO3a,而FoxO3a认为可能是oar-miR-10a的靶基因[24]。两组明显表达可能在卵泡和卵母细胞发育产生的差异。在羔羊和成年羊颗粒细胞组中,oar-miR-10a存在明显差异,表明其可能在两者的卵泡和卵母细胞发育中有重要作用。
成年羊颗粒细胞中,oar-miR-10a表达量是羔羊的2倍。通过前体刺激miR-10a转染人颗粒细胞后,细胞凋亡相关因子Cyclin B1的表达量显著减少[25]。这表明miR-10a可与颗粒细胞增殖相关。
我们用IPA绘制miRNA与其靶基因的互作网络图发现,清道夫受体B家族成员1(SCARB1)可能是oar-miR-125b和let-7a的靶向基因。SCARB1作为高密度脂蛋白受体已被证实在人卵巢颗粒细胞中表达。女性血浆中雌二醇浓度低和受精卵数目减少时,SCARB1表达量也相应降低。Miles等认为let-7和miR-106a在牛卵母细胞发育中可能有重要作用,miR-106a 可能降低 WEE1A mRNA.的表达水平[26]。因此,oar-miR-106a可能在调节雌性羔羊卵母细胞mRNA中发挥作用,还需要进一步的研究证实(图6)。
4 结论
本研究首次综合分析了激素处理羔羊和成年母羊3~4 mm卵泡颗粒细胞miRNA表达谱,共鉴定出238个已知的miRNA和92个新的miRNA,其中有9个miRNA羔羊和其对应母羊差异表达的miRNA。对2个文库中所有miRNAs的靶基因的分析表明,新陈代谢途径富集的靶基因最多。我们的研究结果将有助于了解miRNAs调控卵泡发育过程,为人工改造这些miRNA进一步影响绵羔羊卵巢和卵泡生长发育提供理论依据。
