黄酒对便秘模型小鼠通便及肠道菌群的影响
2018-12-07王丽媛王晶波霍军生丁钢强
王丽媛,秦 文,李 岩,卓 勤,孙 静,王晶波,杨 倬,黄 建,沈 葹,霍军生,丁钢强*
(中国疾病预防控制中心 营养与健康所,北京 100050)
黄酒是我国最古老的酒种,在中国乃至世界酒文化历史上都占有重要的一席。作为我国最有发展前途的酒种之一,黄酒的功效已被大众熟知并广泛应用。古今中外已有诸多记载,如《汉书·食货志》中记载:“酒,百药之长”;《本草纲目》记载:“诸酒醇不同,唯米酒入药用”。米酒即指黄酒,具有通曲脉、厚肠胃、润皮肤、养脾气、扶肝、除风下气等治疗作用[1]。
随着研究的深入,越来越多的结果显示黄酒在抗氧化、抗衰老以及代谢、免疫调节等方面具有良好功效[2],这与黄酒中所含有的矿物质、维生素、活性肽、糖类尤其是低聚糖密切相关[3]。功能性低聚糖是在黄酒酿造过程中曲麦微生物酶的作用下产生的[4],具有低甜度和低热量的特点,被人们称为“膳食纤维”。已有研究表明,功能性低聚糖具有促进营养元素的吸收利用及改善便秘等功效[5],在人体胃中能抵抗胃酸的分解和α-淀粉酶的水解,具有较好的稳定性,能够进入肠道发挥益生元的作用[6],而黄酒对便秘症状的改善作用研究较少。本实验意在研究黄酒对小鼠通便功能作用,以及对便秘小鼠肠道菌群的影响。
1 材料与方法
1.1 材料与试剂
健康雄性BALB/c小鼠共100只(无特定病原体(specific pathogenfree,SPF)级,体质量18~22g,[生产许可证:SCXK(京)2014-0006]):购于斯贝福(北京)生物技术有限公司;动物饲养于中国疾病预防控制中心南纬路动物实验室,许可证号SYXK(京)2009-0032,室温20~26℃,相对湿度40%~70%,12 h光照,12 h黑暗。动物实验已通过中国疾病预防控制中心营养与健康所伦理审查。
受试样品:市售黄酒,标示酒精度为15.0%vol。
药物及试剂:盐酸洛哌丁胺胶囊(每粒含盐酸洛哌丁胺2 mg,国药准字H10910085):西安杨森制药有限公司;阿拉伯树胶:国药集团化学试剂有限公司;活性炭粉、墨汁的配制:准确称取阿拉伯树胶10 g,加水80 mL,煮沸至溶液透明,称取活性炭5 g加至上述溶液中煮沸3次,待溶液冷却后加水定容至100 mL,于4℃保存备用,用前摇匀。0.5%盐酸洛哌丁胺混悬液的配制:取盐酸洛哌丁胺50mg(25粒),加水至10 mL;1%盐酸洛哌丁胺混悬液的配制:取盐酸洛哌丁胺100 mg(50粒),加水至10 mL。均临用前配制。
1.2 仪器与设备
RV10 V-C旋转蒸发仪:德国IKA公司;ME403E天平:瑞士梅特勒公司;AC2-4S1生物安全柜:新加坡ESCO公司;5427R高速冷冻离心机:德国EPPENDRF公司;Illumina HiSe2500测序仪:美国Illumina公司;NANO DROP紫外分光光度计:美国Thermo公司。
1.3 方法
1.3.1 小肠墨汁推进率实验
健康雄性BALB/c小鼠共50只,适应性饲养3 d,按体质量随机分为空白对照组、模型对照组、低剂量组、中剂量组和高剂量组,每组各10只。人体推荐量的10倍为中剂量组,另设5倍低剂量组和30倍高剂量组。按照《中国居民膳食指南》2016新版建议男性每日饮酒的酒精量不超过25 g为参照,标准人体质量60 kg计算,人体每日饮酒量为100 mL,低剂量组=8.3mL/(kg·BW)、中剂量组=16.6mL/(kg·BW)、高剂量组=50mL/(kg·BW)。将黄酒进行浓缩,用15%vol酒基按比例进行调配。高、中、低剂量组灌胃受试样品,空白对照组和模型对照组给予蒸馏水,灌胃体积0.2mL/(10g·BW)。连续灌胃15 d后,各组小鼠禁食不禁水24 h。除空白对照组外,其他各组以0.5%盐酸洛派丁胺混悬液,按末次称质量对应的灌胃量给予灌胃,空白组灌胃蒸馏水。30 min后以0.4 mL每只给予各组小鼠墨汁灌胃,25 min后立即脱颈椎处死,解剖分离肠系膜,剪取上端自幽门、下端至回盲部的肠管,轻拉成直线,测量小肠总长度及墨汁推进最前端长度,计算小肠墨汁推进率。
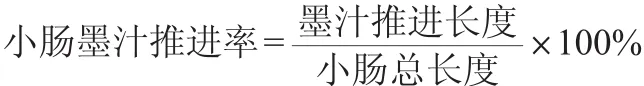
1.3.2 排便时间及粪便质量实验
另50只健康雄性BALB/c小鼠,实验方法同小肠推进率实验。便秘药物为1%盐酸洛派丁胺混悬液。小鼠墨汁灌胃后,动物均单笼饲养,正常饮水进食。从灌墨汁开始,记录每只动物首粒排黑便时间及5 h内排黑便的质量。
1.3.3 肠道菌群分析
无菌环境下收集排便实验组所有动物的新鲜粪便,封装后冻存于-80℃冰箱进行DNA提取与分析。小鼠粪便DNA提取采用华大基因自行研发试剂盒,使用通用引物515F(5'-GTGCCAGCMGCCGCGGTAA-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')对16SrDNA的V4区进行PCR扩增。
应用Illumina HiSe2500平台对PCR产物进行测序,测序类型为PE250。下机数据滤除低质量的reads,获得clean data。序列拼接使用软件FLASH(Fast Length Adjustment of Shortreads,v1.2.11),将双末端测序得到的reads拼接成Tags,利用软件USEARCH(v7.0.1090)将优化好的Tags在97%的相似度下聚类为分类操作单元(operational taxonomic units,OTU),用于物种注释及物种复杂度分析以及组间物种α-多样性分析。
1.3.4 统计学方法
数据分析采用软件SPSS16.0处理,各组以变异数ANOVA进行比较分析,数据以x¯±s表示,P≥0.05无显著差异,0.01≤P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 黄酒对小鼠体质量的影响
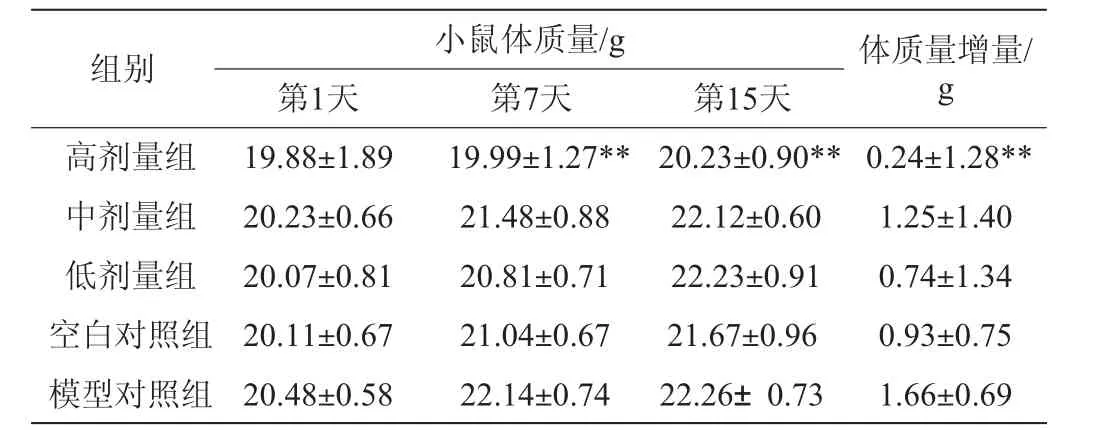
表1 小肠墨汁推进率实验各组小鼠体质量检测结果Table 1 Determination results of body mass of mice in the ink propelling rates experimental group
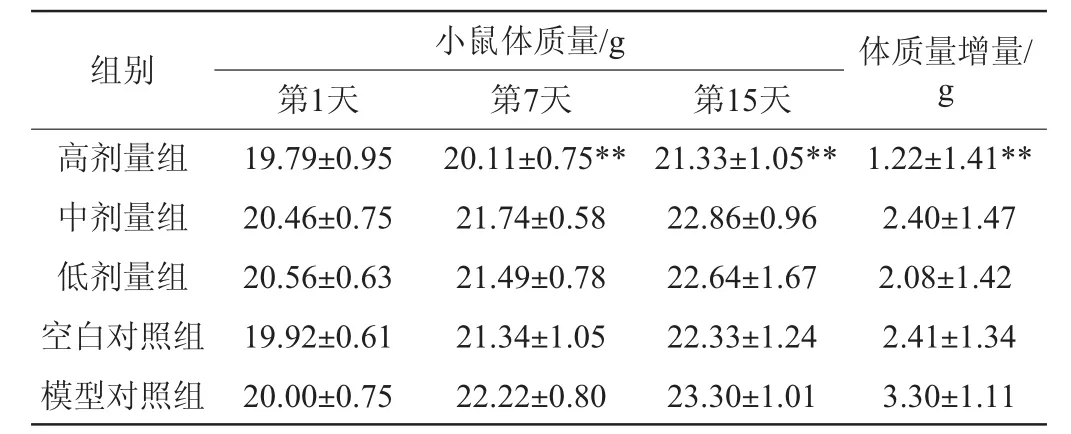
表2 排便实验各组小鼠体质量的检测结果Table 2 Determination results of body mass of mice in defecation experimental group
由表1、表2可知,在小肠推进率和排便两组实验开始前,各组实验动物体质量没有显著差异(P≥0.05)。15 d的灌胃过程中,高剂量组小鼠的体质量增长缓慢,在第7天和第15天小鼠体质量与模型对照组相比差异极显著(P<0.01)。实验结束后,高剂量组与模型组小鼠体质量增量差异极显著(P<0.01)。在实验过程中,各组小鼠均保持正常进食进水,毛色正常,精神状态良好。
2.2 黄酒对便秘小鼠小肠墨汁推进率的影响
采用盐酸洛派丁胺为便秘诱导剂,通过抑制肠道水分泌[7]和结肠蠕动[8]建立便秘模型。表3结果显示,便秘模型对照组小肠推进率与空白对照组差异极显著(P<0.01),表明小肠推进实验中便秘模型建立成功。经统计分析,高、中、低三个剂量组与便秘模型组差异不显著(P≥0.05)。未见黄酒对便秘小鼠小肠蠕动有明显促进作用。
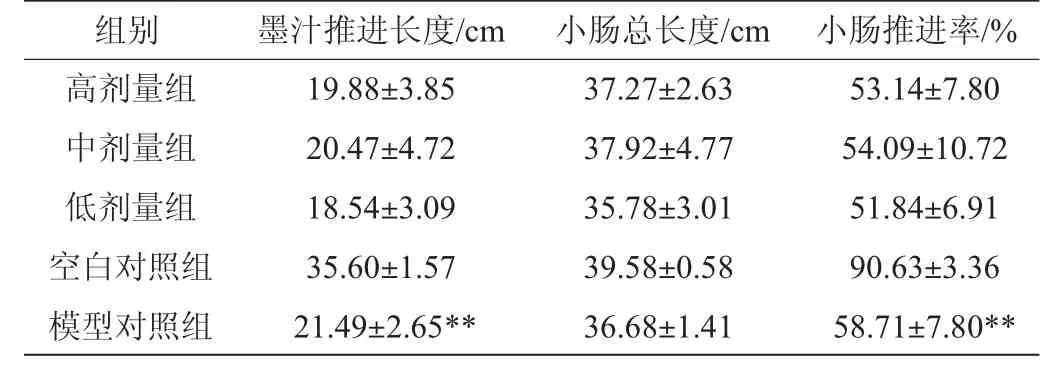
表3 各组小鼠小肠墨汁推进率的检测结果Table 3 Determination results of the ink propelling rates of different groups of mice
2.3 黄酒对便秘小鼠首粒排黑便时间和粪便质量的影响
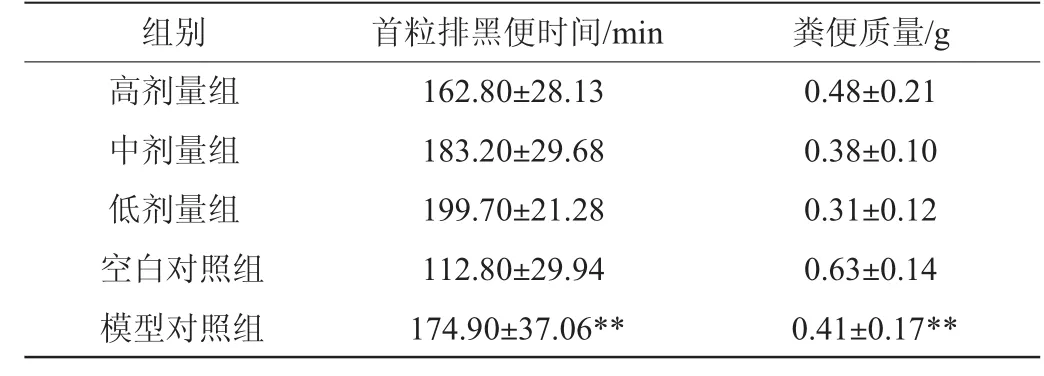
表4 各组小鼠首粒黑便排出时间和粪便质量的检测结果Table 4 Determination results of the time of discharge of the first black feces and fecalmass of different groups of mice
表4结果显示,模型对照组与空白对照组相比,首粒排黑便时间和粪便质量差异极显著(P<0.01),表明便秘模型建立成功。高、中、低剂量组与模型对照组之间差异不显著(P≥0.05),表明黄酒没有明显通便功能作用。
2.4 黄酒对便秘小鼠肠道菌群的影响
2.4.1 各试验组小鼠肠道菌群多样性分析
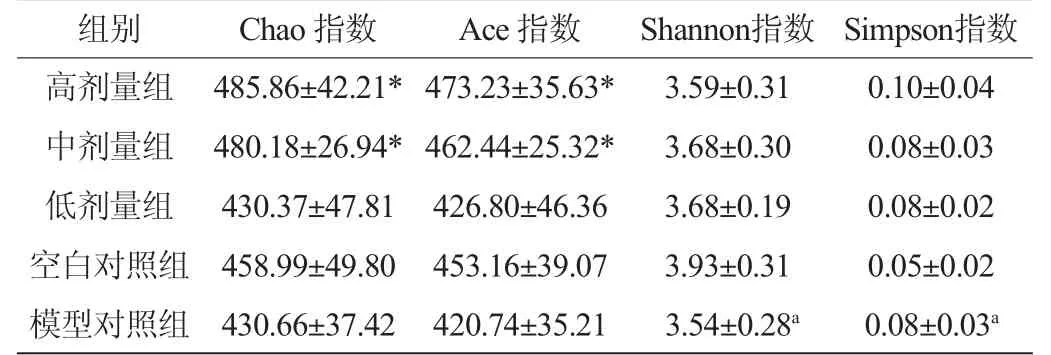
表5 小鼠肠道菌群α-多样性统计分析Table 5 Alpha diversity statistical analysis of intestinal flora in mice
Alpha多样性(Alphadiversity)是对单个样品中物种多样性的分析[9],其中Chao指数和Ace指数反应样本的物种丰富度,Simpson指数和Shannon指数综合反应群落的多样性,受样品群落中物种丰富度和物种均匀度的影响。相同物种丰富度的情况下,群落中各物种具有越大的均匀度,则认为群落具有越大的多样性。由表5可知,在物种多样性方面,模型对照组显著低于空白对照组(P<0.05),高、中、低剂量组与模型对照组差异不显著(P≥0.05),与有关研究便秘模型肠道菌群α-多样性分析结果一致[10]。高剂量组和中剂量组在物种丰富度上显著高于模型对照组(P<0.05)。
2.4.2 各试验组小鼠肠道菌群门水平变化
肠道菌群按照生理作用可分为三类:生理性菌群,主要包括双歧杆菌、乳杆菌等专性厌氧菌,为肠道优势菌,对肠道正常生理功能起保护作用;条件致病菌,大肠埃希氏菌、肠球菌、梭菌等,多为专性厌氧菌,仅在满足特定条件下对宿主产生影响;病原菌多为变形杆菌等,如在肠道长期定殖并大量繁殖可导致人体发病[11-12]。16SrDNA技术的应用,使得DNA测序更加准确的分析肠道菌群种类及其结构组成[13-14]。
50个样品共计产生683个OTU,分属于10个细菌门。各试验组的大部分肠道菌群属于拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、疣微菌门(Verrucomicrobia)、变形菌门(Proteobacteria)、蓝藻细菌门(Cyanobacteria)、柔膜菌门(Tenericutes),见图1。由图1可知,造成便秘高、中、低、模型对照组与空白对照组相比,厚壁菌门显著降低,降低比例分别为34%、17%、36%、31%。疣微菌门和蓝藻菌门显著增加,疣微菌门增加比例均100%以上,蓝藻菌门增加比例分别为59%、84%、52%、43%。

图1 各组小鼠肠道菌群门水平丰度图Fig.1 Phylum-level abundance of intestinal flora in different groups of mice
2.4.3 各试验组小鼠肠道菌群属水平变化
在属的水平上,嗜粘蛋白-艾克曼菌属(Akkermansia)、拟杆菌属(Bacteroides)、Dorea属、Odoribacter杆菌属、颤螺菌属(Oscillospira)、副杆菌属(Parabacteroides)、副普雷沃氏菌属(Paraprevotella)、雷沃氏菌属(Prevotella)、瘤胃球菌属(Ruminococcus)含量丰富(>1%)。高、中、低三个剂量组与模型对照组相比拟杆菌属含量分别降低64%、59%、64%,肠球菌含量分别降低37%、47%、87%,梭菌属含量分别降低63%、46%、13%,变形杆菌含量分别降低86%、100%、100%;高剂量组嗜粘蛋白-艾克曼菌属(主要是Akkermansia muciniphila)、乳杆菌属的含量较模型对照组分别升高41%、38%。
黄酒中丰富的功能性低聚糖[15]能够被肠道有益菌吸收,改善微生态环境,有利于有益菌的增值,经代谢产生的有机酸使肠内的pH值降低[16],低pH值环境能够调节促进专性厌氧菌在肠道的定植,使短链脂肪酸竞争性结合肠道上皮细胞或粘膜上受体结合位,以提高厌氧菌定植抗力[17-18],抑制腐败菌的生长,调节胃肠功能[19]。
已有研究表明,Akkermansia muciniphila是肠道中的一种黏蛋白降解菌[20],在肥胖及相关代谢疾病(如糖尿病)中具有关键作用[21],其组成比例与宿主健康存在正相关[22],有望成为新一代的益生菌[23]。结合本实验结果,推测盐酸洛派丁胺可能引起Akkermansia muciniphila含量增高,而高剂量黄酒也有显著增加该菌含量的可能性,进一步推测高剂量黄酒组动物体质量增长缓慢和该菌含量可能有相关性,有待深入研究。

图2 各组小鼠肠道菌群属水平丰度图Fig.2 Genus-level abundance of intestinal flora in different groups of mice
3 结论
黄酒没有显著促进BALB/c小鼠小肠蠕动,没有显著缩短小鼠首粒排黑便时间以及提高粪便质量,表明黄酒在通便功能上作用不明显。50.0 mL/(kg·BW)剂量黄酒小鼠体质量增长缓慢,明显低于其他各组,该剂量黄酒在维持体质量方面具有一定作用。黄酒能够调节便秘小鼠肠道菌群结构,提高菌群丰富度,高剂量黄酒能够提高嗜粘蛋白-艾克曼菌、乳杆菌的含量,并降低拟杆菌、肠球菌、梭菌和变形杆菌的比例。
