异硫氰酸烯丙酯的农用活性与应用研究进展
2018-12-05李迎宾曹永松罗来鑫张治萍李健强
李迎宾 曹永松 罗来鑫 张治萍 李健强
摘要
异硫氰酸烯丙酯(allyl isothiocyanate,AITC)是十字花科植物的组成型代谢产物之一,关于其天然抗菌杀虫活性,以及在人类医学、农业、食品等领域的应用已有大量研究。本文重点对AITC的制备、农用活性及残留、安全性及作用机制研究等方面进行综述,以期为AITC在农业中的开发应用提供理论参考和技术支撑。
关键词
异硫氰酸烯丙酯; 抗菌活性; 农用活性; 作用机制
中图分类号:
S 436.6
文獻标识码: A
DOI: 10.16688/j.zwbh.2018324
Research progresses on the anti-microbial activity and
application of allyl isothiocyanate in agriculture
LI Yingbin, CAO Yongsong, LUO Laixin, ZHANG Zhiping, LI Jianqiang
(College of Plant Protection, Beijing Key Laboratory of Seed Disease Testing and
Control (BKL-SDTC), China Agricultural University, Beijing 100193, China)
Abstract
Allyl isothiocyanate, as an important constructive metabolite from cruciferous plants, has a broad biological activity and has been widely studied and applied in the fields of human medicine, agriculture, food science,et al. This review summarized the agricultural bioactivity and application of allyl isothiocyanate, including the preparation of AITC, agricultural activity, residue, safety and mechanism. The purpose of this paper is to provide more theoretical and technical support for the development and application of AITC in agricultural production.
Key words
allyl isothiocyanate; biological activity; agricultural activity; mechanism of AITC
依赖化学农药控制农作物病虫害具有悠久的历史[1]。熏蒸剂作为合成化学农药的一种,在防控土传、仓储、采后病虫害及食品保鲜等领域具有较为广泛的应用。随着人们消费水平及对食品安全的重视程度的提高,研究开发高效、无毒、无残留的病虫害防治措施及食品保鲜手段备受关注和重视。1937年Walker等报道十字花科芸薹属植物,如芥菜、甘蓝中的硫代葡萄糖苷(glucosinolates,简称GSLs)的降解产物异硫氰酸酯类化合物(isothiocyanates,简称ITCs)具有天然抗菌活性[2]和广谱灭生性[3],其中异硫氰酸烯丙酯(allyl isothiocyanate,AITC)作为主要降解产物,对多数植物病原真菌[4]、细菌[5]、线虫及昆虫[6]具有活性。同时,对一些人类致病菌,如大肠杆菌Escherichia coli、鼠伤寒沙门氏杆菌Salmonella typhimurium、绿脓杆菌Pseudomonas aeruginosa、副溶血性弧菌Vibrio parahaemolyticus、幽门螺旋杆菌Helicobacter pylori、念珠菌属Candida sp.等同样具有生物活性[7]。除此之外,AITC在抗癌、心肌保护及神经保护等方面的效果和作用也受到关注[8-9]。
1 异硫氰酸烯丙酯及其制备工艺
1.1 异硫氰酸烯丙酯概述
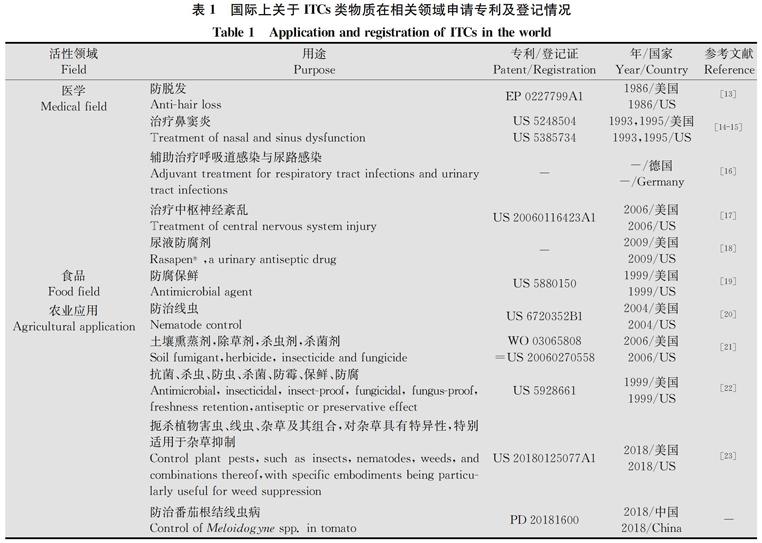
异硫氰酸烯丙酯(AITC,俗称为辣根素)是一类广泛存在于辣根、芥菜和山葵等十字花科蔬菜中的天然含硫次生代谢物,是ITCs类物质的主要种类;其在人类医学、食品和农业领域具有重要的应用价值,基于ITCs类物质所申请的部分专利及农药登记报道见表1。
表1 国际上关于ITCs类物质在相关领域申请专利及登记情况
Table 1 Application and registration of ITCs in the world
辣根素的前体为存在于植物液泡中的GSLs物质,一旦将植物组织破碎,GSLs便在黑芥子酶的催化作用下水解[10]。不同十字花科植物GSLs水解产物不同。Jiang等采用GC-MS方法,共检测出我国辣根中含有的9种挥发性ITCs物质,名称及含量分别为异硫氰酸异丙酯(isopropyl isothiocyanate,isopropyl ITC,含量0.1%)、异硫氰酸烯丙酯(AITC,含量78.4%)、异硫氰酸丁酯(butyl isothiocyanate,butyl ITC,含量0.1%)、3-丁烯基异硫氰酸酯(3-butenyl isothiocyanate,3-butenyl ITC,含量1.5%)、2-异硫氰酸戊酯(2-pentyl isothiocyanate,2-pentyl ITC,含量2.1%)、异硫氰酸苯酯(phenyl isothiocyanate,phenyl ITC,含量0.1%)、3-(甲基硫代)丙基硫代异氰酸酯(3-methylthiopropyl isothiocyanate,3-methyl ITC,含量0.3%)、异硫氰酸苄酯(benzyl isothiocyanate,benzyl ITC,含量0.1%)、β-异硫氰酸苯乙酯(β-phenylethyl isothiocyanate,β-phenylethyl ITC,含量9.4%)。其中,AITC为我国辣根含有的ITCs类物质的主要成分,其含量高于英格兰辣根、匈牙利辣根和日本辣根(44.3%~55.7%)[11-12]。
1.2 AITC的制备
AITC的化学结构式为CH2=CHCH2N=C=S,分子量99.16,沸点为152℃,凝固点-80℃,密度为1.012 6 g/mL。常温下为淡黄色透明油状液体,具有强烈的挥发性,其制备主要有以下两种途径。
1.2.1 从十字花科植物中提取
一些蔬菜如甘蓝中AITC的浓度大概在800~1 000 mg/kg[24],芥菜种子中含有的AITC浓度最高,约为2 500~5 000 mg/kg。从辣根等十字花科植物中提取AITC的经典方法是水蒸气蒸馏法和超临界CO2流体萃取法。以辣根为例,Wu等[25]比较了水解时间、温度、pH和添加剂抗氧化剂对于AITC前体的水解效果,最终发现采用20 mg/g抗氧化剂叔丁基对苯二酚65℃水解120 min(pH=4)时AITC前体物质水解程度最佳,以二氯甲烷作为萃取溶剂最优,采用超临界CO2液体萃取法产生的AITC产量为6.10%,高于水蒸气蒸馏产率(5.83%)。郑建秋等[26]将粉碎后的芥菜籽加入反应釜容器中,采用50℃、pH为4.0~6.5的酸性水浸泡2 h,催化芥菜籽中的GSLs为异硫氰酸烯丙酯,采用亚临界水萃取技术(2Mpa、120℃)对反应釜中的物质进行萃取,然后分离反应釜中的物质,即得到含异硫氰酸烯丙酯的辣根素粗产物,产物中AITC含量为66.5%,产油率为2.3%。该制备过程不仅绿色安全,且易于操作,反应历程短,萃取率高。
1.2.2 仿生化学合成路径
从十字花科植物中提取辣根素操作复杂,能耗过高,提取效率低,难以规模生产,因此AITC的化学合成备受关注[27]。目前AITC主要通过仿生合成进行制备,其中具有工业化前景的合成途径是以烯丙基卤与硫氰酸盐作为原料,通过液固非均相反应及将溶剂改为乙醇后的均相反应。国外团队如美国、俄罗斯(RUSS2321581)、日本(JP181053)、印度等均有关于AITC的合成工艺[28]。国内王向辉等[29]选用l, 3-二溴丙烷、邻苯二甲酰亚胺钾、硫脲、二硫化碳及取代溴苄为原料,经5步反应合成了8个未见报道的辣根素类化合物。刘学勇等[27]综述了国内外主要的合成工艺,认为李健强、曹永松团队等采用烯丙基胺、二硫化碳和双氧水为主要原料的制备工艺简单,产品收率达90%,含量达到97%,具有较大的产业化生产价值[30]。
2 AITC的农用活性
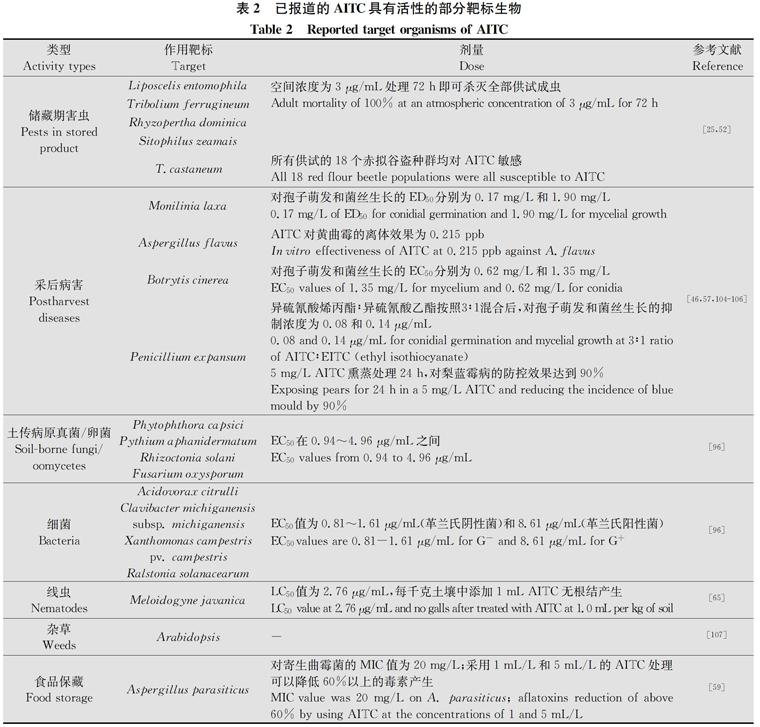
已报道,AITC具有广谱高效的杀菌、杀线虫、杀虫作用活性(见表2)。同时因其来源于植物且具有很高的安全性,美国环境保护署(US EPA)也许可将其登记为风险较低的生物农药之一[31]。
表2 已报道的AITC具有活性的部分靶标生物
Table 2 Reported target organisms of AITC
2.1 对土传植物病原生物的活性
早期人们发现,芥菜籽、山葵、辣根等植物具有杀菌活性。Angus等发现将甘蓝和芥菜等植物的碎粉深埋至土壤中,可以抑制小麦全蚀病菌Gaeumannomyces graminis var. tritici的生长,并首次将这种方法称为“生物熏蒸”[32]。由于连作或伴随灌溉,土壤中的腐霉Pythium与疫霉Phytophthora等不断在田间土壤环境中累积[33],对此Weerakoon等[34]以芥菜种子糠(seed meal)改良土壤,建立了一种以“生物介导”的能够长期抑制病原菌积累的策略,有效地控制了苹果园内树苗根腐病的发生[35]。研究揭示其中具有抑菌作用的成分是包括AITC在内的多种ITCs类物质。Mark等[36]研究表明,芥菜中的AITC在24~48 h内即可完全释放到土壤中。
作者团队的黄小威[37]、王彦柠等[38]研究表明,在熏蒸条件下AITC对供试的禾谷镰刀菌Fusarium graminearum、立枯丝核菌Rhizoctonia solani等10余种植物病原真菌及瓜果腐霉Pythium aphanidermatum、辣椒疫霉Phytophthora capsici等卵菌的菌丝生长具有显著的抑制作用,其EC50分布在0.94~24.64 μg/mL之间;对其中12种病原真菌的孢子萌发亦具有显著抑制作用,EC50分布在0.26~0.69 μg/mL之间;试验证实,AITC能够导致供试土传病原真菌及卵菌菌落扩展速度减慢,气生菌丝稀薄、孢子萌发率降低,病原细菌菌落数量减少、生长速度减缓,对常见的植物病原菌呈现出广谱、高效的抑菌活性,为辣根素熏蒸防控田间主要土传病害提供了理论支持。
由大丽轮枝菌Verticillium dahliae引起的棉花黄萎病是一种重要的土传植物维管束病害,严重影响棉花产量[39]。作者团队的李慧[40]前期研究表明,20%辣根素水乳剂1 500倍稀释液不仅对棉花黄萎病菌菌丝生长具有显著的抑制作用,同时对棉花种子出苗和幼苗生长具有安全性。刘政等[39]采用滴灌与覆膜施药的方式,连续两年对20%辣根素水乳剂防控棉花黄萎病的田间效果进行研究,提出了该药剂防控棉花黄萎病的使用技术规程,且在合作试验地区合计辐射应用面积达到1.4万hm2。
2.2 对果蔬地上部病虫害靶标生物的活性
王彦柠等[38]研究表明,AITC对番茄溃疡病菌Clavibacter michiganensis subsp. michiganensis、十字花科黑腐病菌Xanthomonas campestris pv. campestris等5种植物病原细菌的生长具有显著抑制作用,EC50分布在0.81~8.61 μg/mL之间。
北京市近几年来大力推广使用AITC,建立了以蔬菜无病虫育苗、产前消毒预防、产中综合防控和产后残体无害处理有机结合的“全程绿色防控”技术体系。目前,北京市蔬菜病虫全程绿色防控示范基地数量达到20 个,覆盖了全市10 个区(县),有效减少了病虫危害程度和化学农药用量[41]。示范试验证实,20% 辣根素水乳剂对烟粉虱有很好的速效性,药后3 d防效达到70.9%,且成本低廉,操作简便[42];采用滴灌施药方法,发现其对土壤真菌中的镰刀菌杀灭效果达到100%,对腐霉、曲霉、青霉等杀灭效果显著;设施草莓土壤经過辣根素消毒处理整个生长期内的植株成活率明显提高[43]。天津市津南区植保部门通过滴灌系统把辣根素注入土地后覆盖上一层密闭的厚膜,熏蒸处理3 d即可有效杀灭多种病虫,按照操作规程定植蔬菜,一季不用再除草、除虫,还能保证蔬菜的品质[44]。王晓青等在生菜定植前7 d采用20%辣根素水乳剂以随水滴灌方式对连续种植3年以上菌核病发生严重的生菜地进行土壤熏蒸处理,定植后7 d使用抗重茬菌剂或使用寡雄腐霉灌根处理,对生菜菌核病防治效果可达到80%左右[45]。
2.3 对作物储藏期病虫害靶标的生物活性
AITC因具有强烈的挥发性以及高效的抗微生物活性,且对多种食源性致病菌具有杀灭活性,研究者认为可将AITC开发成一种新型的包装策略,如作为“抗菌香囊(anti-microbial sachets)”防控由Aspergillus flavus引起的储藏期花生黄曲霉素的污染[46]。Tracz等采用AITC对储藏期玉米粒密闭熏蒸处理48 h后进行通风处理,检测了玉米粒中AITC的残留量。结果表明,通风24 h后,玉米籽粒中可检测到44.5%的AITC,继续密封保存30 d后籽粒中仍有15.5%的AITC被检测出,说明在储藏过程中,玉米粒可以作为AITC的吸收维持载体,通过缓释的方式逐渐散发到空气中,对储藏期玉米由5种真菌产生的12种毒素都具有显著的抑制效果[47]。Nazareth等研究表明,AITC可降低储藏期面粉中由寄生曲霉Aspergillus parasiticus产生的黄曲霉毒素(aflatoxin)及早熟禾镰刀菌Fusarium poae产生的白僵菌素(beauvericin)和恩镰孢菌素(enniatin)的积累[48]。除此之外,也有学者采用AITC对莴苣、苹果、番茄、草莓、黑莓、悬钩子等蔬果储藏期病害进行防控研究[49-51]。在杀虫方面,AITC也具有安全高效性且与磷化氢等无交互抗药性[52],可作为一种针对储藏期害虫防控的有效策略。
2.4 对杂草的生物活性
Ren等[53]采用AITC进行番茄地土壤熏蒸处理,发现其不但可以有效杀灭土壤环境中的病原真菌、细菌及线虫等,同时对土壤中的杂草(LC50=17.3~47.7 mg/kg)也具有很好的杀灭活性。Matteo等也发现,十字花科作物粗提取物对大穗看麦娘Alopecurus myosuroides具有优异的生物活性[54]。Bangarwa等研究发现[55],AITC作为除草剂控制苋科植物、马唐的效果与甲基溴相当。2018年申请的美国专利(US201801225077A1)中也表明,ITCs类特别适用于对杂草的抑制。
3 AITC残留和安全性
3.1 AITC残留分析方法
Tracz等[47]研究AITC防控储藏期由Aspergillus parasiticus,Fusarium tricinctum,F.verticillioides以及Alternaria alternata引起的玉米毒素产生水平时,优化了AITC在玉米粒中的残留分析条件,包括1)样品制备:将一定质量的玉米粒浸泡在甲醇中,40℃水浴中振荡30 min后再超声处理10 min,20℃ 4 000 r/min离心5 min后收集上清液,过0.22 μm滤膜;2)检测方法及条件:采用HPLC的方法,检测器为安捷伦二极管阵列检测器(LC-DAD),检测波长为236 nm,分离柱为Gemini C18(4.6 mm×150 mm,孔径3 μm),流动相为水∶乙腈(V∶V=60∶40),流速為0.8 mL/min。
吴华等[56]建立了20%AITC在几种仓库贮藏品中的毛细管气相色谱残留分析方法。该方法以二氯甲烷为提取溶剂,采用毛细管气相色谱-火焰离子化检测仪进行测定(与国标GB29980-2013中规定的检测器一致),发现辣根素在贮藏品中的消解动态符合一级动力学方程,其半衰期为28~75 d,其降解过程主要是酶解、水解、光解。Ugolini等[57]采用固相微萃取技术,以气相色谱火焰离子化检测器进行测定AITC在草莓果实中的残留。
3.2 AITC安全性评价
3.2.1 对人体的安全性
1999年AITC免除了注册化学品的注册授权和限制,并且在日本作为一种商品化的天然抗菌剂或防腐剂添加到食品中[58];2006年美国规定AITC可作为一种“公认安全食品”添加到食品储藏罐中,用来延长食品保质期和抗腐败;2011年美国食品药品监督管理局规定AITC可作为一种食品添加剂直接加入食品中使用,而且被认为有利于人体健康[1,46];欧洲国家也明确了AITC作为食品防腐剂和食品添加剂具有安全性[59]。
Otoni等采用AITC防控由Aspergillus flavus引起的储藏期花生黄曲霉素的污染,在前15 d约92.4%的AITC已经降解,30 d后无AITC可检出[46]。Ugolini采用0.1 mg/L AITC处理草莓果实4 h后,可使灰霉病发生降低47.4%~91.5%,且对果实的营养品质等无影响,储藏7 d后AITC残留量低于1 mg/kg[57]。Santos等采用300 μL/kg的AITC对储藏期密封保存的玉米粒真菌毒素的产生进行防控,结果表明,储藏150 d后,AITC对玉米种子的发芽势、含水量、容重以及电导率等生理指标均无影响[60]。Wu等[25]采用AITC处理稻米,其残留量低于5 μg/g。欧盟委员会规定,AITC日摄取量(tolerable daily intake, TDI)最高为每千克体重0.06 mg[61]。研究表明,一定时间后AITC残留基本检测不到或含量极低,表明采用AITC进行食品保鲜或病害防控,不太可能导致储藏产品中的残留问题,也不太可能会对人类健康产生威胁。美国国家环境保护局(United States Environmental Protection Agency)官方数据表明,AITC安全性高,对婴幼儿等也无不良反应(https:∥www.epa.gov/)。
3.2.2 对非靶标生物的安全性
Zaborski等采用100 mg/L的AITC作驱避剂收集土壤中的蚯蚓,其收集效果与200 mg/L的福尔马林相比无显著差异,且对蚯蚓具有更小的毒性,因此认为将AITC引入土壤环境中是安全的[62]。Borek等[63]测定了AITC在6种不同土壤中的半衰期,为20~60 h,且随着土壤水分的降低和温度的升高,AITC降解速度加快。Isagro美国公司联合美国多所大学的研究人员针对以AITC为原料登记的土壤熏蒸剂“DOMINUS”进行了严格的测试,说明其在土壤中能快速降解,在作物种植前施用,土壤中不会残留,是一款环境友好型的产品[64]。Wu等认为AITC对非靶标生物具有极低的毒性,因此也易被农户接受[65]。
研究报道[36,66]表明,土壤中的有益微生物如Trichoderma spp.等对AITC不敏感,展现出很强的忍耐性。Weerakoon等也发现AITC处理过的土壤环境中,T.hamatum和T.virens仍然是主要群体[34]。美国EPA官方数据表明AITC对环境友好,对非靶标生物(除部分昆虫如蜜蜂外)无毒性作用[67]。
4 AITC的农药登记与产业化应用
4.1 AITC剂型研发
由于AITC分子量很小,化学性质活泼,常温下具有很强的挥发性和刺激性,给使用带来了不便。彭家华采用分子包结络合法,制备了AITC微胶囊剂。该微胶囊剂有一定的缓释作用且利用率可提高到80%左右[68]。中国农业大学李健强团队选用高吸附性惰性材料等载体和助剂制备了多种用途的AITC剂型:包括水乳剂,颗粒剂,缓释型颗粒剂,缓释型纸片、塑料、块、袋等。
4.2 AITC施药器械及方式
辣根素是新型植物源药剂,作为土壤处理剂可有效杀灭多种土壤微生物,防控多种土传病害。施药时可根据土传病害发生严重程度选择随水滴灌施用或在播种前或移栽前采用起垄覆膜密封后,进行土壤熏蒸。
常用施药器械有烟雾施药机、远程机动喷雾器等高效施药器。目前,由北京市果类蔬菜创新团队病虫防控研究室联合设施设备研究室研发的辣根素土壤消毒专用施药机械已面世,该设备基本具备液态药剂土壤注射施用功能,机具采用履带式行走,稳定性高;可根据行走速度精准设定施药量;可根据消毒需要调节施药深度;采用多重防堵防漏措施,具有很高的施药安全性(http:∥www.bjny.gov.cn/)。当然,由于AITC具有强烈的刺激性,进行消毒时,操作人员应该进行自身防护,如佩戴护目镜、防毒面具等。
4.3 AITC的农药登记
以AITC为原料进行的农药登记,最早是美国约旦农业公司2000年登记的“Dazitol”。它是一种由辣椒素及相关物质(有效含量为0.42%)和异硫氰酸烯丙酯(有效含量为3.7%)组成的混合物,用于土壤处理可有效杀灭或抑制土壤中的线虫、有害昆虫、病原菌及杂草[69]。目前Dazitol正式登记的国家或地区有智利、约旦、阿联酋、科威特、美国、希腊、土耳其、摩洛哥、黎巴嫩、以色列、墨西哥、哥伦比亚、巴西、阿根廷、泰国、秘鲁、埃及、西班牙、伊拉克等(http:∥www.ynlagensu.com/userlist/lclmsw/text-9449.html)。除此之外,Isagro美国公司2014年登记的以AITC为活性成分的“Dominus”产品(https:∥www.isagro.com/prodotti/fumiganti.html)是第一款可同时用于传统及有机耕种的土壤生物熏蒸剂,对土壤中的真菌、线虫、杂草和昆虫具有广谱防治功效,其登记类别为“以天然物质为基础的生物农药”[65]。2017年,Mardel Rose Belotinsky TriCal公司登记了AITC与氯化苦的复配制剂投入市场(http:∥www.trical.com/)。
2018年,以AITC为有效成分的我国自创品牌“70%辣根素原药”(登记证号:PD20181601)和“20%辣根素水乳剂”(登记证号:PD20181600)由云南联创利民生物工程有限公司获得首家农药登记,用于防治番茄根结线虫。
4.4 AITC替代溴甲烷的应用
溴甲烷作为一种熏蒸类杀虫剂由来已久[70]。1932年法国首先使用,1937年后广泛使用于植物检疫熏蒸处理,我国于1953年开始用于熏蒸棉籽,后逐渐用于陆地或船舱中的熏蒸灭虫及仓储期杀虫[71]。根据《蒙特利尔议定书》哥本哈根修正案,发达国家和发展中国家分别于2005年和2015年淘汰使用溴甲烷。为了淘汰溴甲烷,各国科学家都在努力寻找安全、经济、有效的替代品,并取得了一些进展,如磷化氢、威百亩、氯化苦等[56]。但随着用药历史的延长,多个国家出现了包括玉米象、谷蠹、赤拟谷盗、嗜虫书虱等在内的至少11种储藏物害虫表现出对磷化氢,溴甲烷等的抗性[72-75],因此,寻找新型的安全、高效、可替代溴甲烷和磷化氢的新型化学品迫在眉睫。
曹坳程等[69,78]早在2006年提出AITC是一种安全、环境相容性好的熏蒸剂,是溴甲烷的潜在替代品。近年来,国内越来越多的团队通过大量的田间实践,证明AITC具有广阔的应用前景。
为实现中国政府的履约目标,由环境保护部和农业部共同组织实施了农业行业甲基溴淘汰项目,举办了“2015年农业行业甲基溴淘汰与土壤消毒技术培训班”,由北京市植保站作为执行和技术指导单位,联合中国农业科学院、中国农业大学、山东省农业环境保护和农村能源总站以及多个企业在山东、河北等省市开展辣根素土壤消毒试验,为溴甲烷替代药剂的开发和应用提供试验数据,推动溴甲烷淘汰项目顺利实施[76]。
国内以云南联创利民生物工程有限公司为代表的企业,大力开展以AITC为有效成分的农药制剂开发,在马铃薯病害综合防治、棉花黄萎病、草莓根腐病、蔬菜根结线虫等主要作物种传、土传病虫害,以及大宗蔬菜黄瓜、番茄等蔬菜多种地上部病蟲害治理中取得了良好的防控效果。目前,国内中国农业大学以及云南农业大学等高校也积极采用AITC防控魔芋细菌性软腐病、具有连作障碍的三七根腐病以及食用百合根及鳞茎腐烂病[77]等,取得了阶段性进展。
5 AITC的作用机制
吴华等对AITC在医学领域抗肿瘤、抗癌的活性,以及其对仓储害虫、病原微生物、线虫、杂草等农业有害生物的活性研究进行了综述[79]。本文结合文献报道重点对AITC的作用机制进行评述。
5.1 诱导线虫细胞压力
Saini等用AITC处理秀丽隐杆线虫Caenorhabditis elegans,采用RT-qPCR方法研究了AITC对其热激蛋白基因HSP70表达的影响。结果发现,低浓度AITC(<0.1 μmol/L)处理对HSP70的表达无影响,而高浓度(>0.1 μmol/L)处理,HSP70的表达会增加4~5倍,表明AITC可以诱导线虫细胞压力,进而起到毒力效果[80]。
5.2 对昆虫的毒力机制
Wu等采用AITC熏蒸处理玉米象,透射电镜观察发现,线粒体基质变得稀疏且空泡化现象严重。进一步作者又研究了AITC對玉米象中谷胱甘肽S-转移酶、过氧化氢酶、细胞色素C氧化酶和乙酰胆碱酯酶的活性,结果表明,4种酶的活性均与AITC的处理时间和剂量有关,即低剂量呈现活性增强,高剂量呈现活性抑制。作者推测,线粒体可能是AITC的作用位点之一且细胞色素C氧化酶可能是AITC的作用靶标蛋白[81];进一步研究表明,AITC对线粒体复合物IV的抑制效果比复合物I更为明显,预示了线粒体复合物IV可能是AITC的初级靶标[82]。同时,通过克隆玉米象中细胞色素C氧化酶亚基Ⅱ,并纯化该蛋白,进一步分析了AITC对该酶的活性,采用同源建模(homology modeling)以及分子对接(molecular docking)分析认为,AITC中的硫原子可以与细胞色素C氧化酶亚基Ⅱ上的一个亮氨酸残基结合[83]。进一步结合RNA-seq数据,发现AITC熏蒸处理玉米象后,玉米象117个基因出现过表达,271个基因下调表达。KEGG富集分析表明,大多数基因富集集中在“折叠、分类和降解”、“运输和分解代谢”、“能量代谢”和“碳水化合物代谢”。提出了细胞骨架丢失和线粒体功能障碍是AITC对玉米象的致死机制[84]。
5.3 抑制植物病原菌的相关机制
已报道AITC具有抗癌活性,胞内靶标涉及多种,如细胞色素P-450(CYP450)、抗氧化过程、肿瘤发生、细胞凋亡、细胞周期与转移等过程相关的蛋白[85]。
Bailey等报道了甘蓝中ITCs类物质自然水解产物,包括硫化氢、二硫化碳以及其他胺化成分,发现部分水解产物同样具有抑菌活性[86];Tang等也描述了微生物对ITCs类物质的降解,认为苄胺(benzylamine)为主要产物[87]。Kawakishi等认为,ITCs可通过破坏蛋白之间的二硫键,影响细菌细胞的蛋白质结构[88];Kojima等对多种ITC物质进行了测试,发现其均可显著性抑制酵母的细胞色素C氧化酶的活性,影响酵母细胞的代谢功能[89],但与典型的呼吸抑制剂如KCN与抗霉素A相比,AITC对待测酵母的MIC浓度却低了100倍左右,说明AITC并不是一种强烈的呼吸抑制剂,也说明抑制氧摄取并不是AITC的主要抑菌机制[90];Lim等发现,ITCs类物质也可影响β-半乳糖苷酶活性,诱导细胞代谢物泄露,抑制革兰氏阴性细菌生长[91]。Delaquis等则认为,ITCs类物质可能是发挥了氧化磷酸化解偶联剂的作用,因为对于严格好氧的真菌而言,其对ITCs类物质具有更高的敏感性[5]。ITCs完整的作用机制至今仍然不清楚[92],以往的文献中也并没有揭示单一的作用位点,因此,其作用机制通常被认为是作为一种非特异性的抑制剂。
Isshiki等研究了AITC对多种细菌的抑制效果。结果表明,相比革兰氏阳性菌,阴性细菌对AITC的敏感性更高[93]。Lin等发现,处于指数期细菌比处于稳定期细菌对AITC敏感性更高;同时,通过比较青霉素、链霉素、多黏菌素B以及AITC,认为AITC的作用机制与多黏菌素B更为接近,因为多黏菌素B具有一个亲水性七肽环和一个疏水链,使其具有两性分子的属性,而AITC同样具有两性分子属性,即含有一个极性的末端和一个非极性末端链,这使得AITC可以更容易改变胞膜通透性[10, 90, 94]。
AITC对害虫的作用机制尚未完全建立[25],也有很多假说提出,一些人认为AITC可以与含硫基团、二硫键、蛋白质的氨基酸、氨基酸残基发生非特异性以及不可逆的结合。Murata等[95]认为AITC还可诱导DNA损伤。
王彦柠[96]通过扫描电镜观测菌丝表面形态发现,经AITC熏蒸处理的供试菌菌丝出现不同程度的皱缩、畸形、瘤状突起及内容物外渗等现象,透射电镜可观测到菌丝外壁及膜结构破裂受损,细胞壁不规则增厚或消解,甚至出现细胞壁剥落;进一步研究发现,AITC可增加细胞膜通透性,对供试真菌具有低浓度促进呼吸高浓度抑制呼吸的双重作用,且随着药剂处理浓度的增加,供试靶标菌菌丝中ATP含量及能荷值均降低。
5.4 AITC诱导植物抗性机制
研究表明,AITC对于植物生长和存活是一种重要的防卫成分[97]。Sporsheim等研究发现[98],AITC通过可逆地抑制高尔基体、内质网、过氧化物酶体和液泡中依赖肌动蛋白的细胞内转运。Khokon等研究报道,AITC可以诱导蚕豆、拟南芥气孔关闭,从而保护自身避免水分丧失或潜在病原菌的侵染[99-100]。Wang等[101]研究表明,AITC可以增强蓝莓果实H2O2的产生和自由基形成,从而对病原菌产生高强度的氧化压力,提高蓝莓对病原菌的抵抗作用。除此之外,ITCs类物质作为化感物质、硫储存物质,以及在耐热、细胞凋亡、生长抑制、信号转导等方面也发挥重要作用。Calmes等以Alternaria brassicicola作为模式菌株,研究了其与十字花科蔬菜大白菜的互作过程。结果表明,植物体内的GSLs降解产物(即ITCs类物质)可诱导A.brassicicola胞内氧消耗降低、活性氧ROS积累下降,线粒体膜电位下降。同时发现,A.brassicicola中一个涉及MAP激酶基因(AbHog1)和一个转录因子(AbAP1)参与了植物与病原菌的互作过程[102-103]。
6 展望
随着农业生产集约化程度不断提高,特别是设施农业快速发展,导致土传病虫害的问题日益突出;同时,农药化肥等的不合理使用也对空气、土壤和水体等造成了严重的面源污染。甲基溴是国际上公认的土壤熏蒸效果最好的药剂[77],但由于其具有破坏臭氧层作用,联合国已将其禁用。2016年由科技部首次启动“化学肥料和农药减施增效综合技术研发”项目,提出“优先选用生物农药或高效低毒低残留化学农药”。AITC作为一种广谱、高效、安全的生物熏蒸剂,各国学者对其生物活性的研究已较为宽广,这充分表明辣根素是极具应用潜力的一类化合物。
6.1 拓展AITC研究,为作物绿色防控提供新举措
AITC是一类国内外高度关注和重视研究开发的药剂,可以满足和适应于保护地或覆膜栽培、仓储期病虫害的防控等方面。推动植物病虫害的源头控制,播种或移栽前通过土壤熏蒸处理,可从源头降低田间初始病虫数量,有效降低病虫害的发生危害;生长期内对棚室进行熏蒸消毒,还可以有效降低蔬菜霜霉病、白粉病等多种气传病害和烟粉虱、蓟马等小型害虫的为害。一药多靶标,实现对作物生长不同阶段病虫害的预防和治理。同时,因其为植物源农药,具有环境友好特征,可使其对环境造成污染的程度降至最低。
6.2 推动AITC产业化,为国家甲基溴替代提供新路径
国家甲基溴替代过程并非一蹴而就。自2003年批准《蒙特利尔议定书》哥本哈根修正案以来,中国就一直致力于甲基溴的替代工作。2008年起,农业部、环境保护部和联合国工业发展组织共同启动了农业甲基溴淘汰项目,农业部科技教育司作为具体实施单位,专设农业行业甲基溴淘汰项目办公室,协调各地方政府、科研单位、企事业单位、农户等开启了长达10年的履约征程,最终筛选出了对靶标菌灭菌活性高、对食品安全及对非靶标微生物干扰小的替代熏蒸剂,辣根素便名列其中。基于无残留的绿色土壤配套处理措施,很好地解决了多种作物土传病虫害的危害,农业部于2011年宣布撤销甲基溴在草莓、番茄、黄瓜等作物上的登记。随着生姜产业的异军突起,土传病害造成的问题凸显。氯化苦作为唯一登记的替代品,无法有效控制根结线虫。为避免对行业的冲击,2014年中国又向联合国臭氧保护秘书处提出申请,为部分生姜产区甲基溴防控根结线虫争取到一定的豁免权。国家项目办综合考虑履约形式及国家对高毒农药逐步淘汰战略,最终承诺2019年1月1日起全面禁止甲基溴在农业上的使用。2018年我国已经实现AITC为有效成分的自创品牌“70%辣根素原药”(登记证号:PD20181601)和“20%辣根素水乳剂”(登记证号:PD20181600)首家登记,有望为我国甲基溴替代提供新的路径。
6.3 强化AITC应用培训,打通技术推广“最后一公里”
辣根素作为一种新型土壤消毒剂,因其强烈的挥发刺激性,加之农户对土壤消毒的认知水平整体偏低,导致其在推广应用中面临一定的挑战。因此,应不断加强对其剂型、施药器械等的研究開发以及对田间应用效果、安全性等的评价研究,同时做好宣传普及推广;倡议创设全国辣根素应用技术合作联盟,加大投入力度,增强与地方农技服务中心、植保站等的合作,形成系统,通过开设辣根素应用技术培训班,不断强化管理人员、生产企业、经销商及农户等的认知水平。通过试验示范和田间现场反馈,不断完善和制定辣根素的使用技术规程;不断加强农户对土壤熏蒸的认知,严格按照使用技术规程操作,确保农事操作人员和作物生产安全。
参考文献
[1] TRONCOSO R, ESPINOZA C, S NCHEZESTRADA A, et al. Analysis of the isothiocyanates present in cabbage leaves extract and their potential application to control Alternaria rot in bell peppers [J].Food Research International,2005,38(6): 701-708.
[2] WALKER J C, MORELL S, FOSTER H H. Toxicity of mustard oils and related sulfur compounds to certain fungi[J].American Journal of Botany, 1937, 24(8): 536-541.
[3] ROSA E A S, RODRIGUES P M F. Towards a more sustainable agriculture system: The effect of glucosinolates on the control of soil-borne diseases[J]. Journal of Pomology and Horticultural Science, 1999, 74(6): 667-674.
[4] SMOLINSKA U, MORRA M J, KNUDSEN G R, et al. Isothiocyanates produced by Brassicaceae species as inhibitors of Fusarium oxysporum [J].Plant Disease, 2003, 87(4): 407-412.
[5] DELAQUIS P J, MAZZA G. Antimicrobial properties of isothiocyanates and their role in food preservation[J]. Food Technology, 1995, 49(11): 73-84.
[6] KERMANSHAI R, MCCARRY B E, ROSENFELD J, et al. Benzyl isothiocyanate is the chief or sole anthelmintic in papaya seed extracts [J]. Phytochemistry, 2001, 57(3): 427-435.
[7] FAHEY J W, ZALCMANN A T, TALALAY P. The chemical diversity and distribution of glucosinolates and isothiocyanates among plants [J]. Phytochemistry, 2001, 32(10): 5-51.
[8] WILLIAMS J R, RAYBURN J R, CLINE G R, et al. Effect of allyl isothiocyanate on developmental toxicity in exposed Xenopus laevis embryos [J]. Toxicology Reports,2015,2: 222-227.
[9] CLARKE D B.Glucosinolates, structures and analysis in food[J]. Analytical Methods, 2010, 2(4): 310-325.
[10] FENWICK G R, HEANEY R K, MULLIN W J. Glucosinolates and their breakdown products in food plants [J]. Critical Reviews in Food Science and Nutrition, 1983, 18(2): 123-201.
[11] GILBERT J, NURSTEN H E. Volatile constituents of horseradish roots [J]. Journal of the Science of Food and Agriculture, 1972, 23(4): 527-539.
[12] JIANG Zitao, LI Rong, YU J C. Pungent components from thioglucosides in Armoracia rusticana grown in China, obtained by enzymatic hydrolysis [J]. Food Technology and Biotechnology, 2006, 44(1): 41-45.
[13] DARKO L L. Allyl isothiocyanate and use thereof to inhibit hair loss: 0227799A1 [P]. 1986-12-31.
[14] FRIEDMAN W H. Horseradish preparation for the treatment of nasal and sinus dysfunction: 5385734 [P]. 1995-1-31.
[15] FRIEDMAN W H. Method of treatment for nasal and sinus dysfunction: 5248504 [P]. 1993-9-28.
[16] AGNETA R, M LLERS C, RIVELLI A R. Horseradish (Armoracia rusticana), a neglected medical and condiment species with a relevant glucosinolate profile: a review [J]. Genetic Resources and Crop Evolution, 2013, 60(7): 1923-1943.
[17] DASH P K. Methods and compositions for treatment of central nervous system injury with isothiocyanates: 20060116423A1[P]. 2006-6-1.
[18] SHEHATA A, MULWA R M S, BABADOOST M, et al. Horseradish: botany, horticulture, breeding [J]. Horticultural Reviews, 2009, 35: 221-261.
[19] FUJITA M, KAMEI K, KAWAZU K, et al. Antimicrobial agent containing allyl isothiocyanate and method for controlling release speed of allyl isothiocyanate: 5928661 [P]. 1999-7-27.
[20] RODRIGUEZ K R. Compositions and process for nematode control: 6720352B1 [P]. 2004-4-13.
[21] RIORDAN F. Novel soil fumigant, herbicide, larvacide, ovacide and fungicide: 7087553B2 [P]. 2006-8-8.
[22] FUJITA M, HIROHAMA S, HAYASHI Y, et al. Controlled release composition containing volatile compound: 5928661[P]. 1999-7-27.
[23] MORRA M J. A method for using mustard meal or an extract thereof: 20180125077A1 [P]. 2018-5-10.
[24] KUSHAD M M, BROWN A F, KURILICH A C, et al. Variation of glucosinolates in vegetable crops of Brassica oleracea[J].Journal of Agricultural and Food Chemistry,1999,47(4): 1541-1548.
[25] WU Hua, ZHANG Guoan, ZENG Shuiyun, et al. Extraction of allyl isothiocyanate from horseradish (Armoracia rusticana) and its fumigant insecticidal activity on four stored-product pests of paddy [J]. Pest Management Science,2009,65(9):1003-1008.
[26] 郑建秋, 李健强, 石尚柏, 等.以芥菜籽为原料提取辣根素的方法: 101768611A [P]. 2010-7-7.
[27] 刘学勇, 刘瑶. 异硫氰酸烯丙酯合成的研究进展[J]. 辽宁化工, 2012, 41(11): 1164-1166.
[28] KIM S, YI K Y. Di-2-pyridyl thionocarbonate. a new reagent for the preparation of isothiocyanates and carbodiimides[J]. Tetrahedron Letters, 1985, 26(13): 1661-1664.
[29] 王向輝, 邵艳东, 谢灵杰. 辣根素类化合物的合成及抑菌活性研究[J]. 化学研究与应用, 2015, 27(12): 1862-1866.
[30] 李健强, 郑建秋, 曹永松, 等. 制取异硫氰酸烯丙酯的方法: 101735128B [P]. 2013-11-20.
[31] 王以燕, 袁善奎, 李友顺. 美国EPA登记的生物农药有效成分名录[J]. 农药科学与管理, 2009, 30(8): 1-11.
[32] ANGUS J F, GARDNER P A, KIRKEGAARD J A, et al. Biofumigation: Isothiocyanates released from brassica roots inhibit growth of the take-all fungus [J]. Plant and Soil, 1994, 162(1): 107-112.
[33] YAMAK F, PEEVER T L, GROVE G G, et al. Occurrence and identification of Phytophthora spp. pathogenic to pear fruit in irrigation water in the Wenatchee River Valley of Washington State [J]. Phytopathology, 2002, 92(11): 1210.
[34] WEERAKOON D M N, REARDON C L, PAULITZ T C, et al. Long-term suppression of Pythium abappressorium induced by Brassica juncea seed meal amendment is biologically mediated [J]. Soil Biology and Biochemistry, 2012, 51: 44-52.
[35] YIM B, HANSCHEN F S, WREDE A, et al. Effects of biofumigation using Brassica juncea and Raphanus sativus in comparison to disinfection using basamid on apple plant growth and soil microbial communities at three field sites with replant disease [J]. Plant and Soil, 2016, 406(1/2): 389-408.
[36] MARK M, JACK B.Efficacy of brassicaceous seed meal formulations for the control of apple replant disease in conventional and organic production systems [J]. Plant Disease, 2010, 94(7): 424-429.
[37] 黄小威.辣根素种子消毒效果及防治果蔬贮藏期主要病害研究[D].北京:中国农业大学,2015.
[38] 王彦柠,李迎宾,黄小威,等.辣根素对常见植物病原菌的抑菌活性研究[J].中国科技论文,2018,13(6):692-697.
[39] 刘政,李迎宾,孙艳,等.20%辣根素水乳剂防控棉花黄萎病的研究[J].中国科技论文,2017,12(24):2817-2821.
[40] 李慧,武静雅,刘娜,等.中国植物病理学会2012年学术年会论文集[C].北京:中国农业科学技术出版社,2012.
[41] 钟欣.20个绿色防控示范基地带动北京蔬菜安全生产[N].农民日报,2013-11-8.
[42] 孙海,郑翔,王晓青,等.高效防治烟粉虱的药剂筛选[J].中国蔬菜,2015(8):46-49.
[43] 肖长坤,张涛,陈海明,等.20%辣根素水剂对设施草莓土壤消毒的效果[J].中国蔬菜,2010(21):29-31.
[44] 中国农业信息网.天津市津南区植保部门引入农业新技术培育放心菜[J].南方农业,2017,11(25):85.
[45] 王晓青,金红云,孙艳艳,等.中国植物病理学会2015年学术年会论文集[C].北京:中国农业科学技术出版社,2015.
[46] OTONI C G, SOARES N D F F, DA SILVA W A, et al. Use of allyl isothiocyanate containing sachets to reduce Aspergillus flavus sporulation in peanuts [J]. Packaging Technology and Science, 2014, 27(7): 549-558.
[47] TRACZ B L, BORDIN K, NAZARETH T D M, et al. Assessment of allyl isothiocyanate as a fumigant to avoid mycotoxin production during corn storage[J]. LWT-Food Science and Technology, 2017, 75: 692-696.
[48] NAZARETH T M, BORDIN K, MANYES L, et al. Gaseous allyl isothiocyanate to inhibit the production of aflatoxins, beauvericin and enniatins by Aspergillus parasiticus and Fusarium poae in wheat flour [J].Food Control,2016,62:317-321.
[49] LIN C M, KIM J, DU W X, et al. Bactericidal activity of isothiocyanate against pathogens on fresh produce [J]. Journal of Food Protection, 2000, 63(1): 25-30.
[50] CHANJIRAKUL K, WANG S Y, WANG C Y, et al. Effect of natural volatile compounds on antioxidant capacity and antioxidant enzymes in raspberries[J]. Postharvest Biology and Technology, 2006, 40(2): 106-115.
[51] CHANJIRAKUL K, WANG S Y, WANG C Y, et al. Natural volatile treatments increase free-radical scavenging capacity of strawberries and blackberries[J]. Journal of the Science of Food and Agriculture, 2007, 87(8): 1463-1472.
[52] SANTOS J C, FARONI L R A, SOUSA A H, et al. Fumigant toxicity of allyl isothiocyanate to populations of the red flour beetle Tribolium castaneum[J]. Journal of Stored Products Research, 2011, 47(3): 238-243.
[53] REN Zongji, LI Yuan, FANG Wensheng, et al. Evaluation of allyl isothiocyanate as a soil fumigant against soil-borne diseases in commercial tomato (Lycopersicon esculentum Mill.) production in China [J]. Pest Management Science, 2018,74(9):2146-2155.
[54] MATTEO R, BACK M A, READE J P H, et al. Effectiveness of defatted seed meals from Brassicaceae with or without crude glycerin against black grass (Alopecurus myosuroides Huds.) [J].Industrial Crops and Products,2017,111:506-512.
[55] BANGARWA S K, NORSWORTHY J K, GBUR E E. Allyl isothiocyanate as a methyl bromide alternative for weed management in polyethylene-mulched tomato [J]. Weed Technology, 2012, 26(3): 449-454.
[56] 吳华, 王朝军, 曾水云, 等. 仓库贮藏品中辣根素残留降解动态研究[J]. 食品科学, 2010, 31(8): 163-166.
[57] UGOLINI L, MARTINI C, LAZZERI L, et al. Control of postharvest grey mould (Botrytis cinerea Per.: Fr.) on strawberries by glucosinolate-derived allyl isothiocyanate treatments[J]. Postharvest Biology and Technology, 2014, 90: 34-39.
[58] DONG S L. Packaging containing natural antimicrobial or antioxidative agents [M].American:Academic Press,2005:108-122.
[59] SALADINO F, QUILES J M, LUCIANO F B, et al. Shelf life improvement of the loaf bread using allyl, phenyl and benzyl isothiocyanates against Aspergillus parasiticus[J]. LWT-Food Science and Technology, 2017, 78: 208-214.
[60] SANTOS S B, MARTINS M A, FARONI L R D, et al. Quality of maize grains treated with allyl isothiocyanate stored in hermetic bags [J]. Journal of Stored Products Research, 2010, 46(2): 111-117.
[61] EUROPE C O. Chemically defined flavouring substances [M]. France: Strasbourg, 2000.
[62] ZABORSKI E R. Allyl isothiocyanate: an alternative chemical expellant for sampling earthworms [J]. Applied Soil Ecology, 2003, 22(1): 87-95.
[63] BOREK V, MORRA M J, BROWN P D, et al. Transformation of the glucosinolate derived allelochemicals allyl isothiocyanate and allylnitrile in soil [J]. Journal of Agricultural and Food Chemistry, 1995, 43(7): 1935-1940.
[64] 農药导航网. 美国环保署批准登记Isagro的生物土壤熏蒸剂DOMINUS[EB/OL].[2015-12-02]. http:∥www.agr123.com/Catalog/mtgc/2015/12/2/151221613318482.html.
[65] WU Hua, WANG Chaojun, BIAN Xiaowei, et al. Nematicidal efficacy of isothiocyanates against root knot nematode Meloidogyne javanica in cucumber [J].Crop Protection,2011,30(1):33-37.
[66] GALLETTI S, SALA E, LEONI O, et al. Trichoderma spp. tolerance to Brassica carinata seed meal for a combined use in biofumigation [J].Biological Control,2008,45(3):319-327.
[67] AGENCY U S E P. Oriental mustard seed; allyl isothiocyanate (aitc) (014921) fact sheet [EB/OL].[2015-9-16]. https:∥www3.epa.gov/pesticides/chem_search/reg_actions/registration/fs_PC-014921_01-Jan-09.pdf.
[68] 彭家华. 辣根素土壤熏蒸剂剂型研究[D]. 武汉: 华中农业大学, 2009.
[69] 曹坳程, 褚世海, 郭美霞, 等. 一种潜在的溴甲烷土壤消毒替代品—异硫氰酸烯丙酯[J]. 农药, 2006, 45(7): 461-462.
[70] JALIL M, ROSS I J, RODRIGUEZ J G. Methyl bromide and phosphine as fumigants for some acarid mites [J]. Journal of Stored Products Research, 1970, 6(1): 33-37.
[71] 王怀训. 溴甲烷使用方法及注意事项[J]. 农药科学与管理, 2001(6): 37.
[72] PIMENTEL M A, FARONI L R, TOTOLA M R, et al. Phosphine resistance, respiration rate and fitness consequences in stored product insects [J]. Pest Management Science, 2007, 63(9): 876-881.
[73] MILLS K A. Resistance to the fumigant hydrogen phosphide in some stored-product species associated with repeated inadequate treatments [J]. Mitteilungen der Deutschen Gesellschaft für Allgemeine und Angewandte Entomologie, 1983, 4: 98-101.
[74] TAYLOR R W D. Phosphine-a major fumigant at risk [J]. International Pest Control, 1989, 31(1): 10-14.
[75] 梁永生,冉莉.谷蠹、米象和銹赤扁谷盗的PH3抗性品系对杀螟松和氯化苦的交互抗性研究[J].粮食储藏,2000,29(4):7-12.
[76] 中国农药信息网.2015年农业生产全面禁止使用甲基溴[J].植物医生,2014(1):24.
[77] 李一寒,何思琪,孟嫣,等.北京昌平区食用百合根及鳞茎腐烂的病原菌分离与鉴定[J].北京农学院学报,2018,33(2):32-37.
[78] 王腾飞.辣根素:植物中提取的土壤熏蒸剂[N].农民日报,2015-4-9.
[79] 吴华,冯俊涛,何军.辣根素的生物活性研究进展[J].中国生物防治学报,2013,29(2):301-306.
[80] SAINI A K, TYLER R T, SHIM Y Y, et al. Allyl isothiocyanate induced stress response in Caenorhabditis elegans[J]. BMC Research Notes, 2011, 4(1): 502.
[81] WU Hua, LIU Xueru, YU Dongdong, et al. Effect of allyl isothiocyanate on ultra-structure and the activities of four enzymes in adult Sitophilus zeamais[J]. Pesticide Biochemistry and Physiology, 2014, 109(1): 12-17.
[82] ZHANG Chao, WU Hua, ZHAO Yuan, et al. Comparative studies on mitochondrial electron transport chain complexes of Sitophilus zeamais treated with allyl isothiocyanate and calcium phosphide [J].Pesticide Biochemistry and Physiology,2016,126: 70-75.
[83] HOU Changliang, WANG Jingbo, WU Hua, et al. Molecular cloning and expression analysis of cytochrome c oxidase subunit Ⅱ from Sitophilus zeamais[J]. Biochemical and Biophysical Research Communications, 2016, 478(4): 1660-1666.
[84] ZHANG Chao, MA Ziqing, ZHANG Xing, et al. Transcriptomic alterations in Sitophilus zeamais in response to allyl isothiocyanate fumigation [J]. Pesticide Biochemistry and Physiology, 2017, 137: 62-70.
[85] KUMAR G, TULI H S, MITTAL S, et al. Isothiocyanates: a class of bioactive metabolites with chemopreventive potential[J]. Tumor Biology, 2015, 36(6): 4005-4016.
[86] BAILEY S D, BAZINET M L, DRISCOLL J L, et al. The volatile sulfur components of cabbage [J]. Journal of Food Science, 1961, 26(2): 163-170.
[87] TANG C S, BHOTHIPAKSA K, FRANK H A. Bacterial degradation of benzyl isothiocyanate [J]. Applied Microbiology, 1972, 23(6): 1145-1148.
[88] KAWAKISHI S, KANEKO T. Interaction of proteins with allyl isothiocyanate [J]. Journal of Agricultural and Food Chemistry, 1987, 49(5): 454-459.
[89] KDJIMA M. Studies on the effects of isothiocyanates and their analogues on microorganisms: I. Effects of isothiocyanates on the oxygen uptake of yeasts [J]. Journal of Fermentaion Technology,1971,49:740-746.
[90] LIN C M, WEI C I. Antibacterial mechanism of allyl isothiocyanate [J].Journal of Food Protection,2000,63(6):727-734.
[91] LIM L T, TUNG M A. Vapor pressure of allyl isothiocyanate and its transport in PVDC/PVC copolymer packaging film [J]. Journal of Food Science, 1997, 62(5): 1061-1066.
[92] ASMAA M S F, GHADA S E S, SALWA R S H, et al. Effect of Bifidobacterium longum and allyl isothiocynate on survival of Salmonella typhimurium in fermented sausage [J]. New York Science Journal, 2013, 6(2): 66-70.
[93] ISSHIKI K, TOKUOKA K, MORI R, et al. Preliminary examination of allyl isothiocyanate vapor for food preservation[J].Bioscience, Biotechnology and Biochemistry,1992,56(9): 1476-1477.
[94] LUCCHINI J J, CORRE J, CREMIEUX A. Antibacterial activity of phenolic compounds and aromatic alcohols[J]. Research in Microbiology, 1990, 141(4): 499-510.
[95] MURATA M, YAMASHITA N, INOUE S, et al. Mechanism of oxidative DNA damage induced by AITC free radical[J].Free Radical Biology and Medicine,2000,28(5):797-805.
[96] 王彦柠. 辣根素的抑菌活性及其作用机制初探[D]. 北京: 中国农业大学, 2017.
[97] OLIVIER C, VAUGHN S F, MIZUBUTI E S G, et al. Variation in allyl isothiocyanate production within Brassica species and correlation with fungicidal activity [J]. Journal of Chemical Ecology, 1999, 25(12): 2687-2701.
[98] SPORSHEIM B, VERBY A, BONES A M. Allyl isothiocyanate inhibits actin-dependent intracellular transport in Arabidopsis thaliana[J]. International Journal of Molecular Sciences, 2015, 16(12): 29134-29147.
[99] KHOKON M A R, JAHAN M S, RAHMAN T, et al. Allyl isothiocyanate (AITC) induces stomatal closure in Arabidopsis [J].Plant Cell and Environment,2011,34(11): 1900-1906.
[100] SOBAHAN M A, AKTER N, OKUMA E, et al. Allyl isothiocyanate induces stomatal closure in Vicia faba[J]. Bioscience,Biotechnology and Biochemistry,2015,79(10):1737-1742.
[101] WANG S Y, CHEN C T, YIN J J. Effect of allyl isothiocyanate on antioxidants and fruit decay of blueberries [J]. Food Chemistry, 2010, 120(1): 199-204.
[102] CALMES B, NGUYEN G, DUMUR J, et al. Glucosinolate-derived isothiocyanates impact mitochondrial function in fungal cells and elicit an oxidative stress response necessary for growth recovery [J]. Frontiers in Plant Science, 2015,6: 414.
[103] BONES A M, HARA M, ROSSITER J T, et al. Physiology and cellular mechanisms of isothiocyanates and other glucosinolate degradation products in plants [J]. Frontiers in Plant Science, 2015, 6: 1105.
[104] MARI M, LEONI O, BERNARDI R, et al. Control of brown rot on stonefruit by synthetic and glucosinolate derived isothiocyanates [J]. Postharvest Biology and Technology, 2008, 47(1): 61-67.
[105] WU Hua, ZHANG Xing, ZHANG Guoan, et al. Antifungal vapour-phase activity of a combination of allyl isothiocyanate and ethyl isothiocyanate against Botrytis cinerea and Penicillium expansum infection on apples [J]. Journal of Phytopathology, 2011, 159(6): 450-455.
[106] MARI M, LEONI O, IORI R, et al. Antifungal vapour-phase activity of allyl-isothiocyanate against Penicillium expansum on pears [J].Plant Pathology,2002,51(2):231-236.
[107] HARA M, YATSUZUKA Y, TABATA K, et al. Exogenously applied isothiocyanates enhance glutathione S-transferase expression in Arabidopsis but act as herbicides at higher concentrations [J].Journal of Plant Physiology,2010,167(8):643-649.
(責任编辑: 杨明丽)
