中国小麦品种抗条锈病现状及存在问题与对策
2018-12-05韩德俊康振生
韩德俊 康振生


摘要
小麦条锈病是小麦重大病害,利用抗病品种是防治小麦条锈病的有效措施。新中国成立以来,中国科学家们广泛开展了小麦条锈病防控方面的研究,并取得显著成绩。大量抗源被筛选、鉴定,但由于抗源自身农艺性状差等原因,能应用于小麦育种的抗源亲本非常少,抗源利用不合理,导致生产品种抗病基因单一,病原菌流行小种很快形成,抗病品种在生产上可利用的寿命太短。本文介绍了国内外抗条锈病基因发掘情况,以及我国小麦抗条锈病育种抗病基因使用概况,通过回述1B/1R(Yr9)和Yr24/Yr26抗源的兴衰周期,总结了抗源利用的教训和经验,探讨了我国小麦抗条锈病育种中存在的问题和今后抗病基因合理利用的发展方向。
关键词
小麦抗条锈育种; 抗病基因兴衰周期; 抗病品种持久利用策略
中图分类号:
S 435.121.42
文献标识码: A
DOI: 10.16688/j.zwbh.2018342
Current status and future strategy in breeding wheat for
resistance to stripe rust in China
HAN Dejun KANG Zhensheng2
(1. State Key Laboratory of Crop Stress Biology for Arid Areas, College of Agronomy, Northwest A & F
University, Yangling 712100, China; 2.State Key Laboratory of Crop Stress Biology for Arid Areas,
College of Plant Protection, Northwest A & F University, Yangling 712100, China)
Abstract
Wheat is an important staple food, which suffers considerable yield loss due to fungal foliar diseases like stripe rust caused by Puccinia striiformis West. f.sp. tritici Eriks. & Henn. (Pst). The management and sustainable control of the disease has been studied and great progress has been achieved since the founding of new China. Abundant resistance genes in wheat germplasms were identified. However, only a few race-specific resistance genes can be used for improving stripe rust resistance in commercially cultivars because of the undesirable agronomic traits or lack of efficient molecular markers. The mono-resistance gene in wheat varieties resulted in rapidly emerging new races of stripe rust pathogens and losing the R gene-mediated disease resistance of wheat cultivars.By retrospective historical events of “boom-bust cycle” of the resistance sources of 1B/1R (Yr9) and Yr24/Yr26, the over used resistance genes for stripe rust in China, the experiences and lessons were summarized. In addition, the strategies for durable (long-lasting) disease resistance are discussed.
Key words
breeding wheat for stripe rust resistance; boom-bust cycle of resistance gene; strategy for long-lasting resistance
小麦是世界性的粮食作物,为全球约35%~40%人口的主食[1]。中国是全球最大的小麦生产国和消费国,每年小麦种植面积在2 400万hm2左右,约占粮食作物总面積的1/4,常年总产量为1.3亿t左右,约占全球总产量的17%[2-3]。因此,小麦生产安全是关系国民经济发展、社会稳定和国家自立的重大战略问题。中国小麦生产虽已实现了历史性跨越,但随着气候变化影响的日益明显,极端温度、干旱和洪涝等灾害频繁发生,条锈病、赤霉病等多种病害日趋严重,化肥、农药过量使用导致农业生产成本较快上涨,同时造成环境污染。当前新形势下,农业生产发展面临提升产量和质量、降低成本和保护环境等多重挑战[4],如何实现粮食安全与资源利用、环境保护之间的平衡,提升农业可持续发展能力,是摆在面前的一项刻不容缓的战略议题。
1 条锈病严重威胁小麦安全生产
由条形柄锈菌小麦专化型Puccinia striiformis West. f.sp. tritici Eriks.& Henn.(Pst)引起的小麦条锈病,是世界性流行的真菌病害,危害我国广大麦区[5]。小麦条锈菌喜好冷凉潮湿环境,可通过高空气流远距离传播,随降雨或结露侵染小麦而引发病害。条锈病一般可造成 0.5% ~5%的产量损失,大流行可导致5%~25%的产量损失、甚至绝收。中国是世界上小麦条锈病最大的流行区域。新中国成立以来,小麦条锈病在中国每年均有不同程度的发生和危害,年均发生面积约400万 hm2。历史上小麦条锈病4次(1950年、1964年、1990年和2002年)大流行均导致100万t以上的产量损失,损失小麦总计约1 200万t,其中1950年条锈病造成的产量损失占全国小麦总产量的41.4%[6-7]。近年来,随着气候变化和耕作制度的调整,西北、华北和长江中下游等我国主产麦区,条锈病、赤霉病和白粉病等病害发生规律和发病范围也发生相应改变,多种病害交替发生,甚至同时发生[8-9]。因此,目前对小麦生产品种抗病性的要求也越来越高,有效防控小麦条锈病等病害,对确保小麦安全生产意义重大。
2 抗病品种是控制条锈病最为经济有效、绿色环保的措施
目前小麦条锈病的防治主要依靠化学农药和种植抗病品种两种途径。化学农药在病害应急防治中发挥了重要作用,但农药的不合理使用不仅导致了生产成本提高,还带来了环境污染问题[1,5,10]。大量研究与生产实践表明,培育、推广抗病小麦品种一直是最为经济有效且绿色环保的防控措施。
2.1 小麦条锈病抗源的发掘与抗性基因鉴定
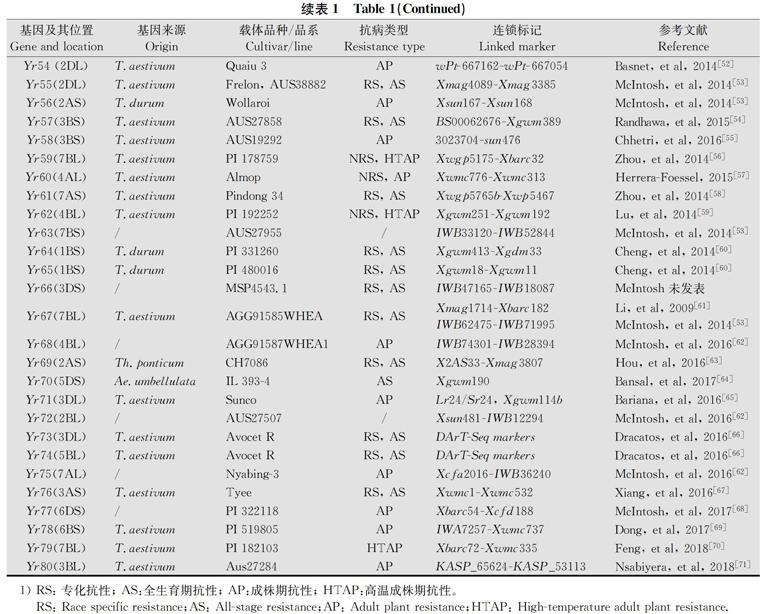
国内外在抗源收集、鉴定和新基因发掘等方面开展了大量研究,取得了一系列重要研究成果并应用于生产实践[5-13]。1962年,Lupton和Macer对7个小麦抗条锈病品种进行遗传分析,并首次采用Yr(yellow rust resistance)定名小麦抗条锈病基因,此后该命名一直沿用至今。截至2018年6月,国际上正式命名的抗条锈基因已有80个,即Yr1~Yr80[11-12]。这些抗条锈基因主要来源于普通小麦,还有一部分来自于小麦的近缘属种(表1)。目前已发现的基因中,绝大多数基因属于小种专化的全生育期抗性基因,少部分是成株期抗性基因如Yr11、Yr12、Yr13、Yr14、Yr16、Yr18、Yr29、Yr30、Yr34、Yr46、Yr48、Yr49、Yr58、Yr60、Yr68、Yr71、Yr75或高温成株期抗性基因(HTAP)如Yr36、Yr39、Yr52、Yr59、Yr62及QTL如Yr54、Yr77、Yr78、Yr79、Yr80。
表1 已被正式命名的抗条锈病基因1)
Table 1 Officially named stripe rust resistance genes
1) RS: 專化抗性; AS:全生育期抗性; AP:成株期抗性; HTAP:高温成株期抗性。
RS: Race specific resistance;AS: All-stage resistance;AP: Adult plant resistance;HTAP: High-temperature adult plant resistance.
2.2 小麦抗条锈病基因有效性评价
系统评估抗源和抗病基因的有效性,有助于为育种家提供精准的育种亲本选择信息,并结合病原菌流行小种动态变化趋势,开展预见性抗病育种。Zeng等[13]利用当前流行小种(CYR32、CYR33和CYR34)和陇南自然诱发病圃,对90份已知Yr基因的载体品种或单基因系材料进行抗病有效性评价。结果表明只有Yr5、Yr15、Yr61对当前中国所有条锈菌流行小种表现抗病,并建议这些基因应在我国条锈菌冬繁区应用,杜绝在越夏易变区使用;抗源‘周8425B虽然对3个流行小种具有全生育期抗性,但是在天水苗期和成株期都为感病,表明在自然界已经出现了对‘周8425B具有毒性的小种,这一抗源应限定区域利用以避免对其毒性小种的定向选择;Yr10、Yr24、Yr26虽然对CYR32和CYR33都具有较好抗病性,但对新小种CYR34(V26)在苗期和成株期均表现为感病,因此,这些基因今后应慎重使用; Yr32、YrTr1和YrTye(=Yr76)基因具有较强的成株期抗病性,可在适宜地区使用;Yr11、Yr12、Yr13、Yr14、Yr16、Yr17、Yr18等表现为成株期部分抗病性,建议与其他Yr基因聚合使用。其他Yr基因Yr1、Yr2、Yr6、Yr7、Yr8、Yr9、Yr21、Yr27、Yr28、Yr29、Yr31、Yr36、Yr39、Yr41、Yr43、Yr44、YrA、YrExp2和YrSP等,不具有单独使用价值,宜通过基因聚合后利用。值得关注的是,Yr基因组合利用对条锈菌有非常好的抗性效果,如,携带不同Yr基因组合的抗源:Ibis(Yr1+Yr2)、Maris Huntsman(Yr2+Yr3a+Yr4a+Yr13)、Mega(Yr3a+Yr4a+Yr12)、Lee(Yr7+Yr22+Yr23)、Compare(Yr8+Yr19)、Hobbit(Yr14+YrHⅦ)、Hyak(Yr17+YrTye)、HyakCarstensV(YrCV1+YrCV2+YrCV3)及Express(YrExp1+YrExp2)等,都表现出非常好的成株期抗病性。其他Yr基因,如Yr46、Yr48、Yr50、Yr52、Yr59、Yr62、Yr69等对中国小麦条锈菌有成株期抗性[13,58,72]。
3 病原菌毒性变异导致抗病品种丧失生产利用价值
诺贝尔奖得主诺曼·博劳格(Norman Borlaug)有一句经典名言“Rust never sleeps”(锈菌永不眠),告诫大家要时刻警惕锈菌新小种的出现。早期研究认为,小麦条锈菌通过突变和异核作用,致使其致病性变异。2010年,美国学者Jin通过室内人工接种的方法,发现小檗Berberis chinensis可作为小麦条锈菌的转主寄主[73]。本团队研究表明:小檗在我国种类多、分布广;自然条件下可以作为条锈菌转主寄主,完成有性生殖[74];小檗在条锈菌毒性变异、新小种形成和病害流行中具有特殊作用;有性生殖是条锈菌毒性变异的主要途径;转主寄主小檗的广泛分布与有性生殖的常年发生是我国条锈菌“易变区”形成的主要原因[5, 74-75]。
对于专性寄生性病害体系来讲,病原菌与寄主间相互施加选择压力,始终进行着病原物致病基因和寄主抗病基因遗传迭代(genetic iteration)的协同进化(co-evolution)[76-77]。在现代农业生产中,如果大规模使用同一抗源,将有利于促成优势小种的形成。由于条锈菌致病性变异频繁,新致病小种不断出现,常导致小麦抗病品种“丧失”其抗条锈性,而失去利用价值[78-81]。一般情况下,小麦品种在生产上使用 3~5 年便“丧失” 其抗锈性。历史资料表明,我国小麦条锈菌新毒性小种的产生和流行,都是与小麦抗病品种(基因)的不合理利用“相伴而生”的[5-8](表2)。
表2 中国小麦主要抗病品种(Yr基因)抗病性“丧失”与条锈菌新小种更替
Table 2 The iteration of elite wheat cultivars(Yr genes)vs the emerging races of stripe rust
4 中国小麦品种抗条锈病水平和抗源使用
4.1 小麦主栽品种和后备品种抗病性水平
全面了解我国小麦品种抗条锈病水平,不仅为当前小麦条锈病预测预报和精准防控提供准确信息,而且可为开展预见性小麦抗病育种和抗病基因布局提供依据。自2008年以来,本实验室依托国家小麦产业技术体系,每年征集全国各个麦区的小麦品种及育种高代系材料进行苗期和成株期多地点的抗病性评估。韩德俊等[9]和Zeng等[72]对2003-2008年期间的主栽品种(330份)和高代育种材料(194份)进行了抗病性鉴定,结果显示只有16份材料(3.2%)为全生育期抗性,99份(20.0%)和28份(5.7%)分别表现成株期抗性和慢锈性,351份呈现感病(71.1%)。薛文波等[82]对全国74个主栽小麦品种抗条锈性鉴定,结果表明,当前主栽小麦品种几乎没有全生育期抗病品种,仅有4个成株期抗病品种,另外有10个品种仅在成株期表现为中感-中抗水平;其余60 个品种苗期和成株期都高度感病。本实验室对2013-2017年期间全国1550余份小麦高代系材料鉴定结果表明,对当前主要流行小种(CYR32、CYR33和CYR34)具有全生育期抗病材料仅51份,占3.3%;成株期抗锈性110份,占7.1%;其余1 300余份材料都表现为不同程度感病,占89.6%。整体评价认为,在过去的十几年中,我国小麦感病品种比例高达80%左右,不同麦区间存在差异,甘肃、四川等条锈病常发区小麦品种抗病性整体好于东部麦区,高代系材料和后备品种的抗病性整体好于当前主栽品种,全生育期抗病品种仍然严重不足,特别是苗期发病严重的陇南和川西北地区小麦品种,具有全生育期抗病性的品种不足5%。由此看来,依赖药剂防治秋季和早春条锈病的现状,在较长时间内不会有明显改变。
4.2 小麦品种(系)抗病基因利用情况
尽管如前文所述,国内外目前已定位出80余个抗条锈病基因和近200余个抗病QTLs,但可用于小麦育种的仍只是少数几个基因/QTL,如Yr1、Yr5、Yr9、Yr10、Yr15、Yr17、Yr18、Yr24/26等。周阳等[83]对179份20世纪80年代的主栽小麦品种(系)鉴定发现,38%的材料都含有1BL/1RS(即携带Yr9),尤以北方麦区和黄淮麦区各占59%和42%;李在峰[84]利用基因推导,对全国145份小麦品种(系)进行Yr基因分析发现,Yr9(43%)和Yr26(20%)是利用率最高的抗条锈病基因,其他Yr基因较少应用。
本实验室利用分子筛查并结合抗病性鉴定和系谱分析的方法,对2010年以来超过2 000份来自不同麦區的小麦品种和高代系进行抗病基因分析[9, 72, 82, 85-86],结果表明,在抗病材料中(约占总数10%):超过30%的抗病材料可能含有Yr26;22%可能含Yr9;3%可能含Yr17。其中少数几份抗病材料,可能是几个已知基因的聚合结果,如:Yr9+Yr17,Yr26+ Yr18(或其他未知微效Yr基因)。未发现含Yr5、Yr10、Yr15的材料。不同麦区对抗病基因使用虽有一定差别,但在主效基因使用上差别不大:如陇南核心越夏区[9]和四川盆地冬繁区[85-86],最重要的抗病基因都是Yr26和Yr9,特别是携带Yr26的品种频率都超过30%,在生产中这些品种累计播种面积都超过当地小麦播种面积的50%,为相应毒性的小种(V26致病类群)的定向选择提供了充足的哺育品种[85]。
5 抗源应用中存在的问题与对策
5.1 系统开展抗源核心亲本定向改良,打通抗源创制与抗病品种培育的中间环节
经过多年努力,筛选创制的小麦条锈病抗源虽然不少,如Yr5、Yr15和Yr61等,但多数抗源来自农家种、国外种质以及远缘杂交的衍生后代。由于综合农艺性状较差,难以作为亲本直接用于小麦品种改良,因此在育种中好用并发挥重要作用的抗源极少。迫切需要植病学家与育种家协作,系统开展育种亲本材料的创制和持续改良的前育种工作(pre-breeding),创造携带一系列已知抗病基因或基因组合的核心亲本材料(elite lines),同时开发相关Yr基因的辅助选择标记,着重创造抗病性状优异、综合性状好且有极高的配合力,在育种上“能用”且“好用”的抗源核心亲本,既增加抗病基因的多样性,又要提高抗源的可用性。同时要改革科研工作的评价机制,对从事定向改造创制核心中间材料的科研人员,在成果认可和利益分配方面,给予保护和长期支持。
5.2 抗病基因的“兴衰周期”与持久利用
由于丰产性、生育期和适应性等表现较差,很多抗源或Yr-基因的载体品种不被育种家青睐。然而一旦有好用的抗源亲本,育种家们又会争先使用,短时期就能创制大量具有同一个Yr-基因的抗病品种,并广泛推广种植(boom),其结果导致在病原菌群体中,有匹配毒性的菌株被选择,并随着哺育品种的面积增加而壮大,最终形成流行小种,致使抗病性被克服而丧失利用价值(bust),完结抗源的兴衰循环周期(boom-bust cycle)[79, 81, 87]。携带Yr9的1B/1R抗源和携带Yr26的92R系和贵农系抗源的兴衰经历,阐释了抗源/抗病基因利用的规律与教训,为今后抗病基因合理使用提供借鉴。
20世纪20-30年代,两个德国的育种项目用同一个冬黑麦品种(‘Petkus)与小麦杂交和复交,分别独立获得属间1B(1R)异代换系‘Salzmunder14/44和‘Zorba,20世纪40年代,在‘Salzmunder14/44基础上衍生‘牛朱特(Neuzucht,意为新品种)[88]。由于该1RS染色体携带一个抗病基因复合体(resistance gene complex)Pm8/ Yr9/ Lr26/ Sr31,对锈病和白粉病都具有良好抗性,且有较好的丰产性和适应性,因此,这两个1B(1R)异代换系于20世纪50年代在世界多地快速传播和利用。‘牛朱特及其衍生后代在前苏联和罗马尼亚等东欧国家利用,并于20世纪60-70年代培育了‘阿夫乐尔(Avrora)、‘高加索(Kavkaz)、‘早熟35(Skorospe1Ra 35)、‘山前麦2号(Predgornaya 2)、‘洛夫林(Lovrin)等一系列1B/1R易位系品种;而‘Zorba主要用于西欧国家[88-89]。
20世纪70年代初期,‘洛夫林等一大批1B/1R易位系的抗病品种被引入中国,在甘、川、陕、青、晋、冀、鲁、鄂、滇、黔等多地小麦生产和育种中同时扮演重要角色[6, 8]。在西北麦区,‘洛夫林10和‘洛夫林13等一批“洛类”抗源于1973 年引入陇南地区, 不仅作为亲本材料, 而且直接用于生产, 在高山小麦区和川道麦区都有分布[91-93]。不幸的是,仅仅两三年后,即1975-1976年,‘洛夫林10和‘洛夫林13分别出现零星病株[92-93],随后病情逐年加重,1978-1979年病株反应型(IT)达到7~8[93],1980-1981年,在陇南各地两个品种都有发病[92-95],联合考察表明,洛夫林抗源在陇南已普遍感病,丧失了抗条锈能力[91-94]。20世纪80年代中后期,源自‘洛夫林10和‘洛夫林13两个致病类群中,各有一个优势小种形成,即条中28号和条中29号流行小种。另一方面,20世纪80年代初期, 在中国很多育种单位,分别以来源不同1B/1R易位系为抗源亲本培育了大量抗病品种,如‘矮孟牛(‘鲁麦1号)、‘鲁麦8号、‘鲁麦11 号、‘陕农7859、‘丰抗15号等,并在全国范围大面积推广种植[5-6, 8]。西部麦区产生了针对Yr9的新流行小种(CYR28和CYR29)和全国广大麦区普遍使用携带Yr9的抗病小麦品种,致使1990年条锈病在全国范围内大发生,给小麦生产造成极大损失。
回述洛类抗源兴衰,总结教训有两个:其一,以‘洛夫林10和‘洛夫林13为代表的1B/1R抗源(携带Yr9)被直接应用于条锈菌核心易变区(陇南和川西北)的小麦生产,Yr9介导所谓“抗病品种”推广面积激增,仅仅两三年时间就“筛选”出对Yr9有毒性的菌株,并迅速定向选择和适应性进化,形成了条中28和条中29为主的流行小种;其二,同一个黑麦品种与小麦远缘杂交衍生的若干抗病材料,其主效抗病基因只有一个,即Yr9,这些名称不同的抗源几乎同时涌入中国不同麦区,培育出大量抗病基因同质的“抗病品种”,为新小种主导的病害大区流行提供了“感病品种”。
Yr26的兴衰循环正在进行之中。刘大钧等于20世纪80年代创制了小麦-簇毛麦代换系(6A/6V)和易位系(6DL/6VS)材料,在此基础上逐步衍生出‘92R137、‘92R149、‘92R178等“92R”系抗源[96]。几乎同期,贵州大学张庆勤等利用小麦-簇毛麦远缘杂交后代创制了‘贵农21、‘贵农22等“贵农”系抗源[97]。92R系和贵农系抗源都是兼抗白粉病和条锈病,后续研究表明,它们都是携带抗条锈病基因Yr26[98-99]和抗白粉病基因Pm21。由于在抗条锈病和抗白粉病中的良好表现,两者于20世纪90年代中后期被广泛应用于四川盆地和甘肃南部麦区。与此同时,四川省农业科学院从国际玉米小麦改良中心(CIMMYT)引进了高抗条锈的硬粒小麦-节节麦人工合成材料,育成了‘川麦42等一批抗病品种[100]。Li等[101]通过抗病基因等位性分析,认为‘川麦42携带的抗病基因YrCH42即是来自硬粒小麦的Yr24,与Yr26是等位基因[102]。由于优良抗病性和丰产性,以‘川麦42及92R系和贵农系抗源为亲本,又衍生系列抗病品种,如:‘绵麦38、‘绵麦40、‘绵麦41、‘绵麦42、‘绵麦43、‘绵麦46、‘绵麦47、‘绵麦48和‘绵麦1403等;‘西科麦3号和‘西科麦5号;‘科成麦1号和‘科成麦2号;以及‘中麦415、‘襄麦55、‘偃育898等品种及数十份高代品系[85] ,分别应用在陇南和川西北麦区。携带相同抗病基因(Yr24/26/CH42)的众多小麦品种,同时在陇南“越夏易变区”和四川盆地“冬繁区”广泛种植,导致V26/G22致病类型在短时间内产生并迅速蔓延[85, 103]。惨痛教训是,Yr24/26/CH42抗源无序地过度利用,导致由兴至衰仅仅十几年。另外,新发掘的主效抗病基因该不该应用于条锈菌易变区的小麦育种和生产,值得我们再思考。
一个现象值得关注,虽然Yr9于20世纪90年代初即被克服,但该基因不仅没有立刻退出中麦育种历史舞台,且在过去的30多年中,中国小麦品种1B/1R的频率一直居高不下, 如周阳报道,中国北部冬麦区、黄淮麦区、长江中下游麦区和西南麦区,2000年前后小麦品种(系)中,1BL/1RS 易位系分布频率分别为48.0%~54.0%、40.0%~50.4%、20.0%~6.9%和21.0%~34.6%[83],曹廷杰等对2009-2013年度河南育成的908个小麦新品种(系)分析发现,超过60%为1B/1R易位系[104]。推测其原因:一是1B/1R携带的其他一些有益基因可满足小麦性状改良,使Yr9被动选择而保留下来;二是Yr9仍具有残余抗病性使其仍具有利用的价值;三是当前小麦品种1B/1R频率居高的结论是基于1B/1R易位系特异标记的分子检测而获得的,然而,2000年以来,不断有新型1B/1R易位系引入中国小麦育种进程,新型1B/1R易位系可能携带抗条锈新基因,抑或是Yr9不同的等位基因。不论是哪种原因,对已有抗病基因利用價值的深度发掘和持续利用的探讨是有必要的。Yr9是否具有残余抗病性仍需持续观察和评估。本团队研究发现,Yr9与其他Yr基因聚合,如Yr9+Yr17或Yr9+Yr18,都能增强品种抗病性。这是否意味着抗病基因不存在“失效”问题,而是如何合理使用,如通过基因聚合实现主效抗病基因的持久利用[105]。
5.3 抗病基因使用具有盲目性和随意性,需加强基因布局意识和规划
抗病基因(品种)的合理布局(gene deployment),是将具有不同抗病基因的品种在大区范围实行合理使用,从空间和时间上阻止病菌新小种的定向选择和发展[106]。对流行区系的不同关键地区,如越夏易变区、传播桥梁区、越冬区和流行区等分别种植具有不同抗病基因的品种,阻止病菌的越夏、越冬和流行传播。国内抗病基因布局的应用还处于起步阶段,目前我国可资利用的抗病基因还很少,在关键流行区布局不同抗病类型的基因始终未能实现。尤其严重的是,对目前有限的抗病基因资源的使用,如Yr5、Yr15和Yr61等,没有布局意识和整体规划,仅凭育种家的喜好和本地育种目标需求。
陇南地区是我国小麦条锈菌最重要的“核心越夏易变区”,是秋季菌源基地和新小种策源地,因此在条锈病综合防控中具有重要地位[5-7]。该区小麦品种的抗病基因群体结构和多样性动态在一定程度上决定着条锈菌的群体演化,影响新小种的定向选择[81]。为了在全国范围持久控制条锈病,必须减缓“易变区”新毒性小种产生的速率,否则,一切成功的病害控制都是暂时的。由于该区条锈菌毒性结构复杂,遗传多样性异常丰富[75],理论上任何一个抗病基因,迟早都会出现一个与之匹配毒性的条锈菌菌株,并随着携带该基因抗病品种的扩大利用,将可能定向选择形成流行小种。如,携带Yr26的‘92R系和‘贵农系抗源,20世纪90年代后期用于陇南小麦育种,2003年后,逐步选育出‘兰天17等多个抗病品种,并应用于当地生产,2007年秋季,在‘兰天17品种上,我们已经分离获得了Yr26的毒性菌株(V26),2012年,V26致病类群的频率已超过10%[85]。因此,新发掘的抗病基因尽量避免在“易变区”使用。
四川盆地是中国小麦条锈菌重要的“冬繁区”,其冬季小麦始终保持生长,为条锈菌大量繁殖提供了机会,条锈菌可“定居”在同一品种上持续发生多次自侵染循环(polycyclic disease with autoinfection)[86],一方面强化了病原菌适应性进化,另一方面,小麦品种依据其所携带Yr基因,使与之有匹配毒性的条锈菌小种得以“选择性”放大增殖,此后又作为春季输出菌源随气流向东部麦区传播,导致更大规模的条锈病流行。因此,输出的菌源群体结构和菌源量对春季条锈病大区流行有关键性影响。冬繁区小麦品种应具有苗期抗病性,因此应使用全生育期抗病基因,且所用主效Yr基因必须有别于陇南越夏易变区[9]。然而从目前基因分布上来看,当地主栽品种,‘川麦42、‘内麦8号、‘内麦9号、‘绵麦37等(种植面积累计约占当地小麦播种面积65%~70%),都携带Yr26基因,虽然对条锈菌主要流行小种CYR32和CYR33表现出较高抗病性,但对条锈菌新致病类型CYR34在苗期,甚至成株期都表现感病[82]。这意味着,在条锈菌冬繁区,每年至少20万hm2小麦可作為新毒性小种V26的哺育品种。一旦环境条件适宜,条锈病害大流行,就会对我国小麦生产造成严重损失。
6 展望
育种是农业可持续发展战略的重要部分[1]。由于病原菌的多样性及其持续的演化,小麦抗病育种不仅重要且无法终止[107]。然而在现代小麦育种目标中,抗病性不总是优先考虑的性状,抗病育种可能会削弱在丰产、优质和农艺适应性等方面改良的努力[108]。因此,抗源的筛选与鉴定、抗病基因的发掘与操作、抗病品种的培育与合理使用,不同层级的研究要贯通并整体推进,而且始终要关注抗病性与其他性状的协调性,否则再好的抗源或抗病基因也很难成为抗病品种。随着抗条锈病新基因/QTLs不断发掘,不仅为深入了解小麦抗条锈病遗传基础,制定抗病育种新策略提供了依据,同时为抗病品种的培育奠定了材料基础。随着SNP等分子标记的大量开发,小麦染色体上的分子标记密度增加,QTL定位也较之前更为准确,使利用分子标记进行辅助选择育种成为可能。基因组技术极大地增强了遗传分析和作物改良的能力,大规模测序技术为更好地了解种质资源遗传多样性结构,解析抗性与丰产性、优质和资源高效利用等性状的协调性,为分子设计育种和全基因组选择提供依据[109]。通过基因聚合等手段,培育兼抗多种病害的小麦品种,建立农业投入安全无害、生产过程环境友好的农业绿色发展技术体系具有重要实践价值。
持久抗病性是小麦重要的育种目标,但至关重要的是,可持续抗病性问题不能简单地作为一个育种问题来处理。通过对条锈菌“易变区”转主寄主小檗的有效治理等综合措施,降低病原菌遗传变异几率;通过小麦与其他作物间作、混作,不同抗病品种轮换使用等农业措施,减少病原体的进化速率[110];通过不同Yr基因遗传多样性利用和基因布局[106, 110],减小对毒性小种的定向选择压力,避免流行小种的形成和发展[108]。因此,寄主多样化既是育种的重要补充,也是育种家需要考虑的重要背景因素。
参考文献
[1] TESTER M, LANGRIDGE P. Breeding technologies to increase crop production in a changing world [J].Science, 2010, 327(5967): 818-822.
[2] 何中虎,庄巧生,程顺和,等.中国小麦产业发展与科技进步[J].农学学报,2018,8(1):99-106.
[3] 刘志勇,王道文,张爱民,等.小麦育种行业创新现状与发展趋势[J].植物遗传资源学报,2018,19(3):430-434.
[4] CUI K, SHOEMAKER S P. A look at food security in China[J/OL]. Science of Food, 2018, 2:4 doi:10.1038/ s41538-018-0012-x.
[5] 康振生,王曉杰,赵杰,等.小麦条锈菌致病性及其变异研究进展[J].中国农业科学,2015,48(17):3439-3453.
[6] 李振岐,曾士迈.中国小麦锈病[M].北京:中国农业出版社,2002:370-373.
[7] 陈万权,康振生,马占鸿,等.中国小麦条锈病综合治理理论与实践[J].中国农业科学,2013,46(20):4254-4262.
[8] 庄巧生.中国小麦品种改良及系谱分析[M].北京:中国农业出版社,2003:421-444.
[9] 韩德俊,王琪琳,张立,等.“西北-华北-长江中下游”条锈病流行区系当前小麦品种(系)抗条锈病性评价[J].中国农业科学,2010,43(14):2889-2896.
[10] BROWN J, HOVMOLLER M S. Epidemiology-aerial dispersal of pathogens on the global and continental scales and its impact on plant disease [J]. Science, 2002, 297(5581): 537-541.
[11] WU Jianhui, HANG Shuo, ZENG Qingdong, et al. Comparative genome-wide mapping versus extreme pool-genotyping and development of diagnostic SNP markers linked to QTL for adult plant resistance to stripe rust in common wheat [J]. Theoretical and Applied Genetics, 2018,131:1777-1792.
[12] MCINTOSH R A, DUBCOVSKY J, ROGERS J, et al. Catalogue of gene symbols for wheat: 2017 Supplement[J/OL].[2018-08-01].http:∥www.shigen.nig.ac.jp/wheat/komugi/genes/macgene/supplement2017.pdf.
[13] ZENG Qingdong, SHEN Chuan, YUAN Fengping, et al. The resistance evaluation of the Yr genes to the main prevalent pathotypes of Puccinia striiformis f. sp. tritici in China [J]. Acta Phytopathologica Sinica, 2015,45:641-650.
[14] LUPTON F G H, MACER R C F. Inheritance of resistance to yellow rust (Puccinia glumarum Erikss., and Henn.) in seven varieties of wheat [J]. Transactions of the British Mycological Society, 1962, 45(1): 21-45.
[15] MACER R C F. The formal and monosomic genetic analysis of stripe rust (Puccinia striiformis) resistance in wheat[C]∥MACKEY J. Proceedings of the 2nd International Wheat Genetics Symposium. 19-24 August 1963, Lund, Sweden. Hereditas 2(Suppl.),1966: 127-142.
[16] RILEY R, CHAPMAN V, JOHNSON R. The incorporation of alien disease resistance in wheat by genetic interference with the regulation of meiotic chromosome synapsis[J]. Genetical Research, 1968, 12: 713-715.
[17] MACER R C F. Plant pathology in a changing world [J]. Transactions of the British Mycological Society, 1975, 65: 351-374.
[18] MCINTOSH R A. Catalogue of gene symbols for wheat [M]∥MILLER T E, KOEBNER R M D. Proceedings of the 7th International Wheat Genetics Symposium. 14-19 July 1988, Cambridge, UK. Institute of Plant Science Research, Cambridge, UK. 1988:1225-1323.
[19] GERECHTER-AMITAI Z K, VAN SILFHOUT C H, GRAMA A, et al. Yr15 -a new gene for resistance to Puccinia striiformis in Triticum dicoccoides sel. G-25[J]. Euphytica, 1989, 43: 187-190.
[20] WORLAND A J, LAW C N. Genetic analysis of chromosome 2D of wheat. I. The location of genes affecting height, day-length insensitivity, hybrid dwarfism and yellow rust resistance [J]. Pflanzenzücht, 1986, 96: 331-345.
[21] BARIANA H S, MCINTOSH R A. Cytogenetic studies in wheat. XIV. Location of rust resistance genes in VPM1 and their genetic linkage with other disease resistance genes in chromosome 2A [J]. Genome, 1993, 36: 476-482.
[22] SINGH R P. Genetic association of leaf rust resistance gene Lr34 with adult-plant resistance to stripe rust in bread wheat[J]. Phytopathology, 1992, 82: 835-838.
[23] CHEN X M, LINE R F. Gene number and heritability of wheat cultivars with durable, high-temperature, adult-plant resistance and race-specific resistance to Puccinia striiformis [J]. Phytopathology, 1995, 85: 573-578.
[24] MCINTOSH R A, LAGUDAH E S. Cytogenetical studies in wheat. XVIII. Gene Yr24 for resistance to stripe rust[J]. Plant Breeding, 2000, 119: 81-83.
[25] CALONNEC A, JOHNSON R, DE VALLAVIEILLE-POPE C. Genetic analyses of resistance of the wheat differential cultivars Carstens V and Spaldings prolific to two races of Puccinia striiformis [J]. Plant Pathology, 2002, 51: 777-786.
[26] MA Jianxin, ZHOU Ronghua, DONG Yushen, et al. Molecular mapping and detection of the yellow rust resistance gene Yr26 in wheat transferred from Triticum turgidum L. using microsatellite markers [J]. Euphytica,2001, 120: 219-226.
[27] MCDONALD D B, MCINTOSH R A, WELLINGS C R, et al. Cytogenetical studies in wheat. XIX. Location and linkage studies on gene Yr27 for resistance to stripe (yellow) rust [J]. Euphytica, 2004, 136: 239-248.
[28] SINGH R P, NELSON J C, SORRELLS M E. Mapping Yr28 and other genes for resistance to stripe rust in wheat [J]. Crop Science, 2000, 40: 1148-1155.
[29] WILLIAM M, SINGH R P, HUERTA-ESPINO J, et al. Molecular marker mapping of leaf rust resistance gene Lr46 and its association with stripe rust resistance gene Yr29 in wheat [J]. Phytopathology, 2003, 93(2): 153-159.
[30] SINGH R P, WILLIAM H M, HUERTA-ESPINO J, et al. Identification and mapping of gene Yr31 for resistance to stripe rust in Triticum aestivum cultivar Pastor [C]∥Proceedings of the 10th International Wheat Genetics Symposium, 2003: 1-6.
[31] ERIKSEN L, AFSHARI F, CHRISTIANSEN M J, et al. Yr32 for resistance to stripe (yellow) rust present in the wheat cultivar Carstens V[J]. Theoretical and Applied Genetics, 2004, 108: 567-575.
[32] ZAHRAVI M, BARIANA H S, SHARIFLOU M R, et al. Bulk segregant analysis of stripe rust resistance in wheat (Triticum aestivum) using microsatellite markers [C]∥ POGNA N E, ROMANO M, POGNA E A, et al. Proceedings of 10th International Wheat Genetics Symposium,2003:861-863.
[33] BARIANA H S, PARRY N, BARCLAY I R, et al. Identification and characterization of stripe rust resistance gene Yr34 in common wheat [J]. Theoretical and Applied Genetics, 2006, 112(6): 1143-1148.
[34] MARAIS G F, PRETORIUS Z A, MARAIS A S, et al. Transfer of rust resistance genes from Triticum species to common wheat [J]. South African Journal of Plant and Soil, 2003, 20(4): 193-198.
[35] UAUY C, BREVIS J C, CHEN X, et al. High-temperature adult-plant (HTAP) stripe rust resistance gene Yr36 from Triticum turgidum ssp. dicoccoides is closely linked to the grain protein content locus Gpc-B1[J]. Theoretical and Applied Genetics, 2005, 112(1): 97-105.
[36] MARAIS G F, MCCALLUM B, SNYMAN J E, et al. Leaf rust and stripe rust resistance genes Lr54 and Yr37 transferred to wheat from Aegilops kotschyi [J]. Plant Breeding, 2005, 124(6): 538-541.
[37] MARAIS G F, MCCALLUM B, MARAIS A S. Leaf rust and stripe rust resistance genes derived from Aegilops sharonensis [J]. Euphytica, 2006, 149(3): 373-380.
[38] LIN F, CHEN X M. Genetics and molecular mapping of genes for race-specific all-stage resistance and non-race-specific high-temperature adult-plant resistance to stripe rust in spring wheat cultivar Alpowa [J]. Theoretical and Applied Genetics, 2007, 114(7): 1277-1287.
[39] KURAPARTHY V, CHHUNEJA P, DHALIWAL H S, et al. Characterization and mapping of cryptic alien introgression from Aegilops geniculata with new leaf rust and stripe rust resistance genes Lr57 and Yr40 in wheat [J]. Theoretical and Applied Genetics, 2007, 114(8): 1379-1389.
[40] LUO P G, REN Z L, ZHANG H Q, et al. Identification, chromosome location, and diagnostic markers for a new gene (YrCN19) for resistance to wheat stripe rust [J]. Phytopathology, 2005, 95(11): 1266-1270.
[41] MARAIS F, MARAIS A, MCCALLUM B, et al. Transfer of leaf rust and stripe rust resistance genes Lr62 and Yr42 from Aegilops neglecta Req. ex Bertol. to common wheat [J]. Crop Science, 2009, 49(3): 871-879.
[42] CHENG P, CHEN X M. Molecular mapping of a gene for stripe rust resistance in spring wheat cultivar IDO377s[J]. Theoretical and Applied Genetics, 2010, 121(1): 195-204.
[43] SUI X X, WANG M N, CHEN X M. Molecular mapping of a stripe rust resistance gene in spring wheat cultivar Zak[J]. Phytopathology, 2009, 99(10): 1209-1215.
[44] LI Q, CHEN X M, WANG M N, et al. Yr45, a new wheat gene for stripe rust resistance on the long arm of chromosome 3D [J]. Theoretical and Applied Genetics, 2011, 122(1): 189-197.
[45] HERRERA-FOESSEL S A, LAGUDAH E S, HUERTA-ESPINO J, et al. New slow-rusting leaf rust and stripe rust resistance genes Lr67 and Yr46 in wheat are pleiotropic or closely linked [J]. Theoretical and Applied Genetics, 2011, 122(1): 239-249.
[46] BANSAL U K, FORREST K L, HAYDEN M J, et al. Characterisation of a new stripe rust resistance gene Yr47 and its genetic association with the leaf rust resistance gene Lr52 [J]. Theoretical and Applied Genetics, 2011, 122(8): 1461-1466.
[47] LOWE I, JANKULOSKI L, CHAO S, et al. Mapping and validation of QTL which confer partial resistance to broadly virulent post-2000 North American races of stripe rust in hexaploid wheat [J].Theoretical and Applied Genetics,2011,123(1): 143-157.
[48] LIU Jie, CHANG Zhijian, ZHANG Xiaojun, et al. Putative Thinopyrum intermedium-derived stripe rust resistance gene Yr50 maps on wheat chromosome arm 4BL [J]. Theoretical and Applied Genetics, 2013, 126(1): 265-274.
[49] RANDHAWA M, BANSAL U, VALARIK M, et al. Molecular mapping of stripe rust resistance gene Yr51 in chromosome 4AL of wheat [J]. Theoretical and Applied Genetics, 2014, 127(2): 317-324.
[50] REN R S, WANG M N, CHEN X M, et al. Characterization and molecular mapping of Yr52 for high-temperature adult-plant resistance to stripe rust in spring wheat germplasm PI 183527 [J]. Theoretical and Applied Genetics, 2012, 125(5): 847-857.
[51] XU L S, WANG M N, CHENG P, et al. Molecular mapping of Yr53, a new gene for stripe rust resistance in durum wheat accession PI 480148 and its transfer to common wheat[J]. Theoretical and Applied Genetics, 2013, 126(2): 523-533.
[52] BASNET B R, SINGH R P, IBRAHIM A M H, et al. Characterization of Yr54 and other genes associated with adult plant resistance to yellow rust and leaf rust in common wheat Quaiu 3 [J]. Molecular Breeding, 2014, 33(2): 385-399.
[53] MCINTOSH R A, DUBCOVSKY J, ROGERS J W, et al. Catalogue of gene symbols for wheat: 2013-14 Supplement[M]∥Annual wheat newsletter, 2014:58.
[54] RANDHAWA M S, BARIANA H S, MAGO R, et al. Mapping of a new stripe rust resistance locus Yr57 on chromosome 3BS of wheat [J]. Molecular Breeding, 2015, 35(2):65.
[55] CHHETRI M, BARIANA H, KANDIAH P, et al. Yr58: A new stripe rust resistance gene and its interaction with Yr46 for enhanced resistance [J].Phytopathology,2016,106:1530-1534.
[56] ZHOU Xinli, WANG Meinan, CHEN Xianming, et al. Identification of Yr59 conferring high-temperature adult-plant resistance to stripe rust in wheat germplasm PI 178759 [J]. Theoretical and Applied Genetics, 2014, 127(4): 935-945.
[57] HERRERA-FOESSEL S A, SINGH R P, LAN C X, et al. Yr60, a gene conferring moderate resistance to stripe rust in wheat [J]. Plant Disease, 2015, 99(4): 508-511.
[58] ZHOU X L, HAN D J, CHEN X M, et al. Characterization and molecular mapping of stripe rust resistance gene Yr61 in winter wheat cultivar Pindong 34 [J]. Theoretical and Applied Genetics, 2014, 127(11): 2349-2358.
[59] LU Yan, WANG Meinan, CHEN Xianming, et al. Mapping of Yr62 and a small-effect QTL for high-temperature adult-plant resistance to stripe rust in spring wheat PI 192252 [J]. Theoretical and Applied Genetics, 2014, 127(6): 1449-1459.
[60] CHENG P, XU L S, WANG M N, et al. Molecular mapping of genes Yr64 and Yr65 for stripe rust resistance in hexaploid derivatives of durum wheat accessions PI 331260 and PI 480016 [J]. Theoretical and Applied Genetics, 2014, 127(10): 2267-2277.
[61] LI Y, NIU Y C, CHEN X M. Mapping a stripe rust resistance gene YrC591 in wheat variety C591 with SSR and AFLP markers[J]. Theoretical and Applied Genetics, 2009, 118(2): 339-346.
[62] MCINTOSH R A, DUBCOVSKY J, ROGERS J, et al. Catalogue of gene symbols for wheat: 2016 Supplement [J/OL].[2018-08-01].http:∥www.shigen.nig.ac.jp/wheat/komugi/genes/macgene/supplement2015-2016.pdf. 2016.
[63] HOU L, JIA J, ZHANG X, et al. Molecular mapping of the stripe rust resistance gene Yr69 on wheat chromosome 2AS[J]. Plant Disease, 2016, 100(8): 1717-1724.
[64] BANSAL M, KAUR S, DHALIWAL H S, et al. Mapping of Aegilops umbellulata-derived leaf rust and stripe rust resistance loci in wheat [J].Plant Pathology,2017,66(1): 38-44.
[65] BARIANA H, FORREST K, QURESHI N, et al. Adult plant stripe rust resistance gene Yr71 maps close to Lr24 in chromosome 3D of common wheat [J/OL]. Molecular Breeding, 2016, 36(7):98. https:∥doi.org/10.1007/s11032-016-0528-1.
[66] DRACATOS P M, ZHANG P, PARK R F, et al. Complementary resistance genes in wheat selection ‘Avocet R confer resistance to stripe rust [J]. Theoretical and Applied Genetics, 2016, 129(1): 65-76.
[67] XIANG C, FENG J Y, WANG M N, et al. Molecular mapping of stripe rust resistance gene Yr76 in winter club wheat cultivar Tyee [J].Phytopathology,2016,106(10):1186-1193.
[68] MCINTOSH R A, DUBCOVSKY J, ROGERS J, et al. Catalogue of gene symbols for wheat: 2017 Supplement [EB/OL].[2018-08-01].http:∥www.shigen.nig.ac.jp/wheat/komugi/genes/macgene/supplement2017.pdf. 2017.
[69] DONG Z, HEGARTY J M, ZHANG J, et al. Validation and characterization of a QTL for adult plant resistance to stripe rust on wheat chromosome arm 6BS (Yr78)[J]. Theoretical and Applied Genetics, 2017, 130(10): 2127-2137.
[70] FENG J, WANG M, SEE D R, et al. Characterization of novel gene Yr79 and four additional quantitative trait loci for all-stage and high-temperature adult-plant resistance to stripe rust in spring wheat PI 182103 [J].Phytopathology,2018,108(6):737-747.
[71] NSABIYERA V, BARIANA H S, QURESHI N, et al. Characterisation and mapping of adult plant stripe rust resistance in wheat accession Aus27284 [J]. Theoretical and Applied Genetics. 2018,131(8):1-9.
[72] ZENG Qingdong, HAN Dejun, WANG Qilin, et al. Stripe rust resistance and genes in Chinese wheat cultivars and breeding lines [J]. Euphytica, 2014, 196(2): 271-284.
[73] JIN Y, SZABO L J, CARSON M. Century-old mystery of Puccinia striiformis life history solved with the identification of Berberis as an alternate host[J]. Phytopathology, 2010, 100:432-435.
[74] ZHAO Jie, WANG Long, WANG Zhiyan, et al. Identification of eighteen Berberis species as alternate hosts of Puccinia striiformis f. sp. tritici and virulence variation in the pathogen isolates from natural infection of barberry plants in China [J]. Phytopathology, 2013, 103:927-934.
[75] ZHAO Jie, WANG Meinan, CHEN Xianming, et al. Role of alternate hosts in epidemiology and pathogen variation of cereal rusts [J].Annual Review of Phytopathology,2016,54:207-228.
[76] THRALL P H, BURDON J J. Evolution of virulence in a plant host-pathogen metapopulation [J]. Science, 2003, 299(5613): 1735-1737.
[77] ZHAN J, THRALL P H, PAPALX J, et al. Playing on a pathogen's weakness: using evolution to guide sustainable plant disease control strategies [J]. Annual Review of Phytopathology, 2015, 53: 19-43.
[78] BROWN J K M, TELLIER A. Plant-parasite coevolution: bridging the gap between genetics and ecology [J]. Annual Review of Phytopathology, 2011, 49(1): 345-367.
[79] BURDON J J, BARRETT L G, REBETZKE G, et al. Guiding deployment of resistance in cereals using evolutionary principles [J]. Evolutionary Applications, 2014, 7(6): 609-624.
[80] HOVMLLER M S, SRENSEN C K, WALTER S, et al. Diversity of Puccinia striiformis on cereals and grasses [J]. Annual Review of Phytopathology, 2011, 49(1): 197-217.
[81] JOHNSON T. Man-guided evolution in plant rusts [J]. Science, 1961, 133(3450): 357-362.
[82] 薛文波,许鑫,穆京妹,等.中国小麦主栽品种抗条锈性评价与基因分析[J].麦类作物学报,2014,34(8):1054-1060
[83] 周阳,何中虎,张改生,等.1BL/1RS易位系在我国小麦育种中的应用[J].作物学报,2004,30(6):531-535.
[84] 李在峰.中国小麦品种条锈鉴定及抗条锈新基因YrZH84的分子标记[D].保定:河北农业大学,2006.
[85] HAN Dejun, WANG Qilin, CHEN Xianming, et al. Emerging Yr26-virulent races of Puccinia striiformis f. tritici are threatening wheat production in the Sichuan Basin, China [J]. Plant Disease, 2015, 99(6): 754-760.
[86] 李北,徐琪,杨宇衡,等.重庆麦区小麦品种(系)抗条锈性评价与基因分析[J].中国农业科学,2017,50(3):413-425.
[87] SCHWESSINGER B. Fundamental wheat stripe rust research in the 21st century [J].New Phytologist,2017,213(4):1625-1631.
[88] GRAYBOSCH R A. Uneasy Unions: Quality effect s of rye chromatin transfers to wheat [J]. Cereal Science, 2001, 33: 3 -16.
[89] RABINOVICH S V. Importance of wheat-rye translocations for breeding modern cultivar of Triticum aestivum L.[J].Euphytica, 1998, 100(1/3): 323-340.
[90] 李振岐.我國小麦品种抗条锈性丧失原因及其解决途径[J].中国农业科学,1980(3):72-76.
[91] 商鸿生.陇南洛夫林系统品种抗条锈性变异问题联合考察报告[J].西北农林科技大学学报(自然科学版),1981(4):1-9.
[92] 李振岐,商洪生,阴省林,等.洛夫林小麦抗条锈性变异的研究[J].中国农业科学,1984,17(1):68-74.
[93] 康振生,李振岐.洛夫林10常温致病新菌系的发现[J].西北农学院学报,1984(4):18-28.
[94] 康振生,李振岐,张硕成.小麦条锈菌洛夫林13菌系的初步研究[J].西北农业大学学报,1987,15(2):105-106.
[95] 吴立人,孟庆玉,谢水仙,等.洛10,洛13致病类群的发现与研究[J].中国农业科学,1988,21(5):53-58.
[96] 刘大钧,陈佩度,裴广铮,等.将簇毛麦种质转移给小麦的研究[J].遗传学报,1983(2):103-113.
[97] 张庆勤,谢水仙.簇毛麦在小麦抗病育种中的利用[J].植物保护学报,1998,25(1):41-45.
[98] MA Jianxin, ZHOU Ronghua, DONG Yushen, et al. Molecular mapping and detection of the yellow rust resistance gene Yr26 in wheat transferred from Triticum turgidum L. using microsatellite markers [J]. Euphytica, 2001, 120(2): 219-226.
[99] WANG Chunmei, ZHANG Yiping, HAN Dejun, et al. SSR and STS markers for wheat stripe rust resistance gene Yr26[J]. Euphytica, 2008, 159: 359-366.
[100] LI G Q, LI Z F, YANG W Y, et al. Molecular mapping of stripe rust resistance gene YrCH42 in Chinese wheat cultivar Chuanmai 42 and its allelism with Yr24 and Yr26 [J]. Theoretical and Applied Genetics, 2006, 112: 1434-1440.
[101] LI Z F, XIA X C, ZHOU X C, et al. Seedling and slow rusting resistance to stripe rust in Chinese common wheats [J]. Plant Disease, 2006, 90: 1302-1312.
[102] MCINTOSH R, MU Jingmei, HAN Dejun, et al. Wheat stripe rust resistance gene Yr24/Yr26: A retrospective review[J]. The Crop Journal, 2018(4):321-329.
[103] LIU T G, PENG Y L, CHEN W Q, et al. First detection of virulence in Puccinia striiformis f.sp. tritici in China to resistance genes Yr24 (=Yr26) present in wheat cultivar Chuanmai 42 [J]. Plant Disease, 2010, 94(9): 1163.
[104] 曹廷杰,陈永兴,李丹,等.河南小麦新育成品种(系)白粉病抗性鉴定与分子标记检测[J].作物学报,2015,41(8):1172-1182.
[105] NING Yuese, WANG Guoliang. Breeding plant broad-spectrum resistance without yield penalties [J]. Proceedings of the National Academy of Sciences, 2018, 115 (12): 2859-2861.
[106] FABRE F, ROUSSEAU E, MAILLERET L, et al. Durable strategies to deploy plant resistance in agricultural landscapes[J]. New Phytologist, 2012, 193: 1064-1075.
[107] MELANIA F, KIM E. HAMMOND K, et al. A review of wheat diseases-a field perspective [J]. Molecular Plant Pathology, 2018, 19(6):1523-1536.
[108] NELSON R, WIESNER-HANKS T, WISSER R, et al. Navigating complexity to breed disease-resistant crops [J]. Nature Reviews Genetics,2017-11-07, DOI: 10.1038/nrg.2017.82
[109] DANGL J L, HORVATH D M, STASKAWICZ B J. Pivoting the plant immune system from dissection to deployment[J]. Science, 2013,341:746-751.
[110] RIMBAUD L, PAPALX J, BARRETT L G, et al. Mosaics, mixtures, rotations or pyramiding: What is the optimal strategy to deploy major gene resistance?[J/OL]. Evolutionary Applications, https:∥doi.org/10.1111/eva.12681.
(責任编辑: 田 喆)
