α-AlH3的恒温热分解动力学研究①
2018-11-26马新刚刘发龙
吴 磊,马新刚,刘发龙,王 敏
(湖北航天化学技术研究所,襄阳 441003)
0 引言
由于AlH3分解反应焓较低和分解迅速,AlH3被认为是氢燃料电池中优质的储氢材料[1-3],而采用AlH3替代固体推进剂中的铝粉,是提高推进剂能量最有效的方法。与金属铝粉相比,AlH3燃烧热更高,可产生小分子气体,能使燃烧室和喷出气体温度低于含铝粉的推进剂,提高推进剂的燃烧速率,同时降低产物的相对分子质量[3-4]。李猛等[5]用AlH3取代Al粉,运用到HTPB推进剂中。结果表明,用AlH3代替Al粉推进剂能量最大可提高3.2%。AlH3标准摩尔生成焓为-11.8 kJ/mol,绝对熵为30.0 kJ/(mol·℃),标准生成摩尔吉布斯自由能为45.4 kJ/mol。没有钝化处理的AlH3在常温常压下不稳定,钝化处理后的AlH3的稳定性会有所改善,但将AlH3应用于高能推进剂体系中仍存在一些问题,如推进剂的感度高、工艺性能不好等[6-7]。
对AlH3脱氢反应动力学(热分解动力学)的研究,不仅可加深AlH3分解反应过程本质的理解,还有利于AlH3的实际应用。目前,金属氢化物氢化/脱氢反应动力学测量技术主要分为[8]:(1)定容法,其基本思路是将金属氢化物反应体系与体积已知、氢气压力事先设定的参比容器通过阀门相连,打开阀门后发生反应,氢气在反应体系和参比容器之间转移,随着反应的进行,系统状态参数产生变化,检测并转换这种变化就可得到参与反应的氢气量。(2)热分析法,是通过测量样品某一个物理参数随着时间或温度的变化,得到氢化/脱氢过程中样品的转化率随时间或温度的变化,主要包括热重法和程序温度脱附法。秦明娜等[9]研究了α-AlH3非等温动力学。结果表明,其热分解动力学方程符合Avrami-Erofeev方程,但在对α-AlH3的热分解动力学计算时,忽略了α-AlH3分解时不同时期的反应速率的差异导致的动力学模型的差异。
本文采用恒温热重法研究了α-AlH3热分解动力学,得到了其加速期与衰退期的恒温热分解动力学方程及动力学参数。
1 实验
1.1 试样和仪器
α-AlH3:湖北航天化学技术研究所合成。
美国FEI Quanta 650型环境扫描电镜;珠海欧美克Topsizer型激光粒度分析仪;美国布鲁克D8 advance型X射线粉末衍射仪;德国NETZSCH STA 449F3型TG-DSC联用仪。
1.2 实验内容
(1)采用不同目数的筛网(325、150、48目)对α-AlH3进行筛分处理,得到不同粒径的α-AlH3粉末,即0~45 μm、45~100 μm、100~300 μm样品,编号分别为A、B、C。使用扫描电镜(SEM)观察样品的外观形貌,使用激光粒度仪测定样品的粒径及粒径分布,并通过X射线粉末衍射仪(XRD)定性分析不同粒径样品的晶相组成。
(2)采用TG-DSC联用仪在N2气氛(流量为60 ml/min)下测量不同样品在不同温度(110、115、120、125、130 ℃)下的恒温热失重,得到转化率与时间的关系,对所得到的转化率曲线进行拟合,计算出各个样品的活化能,并得到转化率与时间和温度关系的动力学方程。对比拟合计算值与实验值,验证拟合的动力学方程能否用于估算其他温度的热分解过程。
2 结果与讨论
2.1 α-AlH3的基本特性表征
2.1.1 粒径及其分布
采用欧美克Topsizer激光粒径分析仪测定样品A、B、C的粒径分布,测得样品的D50(中位粒径)与D4,3(体积平均粒径)的值,图1为样品A、B、C的粒径分布图,表1为样品A、B、C的粒径。

(a)样品A (b)样品B (c)样品C

样品D50D4,3A18.9420.30B43.6945.95C85.0095.88
样品A、B、C的粒径逐渐增大,但在大粒径样品中存在着一些小粒径的颗粒分布。分析认为,这是由于α-AlH3粉末样品中细粒径的粉末会出现团聚现象,在筛分过程中不能严格地将样品按筛网的目数分离。
2.1.2 形貌特征
不同样品的外观形貌SEM图片如图2所示。

(a)样品A (b)样品B (c)样品C
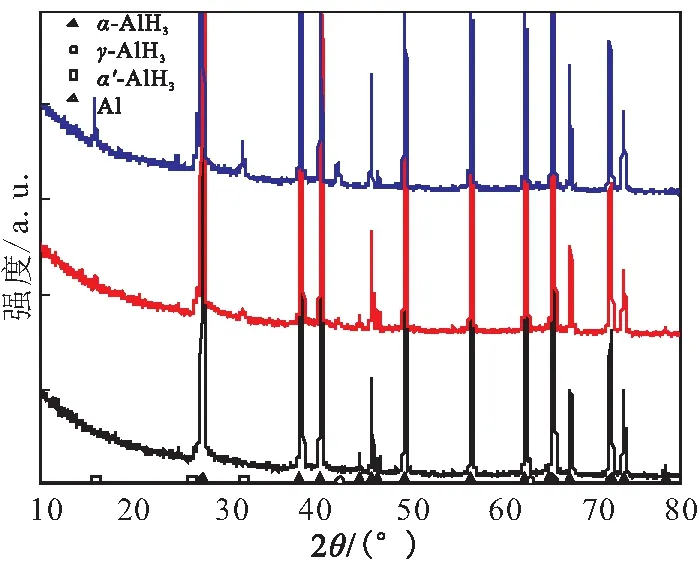
从图2可看出,A、B、C样品中都含有一些细粒径α-AlH3,一些颗粒表面有较为明显的缺陷,同时附着了一些小颗粒。A、B、C 3个样品主要还是α晶型,同时含有少量的棒状的γ晶型与绒球状α′晶型。
2.1.3 晶形特性
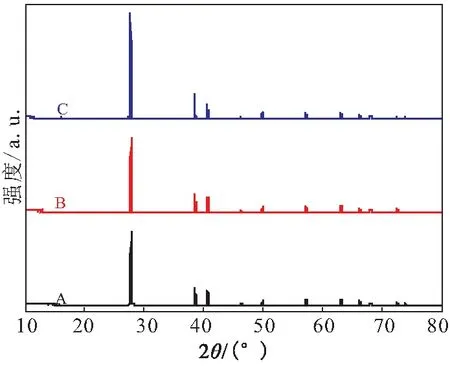
采用X射线粉末衍射仪定性分析了样品A、B、C中的晶相组成,结果见图3。图3(a)表明,A、B、C 3个样品的主要晶型是α-AlH3;而在图3(b)中,除了α-AlH3晶型的衍射峰外,还存在着少量的γ-AlH3、α′-AlH3、Al的衍射峰。XRD结果表明,样品A、B、C主要由α-AlH3构成,含有微量的γ-AlH3、α′-AlH3、Al,不同粒径的样品晶相构成没有太大的区别。
采用XRD内标法对样品的α-AlH3的含量进行测试,测试结果见表2。由表2可看出,细粒径样品A的α-AlH3明显高于样品B和C,而中粒径样品B与粗粒径样品C之间的差异较小。
(a)总体
(b)细节图

样品ABCα-AlH3的含量95.7990.9490.21
2.2 α-AlH3热分解反应动力学
2.2.1 恒温热分解动力学模型
使用TG-DSC联用仪测试样品A、B、C在不同温度下的恒温TG曲线,将重量信号转变为转化率φ,得到φ与时间t的关系曲线(φ(t)=t时刻失重量/最终的总失重量),见图4。由图4可见,样品在不同温度下的热分解曲线都呈“S”型。对于同一样品,随着温度的升高,反应速率增大,反应所需时间缩短。

(a)样品A

(b)样品B

(c)样品C
AlH3在热分解过程中大致可分为诱导期、加速期、衰退期[10],根据图4所得到的转化率φ与时间t的关系,α-AlH3分解的加速期为0.06<φ<0.6,衰退期为0.6<φ<0.95。通过对图5数据进行处理,并对比化学反应、扩散、晶核形成生长等反应机理模型[11],认为Avrami-Erofeev方程[-ln(1-φ)]1/n=kt+k′(k与k′都为常数,其中k由反应温度T和压强p决定)更吻合,即α-AlH3的分解符合Avrami-Erofeev方程。
按照Avrami-Erofeev方程,加速期Avrami-Erofeev方程中的Avrami指数n在3浮动,而在衰退期n的值则在2浮动,在AlH3热分解过程中,Al核的形成发生在诱导期,而在加速期与衰退期的Avrami指数n表示Al核生长方向;加速期和衰减期的Avrami指数分别为3和2,表明在加速期Al核的生长是三维生长控制,随着Al核的迅速生长,生长着的铝核交联,界面面积降低,反应减速,分解进入到衰退期,反应趋于二维生长控制。
以加速期和衰减期的Avrami指数分别为3和2,对AlH3热分解动力学模型曲线及参数进行了拟合,结果见图5和表3,曲线拟合校正决定系数(R2)均大于0.99。
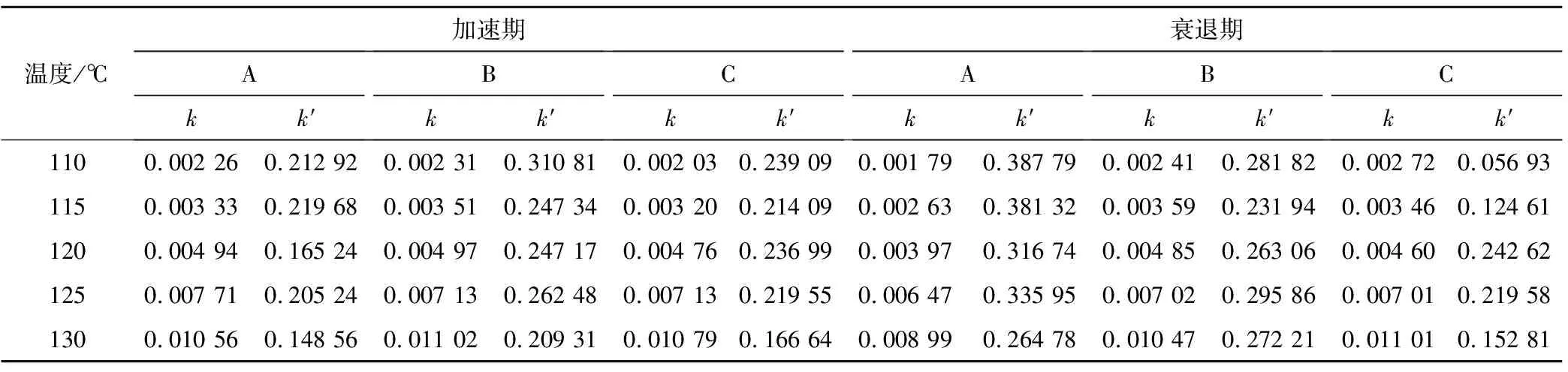
温度/℃加速期Akk′Bkk′Ckk′衰退期Akk′Bkk′Ckk′1100.002 260.212 920.002 310.310 810.002 030.239 090.001 790.387 790.002 410.281 820.002 720.056 931150.003 330.219 680.003 510.247 340.003 200.214 090.002 630.381 320.003 590.231 940.003 460.124 611200.004 940.165 240.004 970.247 170.004 760.236 990.003 970.316 740.004 850.263 060.004 600.242 621250.007 710.205 240.007 130.262 480.007 130.219 550.006 470.335 950.007 020.295 860.007 010.219 581300.010 560.148 560.011 020.209 310.010 790.166 640.008 990.264 780.010 470.272 210.011 010.152 81
2.2.2 恒温热分解动力学方程
AlH3恒温热分解过程中,k与温度T、压强p有关[11]:
(2)
在实验条件下,采用TG-DSC联用仪测定AlH3热失重时,其测试环境是与大气相通的,且反应速率较为缓慢,可认为其测试环境的压强与大气压相同,即g(p)是一个常数。所以,式(2)可转换为
(3)
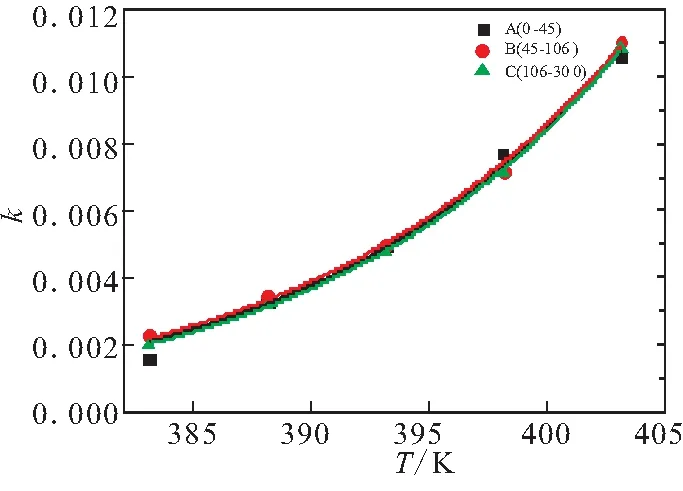
对于同一个样品,q、m为常数,q=aAg(p);m=Ea/R,对k与温度T进行拟合计算,拟合结果见图6、表4。
AlH3(样品A、B、C)在恒温热分解时,加速期与衰退期反应动力学方程可表示为
A(0~45 μm):
[-ln(1-φ)]1/3= 6.933×1010e-11893/Tt+
0.1903(0.06<φ<0.6)
[-ln(1-φ)]1/2= 3.385×1011e-12597Tt+
0.3373(0.6<φ<0.95)
B(45~100 μm):
[-ln(1-φ)]1/3=2.590×1011e-12417/Tt+
0.2453(0.06<φ<0.6)
[-ln(1-φ)]1/2=2.285×1010e-11459/Tt+
0.2658(0.6<φ<0.95)
C(100~300 μm):
[-ln(1-φ)]1/3=7.934×1011e-12873/Tt+
0.2153(0.06<φ<0.6)
[-ln(1-φ)]1/2=1.710×1010e-12254/Tt+
0.1849(0.6<φ<0.95)
(a)加速期

(b)衰退期
由表4中的m值计算了各个样品在不同时期的活化能Ea=m×R,结果见表5。可看出,不同粒径的样品加速期与衰退期的活化能没有太大的差距,其值为(101.8±6.5)kJ/mol。
2.3 实验值与计算值的对比
为了验证上述动力学方程的正确性,采用TG-DSC联用测定了A、B、C3个样品在135 ℃恒温热分解的TG曲线,得到转化率与时间的曲线图,并与由动力学方程计算得到的数据进行对比,结果见图7。由图7可看出,3个样品在135 ℃转化率φ(t)的计算值与实验值较一致。因此,应用动力学方程可外推到其他温度下的恒温热分解,估算样品在其他温度下的恒温热分解历程。
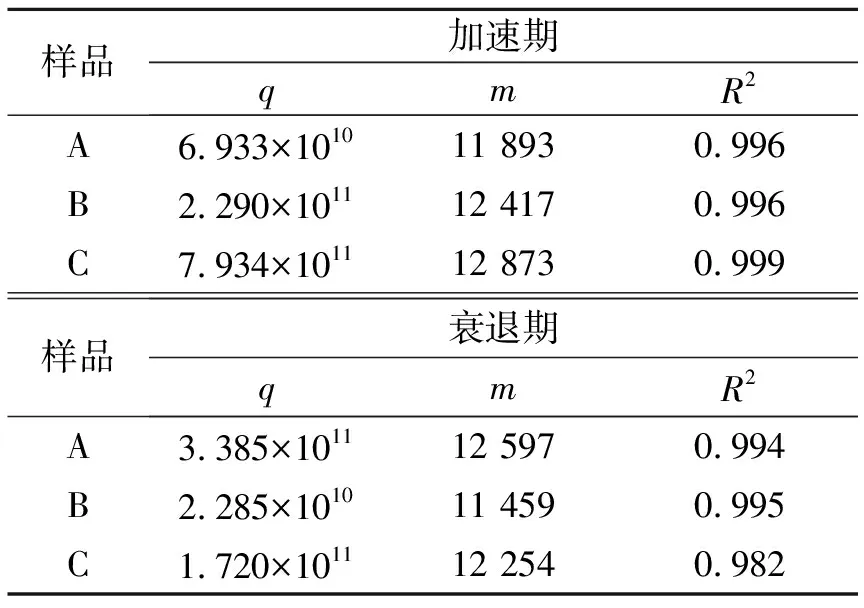
表4 不同样品加速期与衰退期q、m的值

表5 样品A、B、C加速期与衰退期的活化能
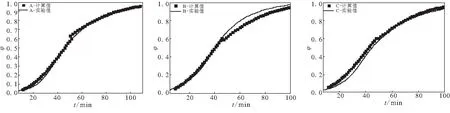
(a)样品A (b)样品B (c)样品C
3 结论
(1)AlH3在恒温热分解时,其动力学方程符合Avrami-Erofeev方程,加速期和衰退期的Avrami指数n分别为3和2,表明Al核的生长在初期是三维生长控制的,随着反应的进一步进行,在进入到衰退期后,Al核的生长逐渐变为平面生长控制。
(2)不同粒径的AlH3粉末颗粒的晶相构成没有太大的区别,细粒径样品A中α-AlH3的含量更高,但是三个样品的反应活化能差异不大,为(101.8±6.5)kJ/mol。样品的恒温动力学方程为
A(0~45 mm):
[-ln(1-φ)]1/3=6.933×1010e-11893/Tt+
0.1903(0.06<φ<0.6)
[-ln(1-φ)]1/2=3.385×1011e-12597/Tt+
0.3373(0.6<φ<0.95)
B(45~100 μm):
[-ln(1-φ)]1/3=2.590×1011e-12417/Tt+
0.2453(0.06<φ<0.6)
[-ln(1-φ)]1/2=2.285×1010e-11459/Tt+
0.2658(0.6<φ<0.95)
C(100~300 μm):
[-ln(1-φ)]1/3=2.590×1011e-12417/Tt+
0.2453(0.06<φ<0.6)
[-ln(1-φ)]1/2=1.710×1010e-12254/Tt+
0.1849(0.6<φ<0.95)
(3)通过拟合计算得到了AlH3恒温热分解的动力学方程,135 ℃下的转化率φ(t)的计算值与实验值较一致,拟合得到的动力学方程可估算在其他温度下的热分解历程。
