黄芩苷对肺癌细胞A549增殖、迁移能力及蛋白Cx43表达的影响
2018-11-23郭爱萍
郭爱萍,党 源 ,彭 军
(1.福建中医药大学中西医结合研究院,福建 福州 350122;2.南京军区福州总医院,福建 福州 350025)
黄芩苷是从植物黄芩的干燥根中提取的一种黄酮类化合物,化学式C21H18O11,分子量446.35,为一个带有葡萄糖醛酸结构的黄酮衍生物,是黄芩主要的有效成分之一。它具有多种的药理作用,包括抗菌、抗病毒、抗肿瘤、清除氧自由基抗氧化、抗血管增殖等[1-2]。本文通过研究黄芩苷对人肺癌细胞A549增殖、迁移的影响,探讨黄芩苷是否通过调控Cx43蛋白来抑制A549细胞的作用及其可能的作用机制,为黄芩苷在肿瘤治疗中的应用提供进一步实验依据。
1 实验材料
1.1 实验细胞 人非小细胞肺癌A549细胞购自中国科学院细胞库。
1.2 实验试剂与仪器 黄芩苷(纯度:99.1%,福州沃森生物技术有限公司);DMEM培养基、胰酶消化液(美国GIBCO公司);超级胎牛血清(四季青微生物材料工程公司);辣根过氧化酶标记的抗兔二抗、兔抗β-actin多克隆抗体(美国 Santa Cruz公司);兔抗Cx43多克隆抗体(美国Abcam公司);CKX41型倒置显微镜(日本Olympus公司);Powerwave XS型酶标仪(中国基因有限公司);ChemiDoc MP成像系统(Bio-Rad,Hercules,CA)。
2 实验方法
2.1 黄芩苷溶液配制 采用二甲亚砜(DMSO)将黄芩苷配制成 100 mmol/L的贮存液,-20℃保存备用,临用时以DMEM培养基稀释。
2.2 细胞培养及干预 将A549细胞培养于含有10%FBS的高糖DMEM细胞培养液中,置于37℃、5%CO2的恒温培养箱中常规培养传代。实验分组:对照组(0 μmol/L 组)、50 μmol/L 组、100 μmol/L组、200 μmol/L 组。
2.3 CCK8检测细胞增殖 取96孔板,将生长对数期A549细胞按104个/孔浓度接种,每孔约100μL细胞悬液,每组设置6个复孔,边缘孔用无菌PBS填充,轻轻摇晃细胞板使细胞均匀分散后置于37℃、5%CO2恒温培养箱中培养;加药组加入不同浓度的药物,对照组均加入等体积溶剂,其中黄芩苷对照组加入与最高浓度组等量的二甲亚砜,分别培养24、48、72、96 h。 用酶标仪检测在 450 m 处的吸光度A值,实验重复3次。
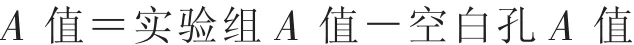
2.4 细胞划痕损伤实验 首先将实验分组:对照组(0 μmol/L 组 )、50 μmol/L 组 、100 μmol/L 组 、200μmol/L组;用 marker笔在 6孔板背后,用直尺均匀地划横线,大约每隔0.5~1 cm一道,横穿过孔,每孔至少穿过5条线。接种约5×105个/孔的上述不同分组的细胞,使细胞过夜后能铺满整孔。第2天用200μL格的枪头比着直尺,尽量垂至于背后的横线划痕,枪头要垂直,不能倾斜。用PBS洗细胞3次,去除划下的细胞,加入含10%的胎牛血清的细胞培养基2 mL,置于37℃、5%CO2培养箱培养。分别于 0、24、48、72、96 h 观察细胞迁移距离,拍照并测量其迁移距离。

2.5 Western blot法检测Cx43蛋白表达 每单个组织样本经PBS洗后,加入300μL RIPA缓冲液裂解30 min,17 000 r/min离心15 min后取上清作为蛋白提取物,进行BCA蛋白定量。取20μg蛋白样品进行SDS-PAGE实验。通过SDS-PAGE分离,并转移到PVDF膜上。将含有分离出的蛋白质的膜用含5%BSA的TBST缓冲液(25 mM Tris,190 mM NaCl,0.05%Tween 20,pH 7.5)在室温下封闭 2 h。随后用所述的 Cx43 一抗(1∶1 000)和 β-actin(1∶2 000),4℃孵育过夜。TBST缓冲液洗膜3次,每次10 min。将膜用相应的结合辣根过氧化物酶(HRP)的二抗(1∶5 000)在室温下孵育 1 h。TBST 缓冲液再次洗膜3次,每次10 min。采用增强的化学发光法检测,并由ChemiDoc MP成像系统进行成像。靶蛋白的定量通过光密度分析,并用β-actin进行标准化。
2.6 统计学方法 采用SPSS 21.0统计软件进行数据处理。计量资料符合正态分布以(±s)表示,采用t检验。
3 结 果
3.1 黄芩苷对肺癌细胞A549增殖能力的影响 见表1。
表1 黄芩苷对肺癌细胞A549增殖能力的影响(A值,±s)

表1 黄芩苷对肺癌细胞A549增殖能力的影响(A值,±s)
注:与对照组比较,1) P<0.01,2) P<0.05。
组别对照组50 μmol/L 组100 μmol/L 组200 μmol/L 组0 h 0.45±0.05 0.48±0.04 0.46±0.05 0.47±0.04 24 h 0.74±0.02 0.66±0.031)2)0.51±0.051)2)0.51±0.161)2)48 h 1.14±0.02 0.97±0.031)2)0.74±0.011)2)0.58±0.061)2)72 h 1.59±0.06 1.48±0.012)0.90±0.041)2)0.70±0.031)2)96 h 1.59±0.06 1.77±0.031)2)1.06±0.041)2)0.84±0.041)2)
3.2 黄芩苷对肺癌细胞A549迁移能力的影响见图1、表2。

图1 黄芩苷对A549细胞迁移能力的影响(×200)
表2 黄芩苷对肺癌细胞A549迁移能力的影响(n=6,±s) μm

表2 黄芩苷对肺癌细胞A549迁移能力的影响(n=6,±s) μm
注:与对照组比较,1) P<0.01,2) P<0.05。
组别对照组50 μmol/L 组100 μmol/L 组200 μmol/L 组0 h 0 0 0 0 24 h 2.88±0.24 2.33±0.232)1.59±0.181)0.86±0.121)48 h 5.24±0.16 4.26±0.111)3.37±0.081)2.18±0.171)72 h 5.31±0.29 4.69±0.142)4.28±0.151)3.06±0.441)96 h 6.00±0.22 5.40±0.172)4.71±0.171)4.19±0.181)
3.3 黄芩苷对肺癌细胞A549蛋白Cx43表达的影响 见图 2、图 3。
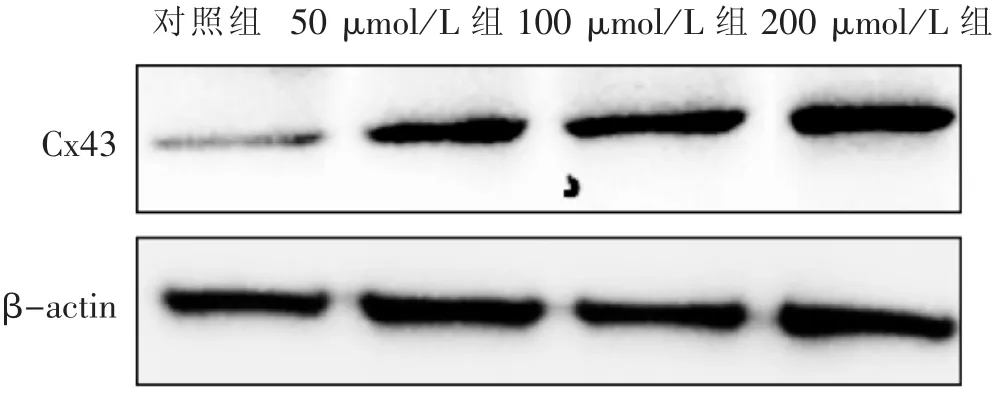
图2 黄芩苷干预A549细胞Cx43蛋白表达电泳图

图3 黄芩苷对肺癌细胞A549蛋白Cx43表达的影响
4 讨论
药理学研究发现:黄芩具有抗肿瘤作用,包括诱导细胞凋亡、控制细胞周期、抗氧化、抗炎、诱导细胞分化、降低细胞的转移和侵袭能力[3]。黄芩苷是黄芩主要的有效成分之一,近年来,随着对黄芩苷抗肿瘤作用的深入研究,发现其还能抑制黏液表皮样癌肿瘤细胞增殖,促进肿瘤细胞凋亡[4]。目前研究发现,对黄芩苷抗肿瘤作用的实验研究主要集中在人前列腺癌、膀胱癌、肝细胞癌、乳腺癌、结肠癌、宫颈癌等恶性肿瘤[5-7]。但关于黄芩苷对肺癌细胞增殖、迁移、侵袭能力的作用的报道较少。本研究通过CKK-8法和细胞划痕实验证实:不同浓度的黄芩苷对肺癌细胞A549增殖和迁移能力具有显著的抑制作用,且这种抑制呈现剂量依赖性。
为了探讨黄芩苷对肺癌细胞A549抑制作用的机制,我们进一步检测连接蛋白Cx43的表达水平。相关研究已证明:Cx43与肿瘤的生长呈负相关,并主要与Cx43调节细胞凋亡密切相关,Cx43可能是肿瘤的重要抑制因素[8]。Cx43蛋白在肺癌组织中表达下降,且表达下降程度与临床病理参数相关,Cx43可通过细胞周期调节抑制细胞生长速度[9]。Cx43蛋白在正常组织中表达阳性率均比在原发性肺癌组织中表达阳性率高,在进展的非小细胞肺癌中阳性表达率下降,它的mRNA表达的水平与组织类型、临床分期、肿瘤分化程度及淋巴结转移情况密切相关[10]。
本研究显示:肺癌细胞A549中连接蛋白Cx43的表达水平在黄芩苷作用后明显上升,提示黄芩苷可通过上调连接蛋白Cx43表达来抑制肿瘤细胞的增殖和迁移能力。
