Cu/Ag纳米簇比率型荧光探针的构建及其在Ag+检测中的应用
2018-11-07陆可钰孔令灿
陆可钰, 孔令灿
(1.江南大学食品科学与技术国家重点实验室,江苏无锡 214122;2.无锡市疾病预防控制中心,江苏无锡 214023)
随着全球化、工业化和城市化的飞速发展,重金属污染已经成为一个严重的环境问题。银因具有极好的杀菌特性和光电特性而被广泛应用于临床、影像、化妆品等领域[1 - 2]。但如今,由于其高毒性、非生物降解,Ag+污染已经成为一个对人类健康最有害的重金属离子之一。人体中Ag+的积累可导致多种症状,如头痛和器官功能衰竭等[3 - 4]。传统检测Ag+的方法主要有原子吸收光谱法、电感耦合等离子体质谱法、电化学分析法等[5 - 7]。然而,这些技术往往由于成本较高、操作复杂、耗时等原因,无法对样品(特别是复杂基质样品,如血液、尿液和食物)中的Ag+实现实时的检测。因此发展高效、简易、环保、灵敏的检测Ag+的方法就显得尤为重要。
金属纳米簇一般是由几个至几百个金属原子组成,粒径大小接近于电子的费米波长,因此呈现出很多不同于金属纳米粒子的光学和电学性质,如较强的荧光性、良好的光稳定性等[8 - 12]。这些性质为金属纳米簇在化学传感和光电等领域中的应用提供了可能。例如,Wang等人利用纳米簇实现了Pb2+的检测[13];Yang等人利用铜纳米簇实现了汞离子的检测[14]。然而,这些研究主要是通过调节配体间的相互作用来实现金属离子的检测。相应的通过调整金属间的相互作用特别是聚集诱导发光的方法来高效、灵敏地检测重金属离子的研究报道较少。
本文在水溶液中以D -青霉胺为配体,在室温下通过一锅法制备出具有聚集诱导发光的铜/银合金纳米簇(Cu/AgNCs)发光探针,而且Ag+的掺杂会使探针的发光表现出了明显的蓝移效应,基于此,建立了Ag+的比率发光检测方法,该方法不仅快速、灵敏,而且其他常见的金属离子对Ag+的检测没有明显的干扰作用,并将其成功地应用于人体尿样和环境水样中Ag+的测定。
1 实验部分
1.1 仪器与试剂
F-4500型荧光光谱仪、UV-2450型紫外-可见分光光度计(日本,岛津公司);JEM-2100型透射电子显微镜(日本,JEOL公司);Nexus670型傅里叶变换红外光谱仪(美国,Nicolet公司);6220型 LC-TOF MS仪(美国,Agilent公司);量子产率测量系统(日本,Hamamatsu Photonics K.K.公司)。
氯金酸(HAuCl4)、D -青霉胺(纯度98%)购自西格玛奥德里奇(上海)贸易有限公司。CuSO4·5H2O(纯度98%)、AgNO3(纯度99%)购自阿拉丁试剂(中国)公司。所用试剂均为分析纯。实验用水为Millipore Milli-Q纯水系统制备的超纯水。
1.2 Cu/Ag纳米簇(Cu/AgCNs)的制备
参考文献方法[15],稍加改进制备Cu/AgNCs。具体如下:室温下将70 μL的CuSO4溶液(100 mmol/L)和50 μL 100 mmol/L的AgNO3溶液,依次加入到5 mL的D -青霉胺溶液(3 g/L)中,搅拌5 min后离心,取沉淀物待用。
1.3 Ag+检测的灵敏度和选择性实验
将一系列不同浓度的AgNO3标准溶液和70 μL的CuSO4溶液(100 mmol/L),依次加入到5 mL的D -青霉胺溶液(3 g/L)中,室温搅拌5 min后,收集相应的荧光光谱数据。根据比率发光数值(I570/I615)和Ag+浓度之间的比例关系建立标准曲线。在Ag+加入量不变的情况下(50 μL,100 mmol/L),分别加入等量的其它金属离子或HAuCl4,并保持其他条件不变,研究Cu/AgNCs比率荧光探针对Ag+的选择性。
2 结果与讨论
2.1 Cu/AgCNs比率荧光探针的制备与表征
根据1.2节合成方法制备出不同Ag+掺杂量的Cu/AgNCs,并分别命名为N1、N2、N3,见表1。从傅里叶变换红外(FT-IR)光谱结果(图1)可以看出,相比于纯的D -青霉胺,Cu/AgNCs(N1和N2)在2 520 cm-1处的峰消失了,这是由于S-H键发生了断裂并形成了新的S-Cu(Ag)键。从Cu/AgNCs的电喷雾电离-飞行时间质谱(ESI-TOF MS)(图2)结果可以看出,在Cu/AgNCs中存在许多Cu/Ag离子碎片,比如Cu2Ag2L2,Cu3AgL3,Cu3Ag2L4等(L代表配体D -青霉胺)。透射电镜(TEM)结果(图3)显示N1表现为不规则的组装结构,而Cu/AgNCs(N2、N3)变成相对规整的近球形结构。随着Ag+掺杂量的增加,这些球状结构随着尺寸的增大而进一步融合成不规则的组装结构,Cu/AgNCs的平均尺寸由30 nm(N2)增加到125 nm(N3)。以上结果都表明确实形成了Cu/AgNCs。

表1 Cu/AgNCs(N1-N3)合成条件及其发射峰的位置
a:D -penicillamine.
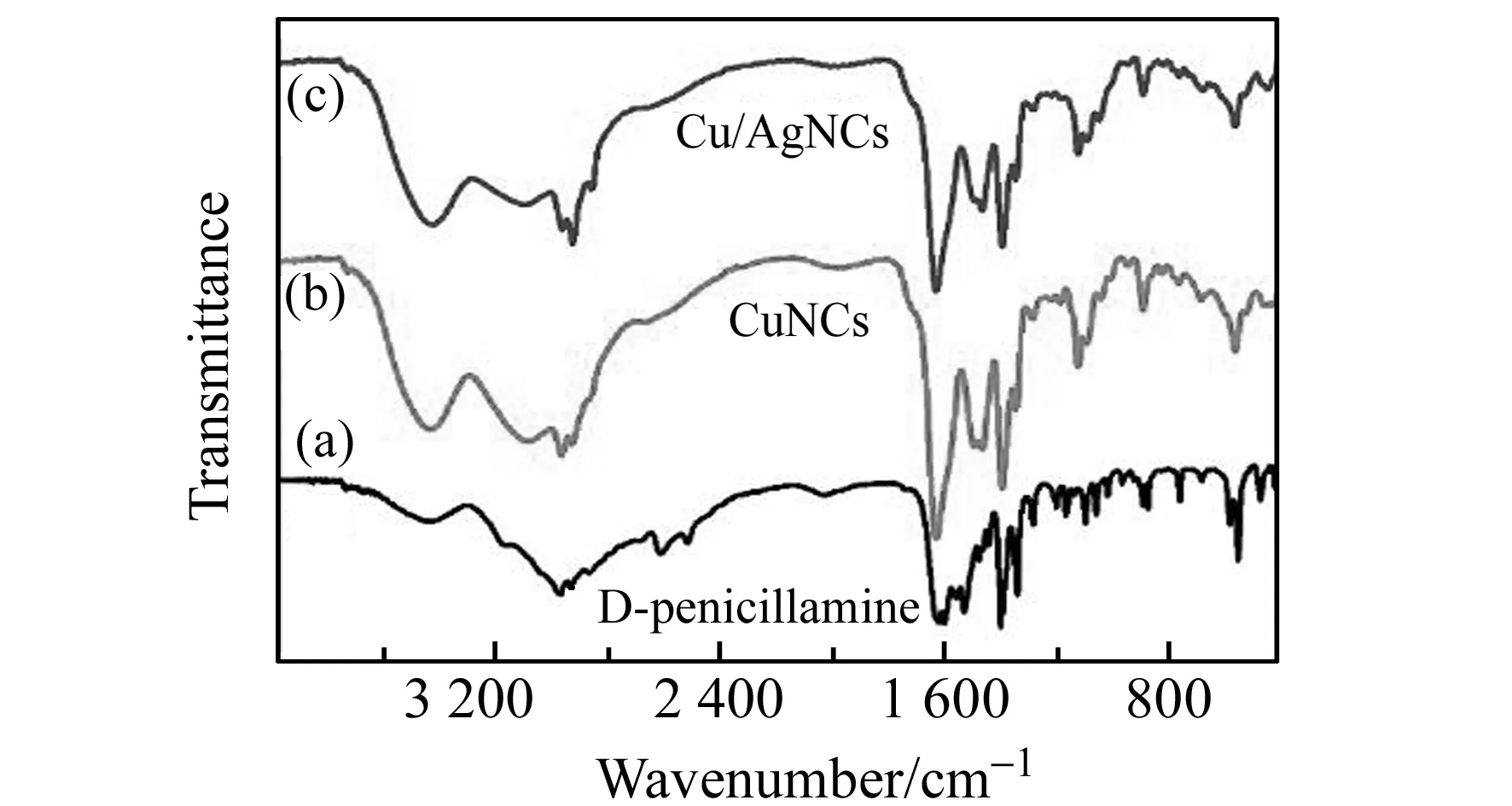
图1 D -青霉胺(a)、N1(b)和N2(c)的红外(IR)光谱图Fig.1 IR spectra of D -penicillamine(a),N1(b) andN2(c)
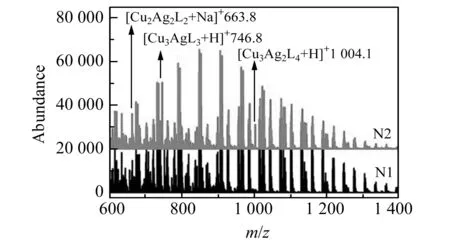
图2 Cu/AgNCs N1和N2的ESI-TOF MS数据Fig.2 The ESI-TOF MS data of Cu/AgNCs N1 and N2

图3 N1(a)、N2(b)和N3(c)的透射电镜(TEM)照片Fig.3 TEM images of N1(a),N2(b) and N3(c)
2.2 Cu/AgNCs的聚集诱导发光性质及其内在机制
图4(a)为Cu/AgNCs在水中的紫外-可见吸收光谱,可以看出它们(N1、N2和N3)的吸收光谱比较相似,都在276~407 nm范围内。在用波长360 nm 紫外光激发时 Cu/AgNCs表现出较强的聚集诱导发光性质,如图4(b)所示。而且,随着Ag+掺杂量的增加,它们的最大发射峰位置出现明显的蓝移,从615 nm(N1)移动到576 nm(N3)。
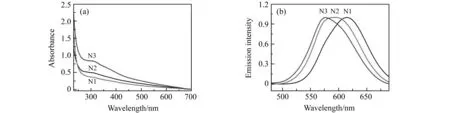
图4 (a)N1-N3水溶液的紫外-可见(UV-Vis)吸收光谱;(b)N1-N3水溶液中在紫外光下的发射光谱Fig.4 (a) UV-Vis absorption spectra of N1-N3 in aqueous solution;(b) Emission spectra of N1-N3 in aqueous solution under UV light(λex=360 nm)
高分辨透射电镜(HRTEM)结果(图5)显示Cu/AgNCs中有明显的晶格条纹。由于Cu元素的晶格常数小于Ag元素,所以可以预测Cu纳米簇(CuNCs)的平均晶格间距要小于Cu/AgNCs。而事实上,CuNCs(N1)平均晶格距离为2.68 Å,要大于Cu/AgNCs(N2和N3,分别为2.25 Å和2.37 Å),这个现象是由于小纳米粒子中存在晶格张力而导致的[16]。以上结果表明Ag+成功地掺杂到Cu/AgNCs中。值得注意的是,CuNCs和Cu/AgNCs有序的微观结构促进了配体与金属间的电荷转移(LMCT)以及配体与金属-金属间的电荷转移(LMMCT),从而导致聚集诱导发光行为的出现[17 - 18];而且,随着Ag+含量的增加,可能导致微观结构的排斥力减少以及金属-金属作用的增强,从而增加了Cu/AgNCs超结构中金属-金属间的平均距离,最终导致了发光光谱的蓝移[19]。

图5 N1(a)、N2(b)和N3(c)的高分辨透射电镜(HRTEM)照片(它们的晶格间距分别为2.68 Å、2.25 Å和2.37 Å)Fig.5 HRTEM images of N1(a),N2(b) and N3(c)(Their lattice distances are 2.68 Å,2.25 Å,and 2.37 Å,respectively)
2.3 Ag+的检测及选择性试验
将不同体积的100 mmol/L AgNO3溶液(0、1、2、4、8、12、16、20、24、30、40、80、120、160、200 μL),以及100 mmol/L CuSO4溶液(70 μL),依次加入到5 mL D -青霉胺溶液(3 g/L)中,在室温下反应5 min,之后进行光谱测量。为了清楚地研究Cu/AgNCs的比率荧光变化,其归一化的发射光谱如图6(a)所示。可以观察到,随着Ag+量的增加它们的光致发光光谱呈现明显的蓝移(从右到左Ag+体积为0~120 μL)。此外,比率荧光强度(I570/I615)与Ag+浓度(0~80 μL或0~1 600 μmol/L)之间有良好的线性关系,检出限(S/N=3)为0.9 μmol/L(图6(b))。
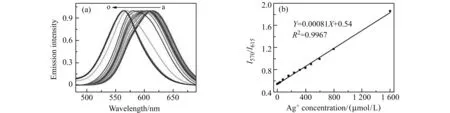
图6 不同剂量AgNO3制备所得Cu/AgNCs的归一化发射光谱(a)、比率荧光强度(I570/I615)和Ag+浓度(0~80 μL或0~1 600 μmol/L)的线性关系(b)Fig.6 The normalized emission spectra of Cu/AgNCs prepared upon addition of different volumes of AgNO3(a),the linear relationship between the ratios of emission intensity(I570/I615) and the concentration of Ag+(0 - 80 μL or 0 - 1 600 μmol/L)(b)(a):(a-o)0,1,2,4,8,12,16,20,24,30,40,80,120,160,200 μg AgNO3.

图7 不同金属离子对比率荧光强度(I570/I615)的影响Fig.7 Effects of metal ions on ratio fluorescence intensity(I570/I615)metal ions(1→15):Na+,Mg2+,Pb2+,Ba2+,Cd2+,Fe2+,Fe3+,Ag+,K+,Mn2+,Zn2+,Ca2+,Co2+,Hg2+,HAuCl4.
为深入了解Cu/AgNCs荧光探针是否可用于实际样品中Ag+的特异性检测,我们考察了水体系中可能存在的其它金属离子Na+、K+、Mg2+、Mn2+、Pb2+、Zn2+、Ba2+、Ca2+、Cd2+、Co2+、Fe2+、Hg2+、Fe3+或HAuCl4等对该探针检测Ag+的干扰。如图7所示,当Ag+浓度保持不变(50 μL,100 mmol/L),且其他实验条件相同的情况下,向体系中分别加入等量的不同金属阳离子时,可以看到探针的比率荧光强度(I570/I615)只有轻微的变化,这说明,当这些阳离子或HAuCl4和Ag+共同存在时,它们几乎对Ag+的检测无干扰作用,进一步说明了该探针对Ag+具有较好的选择性。
2.4 实际样品中Ag+检测
基于该Cu/AgNCs在Ag+的检测中具有良好的灵敏度和选择性,将其应用于人体尿样及实际水样中Ag+的检测。尿样(先用去离子水稀释50倍混匀)或水样经过静置、过滤后取上层清液,采用加入回收法进行检测。在实验条件下,向样品中分别加入不同浓度(10.2、25.3、50.5 μmol/L)的AgNO3溶液,然后进行测定,每个浓度平行测定3次,结果列于表2中。可以观察到加标人体尿液和水样中Ag+的回收率在93%~99%之间,相对标准偏差(RSD)在3.6%~5.9%之间(表2)。为了验证此方法的准确性,利用火焰原子吸收光谱法(FAAS)对实际样品进行了检测,结果显示人体尿液和水样中Ag+的加标回收率和相对标准偏差分别在94%~98%和3.2%~5.6%范围内,与本文所建立方法结果一致。
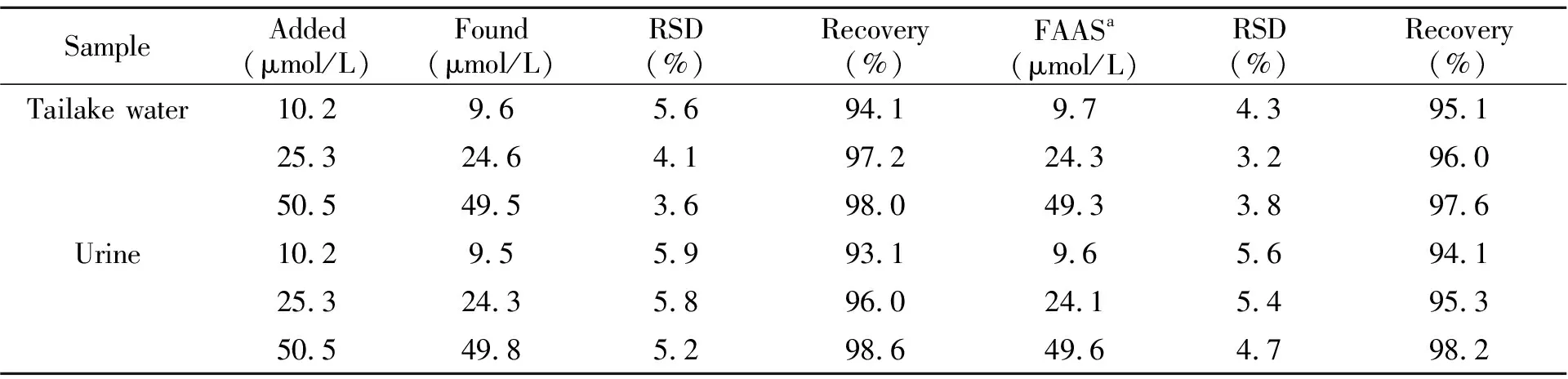
表2 人体尿样和水样中Ag+含量测定结果(n=3)
a:the flame atomic absorption spectrometric method.
3 结论
本研究利用D -青霉胺为配体,在室温下通过一锅法制备出具有聚集诱导发光行为的Cu/Ag纳米簇比率型荧光探针,探究了其内在机制。基于Ag+的掺杂会对该探针的荧光做出明显的蓝移效应,建立了快速灵敏检测Ag+的方法,并已成功地应用于人体尿样和实际水样中Ag+的测定。该方法由于其廉价易得、简单快速,并具有很高的选择性,将在分析检测领域中具有较好的应用前景。
