致病性尖孢镰刀拮抗菌的筛选与鉴定
2018-11-05王宇鹏
王宇鹏,杨 帆,赵 华*
(天津科技大学 生物工程学院,天津 300457)
尖孢镰刀菌(Fusarium oxysporum)是一种既可侵染植物又可在土壤内生存的兼性寄生真菌,属半知菌类(Imperfectifungi)、从梗孢目(Moniliales)、瘤座孢科(Tuberculariaceae)、镰刀菌属(Fusarium)[1]。由致病性尖孢镰刀菌(F.oxysporum)侵染引起的植物枯萎病是一种世界性的土传真菌病害。该病原菌在植株维管束组织内生长,使植株的营养和水分供应受到很大的影响,导致叶片气孔关闭、叶片枯萎和植株整体死亡,最终病原菌到达死亡组织表面,然后在死亡组织表面产生大量孢子,进一步扩散为接种体[2]。尖孢镰刀菌可引起100多种植物发生枯萎病,给作物生产带来严重的损失。传统防治措施由于长期大量施用化学农药导致农药残留及环境污染,危害人类健康并破坏生态平衡,且随着病原菌抗药性的不断增强,出现用药量与病害发生程度相互递增的恶性循环[3],因此,寻找健康、安全、有效的农业生物灾害防治手段成为当务之急。
生物防治因其来源广泛,对人畜安全和对环境友好而备受研究者的青睐,其中芽孢杆菌(Bacillus)具有培养周期短、生产方便、抗逆性较强、易于与其他药剂混用等优点,日益成为生防菌的优势菌源。李建嫄等[4]通过抑菌圈法和对峙平板法筛选出一株对花椒枯穗病病原菌具有抑制作用的多粘类芽孢杆菌(Paenibacillus polymyxa);杨冬静等[5]通过研究发现解淀粉芽孢杆菌(Bacillusamyloliquefaciens)对甘薯黑斑病有很强的拮抗活性,而且对病原菌的菌丝体及孢子都具有致畸作用,对病原菌的萌发也有一定的影响;尹微等[6]通过验证多粘类芽孢杆菌菌剂与腐植酸水溶肥料配合施用效果表明,二者配用显著提高了黄瓜的产量及肥料的效果,对减轻土传病害提高黄瓜产量有极其重要的作用。芽孢杆菌作为一类防治植物病害的重要生物资源,其主要抑菌物质来源于自身产生的蛋白[7]、脂肽[8]、挥发类物质[9],并能促使植株分泌一定的拮抗物质及促生长物质[10]。贝莱斯芽孢杆菌(Bacillus velezensis)作为一种新型生防菌,在2008年被确定为解淀粉芽孢杆菌的后期异型体[11]。除具有与解淀粉芽孢杆菌相似的拮抗作用和诱导植株抗性作用外,还能产生最佳乳化活性的生物表面活性剂,对后期在植物和土壤中定殖具有很大的应用价值[12]。
清香型白酒大曲中微生物含量高,菌体抗逆性较好,因此本研究以致病性尖孢镰刀菌(F.oxysporum)为靶标菌,从清香型白酒大曲中筛选一株对其具有拮抗作用的拮抗菌,进行菌落形态观察、生理生化指标及16SrRNA鉴定,并对其生长曲线及抑菌物质做了初步研究,为后期生物防治应用提供菌种材料。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
尖孢镰刀菌(F.oxysporum):由本实验室(天津科技大学工业发酵微生物重点实验室)提供;清香型大曲粉:安徽省绩溪县龙川酒厂。
1.1.2 试剂
冰乙酸、氢氧化钠、硫酸铵(均为分析纯):天津市鼎盛鑫化工有限公司;琼脂粉、孟加拉红(均为分析纯):北京索莱宝有限公司;葡萄糖、酵母膏、蛋白胨(均为分析纯):北京奥博星生物技术有限责任公司;KH2PO4、Na2HPO4、KCl、NaCl(均为分析纯):天津市风船化学试剂科技有限公司。
1.1.3 培养基
LB培养基:酵母膏5.0g/L,蛋白胨10.0g/L,NaCl10.0g/L,pH为7.0。固体培养基时另添加15~20 g/L琼脂粉,121℃灭菌20 min。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯浸出液200 g/L,葡萄糖20 g/L,pH自然。固体培养基时另添加15~20 g/L琼脂粉,115℃灭菌30 min。
马丁氏固体培养基:葡萄糖10.0 g/L,蛋白胨5.0 g/L,KH2PO41.0 g/L,MgSO4·7H2O 0.5 g/L,孟加拉红(10 g/L)3.3 mL,琼脂粉15~20 g/L,pH自然,115℃灭菌30 min,临用前每100 mL添加10 g/L链霉素液0.3 mL。
1.2 仪器与设备
H1815高速离心机:湘仪离心仪器有限公司;岛津UV-1800紫外分光光度计:上海美谱达仪器有限公司;CX21FS1型生物显微镜:日本OLYMPUS会社;LRH-150-S恒温恒湿培养箱:广东省医疗器械厂;Lab-1D-50真空冷冻干燥机:北京博医康实验仪器有限公司;DYY-4C型稳压稳流电泳仪:北京百晶生物技术有限公司;Mastercycler nexus聚合酶链式反应(polymerase chain reaction,PCR)仪:德国Eppendorf公司;Tanon1600凝胶成像系统:上海天能科技有限公司;SY.45-NJB牛津杯(Φ6×8×10 mm):北京先驱威锋技术开发公司。
1.3 方法
1.3.1 菌种分离
称取10 g大曲粉于100 mL无菌水中,加入玻璃珠后振荡均匀,制备菌悬液;吸取1 mL菌悬液进行梯度稀释,分别取稀释梯度为10-2、10-3、10-4的菌悬液100 μL涂布于LB平板上,30℃条件下倒置培养2 d,整个实验重复3次。挑选培养菌落形态不同且单一菌落,于LB平板上进一步划线纯化,将纯化的菌株转接到LB平板上,于4℃保存。
1.3.2 尖孢镰刀拮抗菌的筛选
(1)初筛:将4℃保存的尖孢镰刀菌转接于PDA平板活化5 d,用灭菌打孔器在菌落边缘区域制成直径为5 mm的尖孢镰刀菌饼置于PDA平板中心,同时将分离于大曲酒糟的菌株于LB固体平板培养基上进行三区划线活化,30℃倒置培养24 h,然后分别使用无菌牙签挑取单菌落点接拮抗菌于距离平板中心30 mm处的同一直线上,以接种尖孢镰刀菌饼不接细菌的PDA平板为对照,30℃培养箱中培养5 d,观察抑菌圈大小,并用卡尺采用十字交叉法测定抑菌圈直径[14]。
(2)复筛:将4℃保存的尖孢镰刀菌转接于PDA平板上活化5 d,在菌落边缘区域用灭菌打孔器制成直径5 mm尖孢镰刀菌饼,接种于PDA平板中央。取已活化的上述具有拮抗作用的拮抗菌株接种于LB液体培养基中,30℃、160 r/min培养48 h,6 000 r/min离心10 min除去菌体后收集发酵液,经真空冷冻干燥后用磷酸盐(phosphatebuffer solution,PBS)缓冲液定容至10 mL,然后经微生物滤膜过滤,于距离平板中心30 mm处放置牛津杯,每个牛津杯中加入200μL无菌发酵液,30℃静置培养5 d,测定抑菌圈直径。
1.3.3 尖孢镰刀菌拮抗菌株的鉴定
(1)形态学鉴定:将活化后的拮抗菌株划线接种于LB平板上,30℃培养24 h,观察菌落形态。挑取拮抗菌单菌落进行革兰氏染色,并在显微镜下观察细胞形态。
(2)生理生化鉴定:参考《常见细菌系统鉴定手册》[15]对拮抗菌株进行生理生化鉴定。
(3)分子生物学鉴定:
脱氧核糖核酸(deoxyribonucleic acid,DNA)的提取:接菌株P9于3 mL LB培养基中过夜培养,6 000 r/min离心8 min,收集沉淀,800μL无菌生理盐水重悬后混匀,再次离心并重悬于无菌TE缓冲液中,涡旋振荡混匀,100℃水浴15 min,然后12 000 r/min离心5min,保留上清液备用。
PCR扩增:引物为细菌通用引物(27F与1492R)。PCR反应体系(25μL):模板1μL,上游引物1μL,下游引物1μL,10×PCRbuffer 2.5μL,脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)(2.5 mmol/L)2μL,Taq DNA聚合酶0.1μL,二甲基亚砜(10%)1μL,双蒸水(ddH2O)16.4μL。PCR扩增条件:94℃预变性5 min;94℃变性30 s,53℃退火45 s,72℃延伸1 min,30个循环;72℃再延伸10 min。取2~5μL PCR扩增产物用0.8%的琼脂糖凝胶电泳进行验证,PCR扩增产物于4℃保存备用。将PCR扩增产物送至苏州金唯智生物工程有限公司进行测序。利用EZbioCloud数据库对测序结果进行比对,选择相似性较高的模式菌株序列,利用MEGA 7.0软件构建系统发育树。
1.3.4尖孢镰刀拮抗菌生长曲线的绘制
将已活化的尖孢镰刀菌拮抗菌按3%接种量接种于装液量为100 mL/250 mL的LB液体培养基中,每个菌株各设置一组平行和空白试验。30℃、160 r/min摇瓶培养30 h,每隔3 h取样,测培养液的OD600nm值,绘制菌种生长曲线。
1.3.5 尖孢镰刀拮抗菌抑菌物质初探
(1)尖孢镰刀菌孢子液制备:将4℃保存的尖孢镰刀菌转接于PDA平板,30℃培养5 d,然后用灭菌打孔器在菌落边缘区域取直径为5 mm的尖孢镰刀菌菌饼,将菌饼放置于PDA平板中央,30℃恒温培养5~6 d,取无菌生理盐水进行水洗并刮下菌丝体,所得的水洗液经灭菌的4层滤布过滤即得真菌孢子液。
(2)尖孢镰刀拮抗菌培养液的制备:取已活化的尖孢镰刀拮抗菌转接于LB液体培养基中,30℃、160 r/min培养9 h制备种子液,然后将种子液接种于LB液体培养基中,装液量100 mL/250 mL,接种量为3%(V/V),30℃、160 r/min培养48 h,所得的培养液经10 000 r/min离心10 min,收集上清液。
(3)蛋白类物质提取:按照(2)所述收集上清,采用硫酸铵沉淀法[16-17]分别提取不同硫酸铵饱和度(25%、35%、45%、55%、65%、75%)的粗蛋白,将所得的粗蛋白用少量PBS缓冲液溶解,透析除盐(透析袋截留分子质量为14 000 Da)后用PEG-8000进行脱水,最后定容至10 mL,经微生物滤膜(Φ=0.22μm)过滤收集到无菌EP管中,4℃保存。
(4)脂肽类物质提取:用6 mol/L的盐酸将(2)中得到的上清液pH调节至2.0,采用酸沉淀法[18-19]提取脂肽物质,然后用PBS缓冲液溶解,并用NaOH调节pH为中性后再用PBS缓冲液定容至10 mL,经微生物滤膜(Φ=0.22μm)过滤收集到无菌EP管中,4℃保存。
(5)抑菌效果的测定:采用牛津杯法[20]测定抑菌能力,调整尖孢镰刀菌孢子液的OD600nm值为0.6,吸取100μL孢子液均匀涂布于马丁培养基,分别于距平板中心点20 mm处放置牛津杯,每个牛津杯中接入待检测液体(尖孢镰刀菌培养液、蛋白质类物质提取液、脂肽类物质提取液)200μL,30℃静置培养2~3 d,观察透明圈的有无并记录抑菌圈的大小,当观察到明显的透明圈时表明该物质对尖孢镰刀菌可以起到一定的抑制作用。
2 结果与分析
2.1 尖孢镰刀拮抗菌的筛选
2.1.1 尖孢镰刀拮抗菌的初筛
采用平板梯度稀释法共筛选出105种菌落形态不同的菌株,经过初筛,共得到28株对尖孢镰刀菌具有拮抗作用的菌株,其中9株抑菌效果比较好,编号分别为P1、P2、P3、P4、P5、P6、P7、P8、P9。其抑菌圈直径如表1所不。
由表1可知,所筛选的9株拮抗菌对尖孢镰刀菌都具有一定的拮抗作用,其中P9的抑菌效果最好,其抑菌圈直径可达到20 mm左右。

表1 拮抗菌对尖孢镰刀菌的抑制作用Table1 Inhibitory effect of antagonistic bacteria on Fusarium oxysporum
2.1.2 尖孢镰刀拮抗菌的复筛
分别取尖孢镰刀拮抗菌P1、P2、P3、P4、P5、P6、P7、P8、P9进行平板对峙拮抗实验,观察抑菌圈有无,并记录抑菌圈大小,其结果如表2所不。

表2 拮抗菌的发酵液对尖孢镰刀菌的抑制作用Table2 Inhibitory effect of fermentation broth of antagonistic bacteria on Fusarium oxysporum
由表2可知,所筛选的拮抗菌均具有抑菌效果,其中P2和P3的拮抗效果最差,其发酵液的抑菌圈直径乃有8.1mm左右,P9的拮抗效果最好,其发酵液的抑菌圈可达到10mm左右,因此选用拮抗菌P9进行后续实验。
2.2 尖孢镰刀拮抗菌的鉴定
2.2.1 形态学鉴定
对拮抗菌P9进行革兰氏染色、镜检及形态观察,结果见图1。
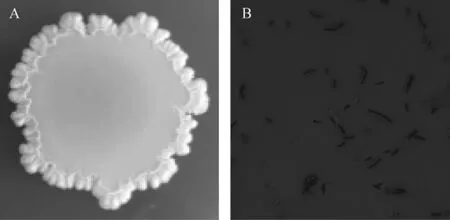
图1 拮抗菌P9的菌落形态(A)与细胞形态(B)Fig.1 Colony(A)and cell morphology(B)of antagonistic bacterium P9
由图1可知,菌株P9为革兰氏阳性短杆菌,中生芽孢。菌落较大,呈不规则圆形,颜色为灰白色不透明,边缘呈锯齿状,表面有褶皱,菌落中心有凸起。
2.2.2 生理生化鉴定
拮抗菌P9的生理生化试验结果如表3所不。

表3 拮抗菌P9的生理生化特征Table3 Physiological and biochemical characteristics of antagonistic bacterium P9
根据伯杰氏手册及常见微生物鉴定手册[15]可知,该拮抗菌符合解淀粉芽孢杆菌(Bacillus amyloliquefaciens)的生理生化特征。
2.2.3 分子生物学鉴定
拮抗菌株P9的16SrRNA扩增产物电泳结果如图2所不。
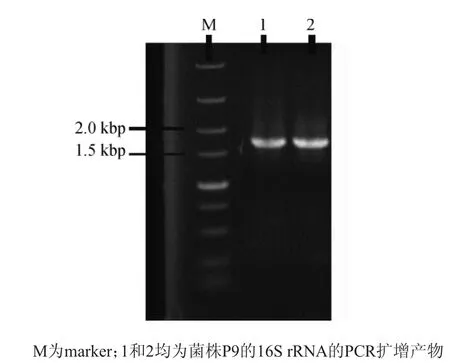
图2 拮抗菌P9 16S rRNA PCR扩增产物的电泳图谱Fig.2 Electrophoregram of PCR amplification products of 16S rRNA of antagonistic bacterium P9
由图2可知,在1 500~2 000 bp之间出现一条清晰且无弥散的条带,说明得到了质量较高的扩增产物。然后将扩增产物送样测序,采用EZbioCloud进行序列同源性比较,选取同源性较高的菌株,采用MEGA 7.0软件构建该菌株的系统发育树,结果如图3所不。
由图3可知,拮抗菌株P9与贝莱斯芽孢杆菌(Bacillus velezensis)聚于一个分支,亲缘关系较近。结合形态观察和生理生化特性,鉴定拮抗菌P9为贝莱斯芽孢杆菌(Bacillus velezensis)。

图3 基于拮抗菌P9 16S rRNA序列的系统发育树Fig.3 Phylogenetic tree of antagonistic bacterium P9 based on 16S rRNA sequence
2.3 贝莱斯芽孢杆菌P9的生长曲线
贝莱斯芽孢杆菌P9的生长曲线如图4所不。

图4 贝莱斯芽孢杆菌P9的生长曲线Fig.4 Growth curve of Bacillus velezensis P9
由图4可知,接种B.velezensis P9后,0~6h处于迟缓期,此时菌株生长缓慢;6~14h处于对数生长期,此时菌体数明显增多,其中在第9小时生长速率最大。14~26 h为稳定期,14h时菌体的OD600nm值达到最大并基本保持稳定,菌体数不再增加,然后在第26小时进入衰亡期,菌体数量开始下降。
2.4 抑菌物质的初探结果
2.4.1 贝莱斯芽孢杆菌P9培养液对尖孢镰刀菌的拮抗作用
以添加无菌水替代菌液作为对照,贝莱斯芽孢杆菌P9培养液对尖孢镰刀菌的抑制效果如图5所不。

图5 贝莱斯芽孢杆菌P9发酵液对尖孢镰刀菌的拮抗作用Fig.5 Inhibitory effect of fermentation broth of Bacillus velezensis P9 on Fusarium oxysporum
由图5可知,B.velezensis P9在培养过程中能产生具有抑制尖孢镰刀菌生长的代谢产物,该代谢产物主要分泌在胞外,其抑菌圈直径为(10.3±0.2)mm。
2.4.2 蛋白类粗提液对尖孢镰刀菌的拮抗作用
以添加无菌水作对照,无菌蛋白类粗提液对尖孢镰刀菌的拮抗作用如图6及表4所不。
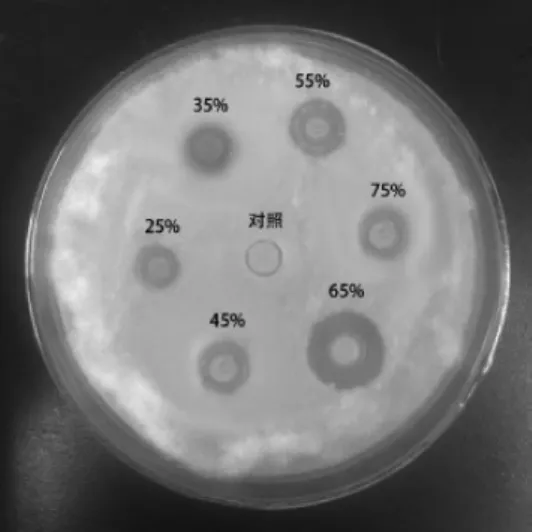
图6 粗蛋白对尖孢镰刀菌的拮抗作用Fig.6 Inhibitory effect of crude protein on Fusarium oxysporum
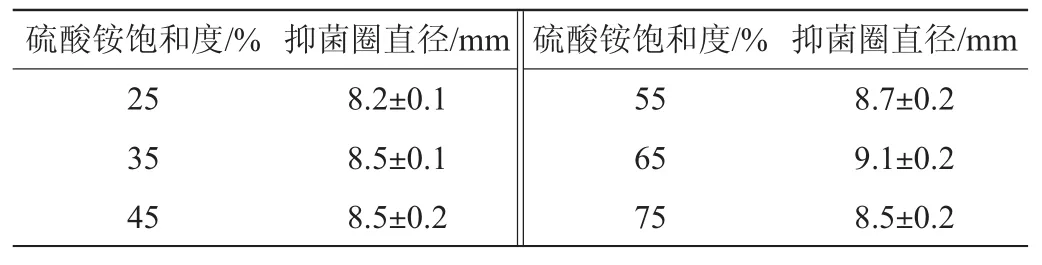
表4 不同硫酸铵饱和度提取的蛋白对尖孢镰刀菌的抑菌效果Table4 Antibacterial effect of protein extracted by different ammonium sulfate saturation on Fusarium oxysporum
由图6及表4可知,硫酸铵饱和度在25%~75%范围内析出的蛋白对尖孢镰刀菌均有一定的拮抗作用(抑菌直径均>8.2 mm),其中硫酸铵饱和度达到65%时,抑菌效果最佳抑菌直径可达(9.1±0.2)mm。因此,B.velezensis P9可代谢产生对尖孢镰刀菌具有抑制作用的蛋白。
2.4.3 脂肽类粗提液对尖孢镰刀菌的拮抗作用
以无菌水作为对照,无菌脂肽类粗提液对尖孢镰刀菌的拮抗作用结果如图7所不。

图7 粗脂肽尖孢镰刀菌的拮抗作用Fig.7 Inhibitory effect of crude lipopeptide on Fusarium oxysporum
由图7可知,B.velezensis P9不仅能产生抗菌蛋白,而且也能产生抑菌脂肽类物质,其抑菌圈直径为(8.8±0.2)mm。结果也表明,Bacillusvelezensis P9能通过分泌抗菌蛋白类物质和抑菌脂肽类物质共同作用实现对尖孢镰刀菌的拮抗作用。
3 结论
从清香型白酒大曲中筛选出一株对尖孢镰刀菌具有较强拮抗作用的芽孢杆菌,编号为P9。经形态学观察、生理生化试验及16SrRNA序列比对分析,鉴定菌株P9为贝莱斯芽孢杆菌(Bacillus velezensis)。B.velezensis P9经过6 h的迟缓期后进入对数生长期,在第9小时生长速率达到最大,第14小时后进入平稳期。通过提取B.velezensis P9的抑菌物质发现,拮抗菌P9既能产生蛋白类物质进行抑菌,也能产生具有拮抗作用的脂肽类物质。
