当归根系土壤有机磷降解菌的分离鉴定及其生长特性的研究
2018-11-05王治业杜津昊彭轶楠巩晓芳祁宏山
陈 娟,王治业*,杜津昊,曾 杨,彭轶楠,季 彬,巩晓芳,祁宏山
(1.甘肃省科学院 生物研究所,甘肃 兰州 730000;2.甘肃省微生物资源开发利用重点实验室,甘肃 兰州 730000)
自20世纪60年代以来,许多国家开始禁止或限制使用有机氯农药,高效、低成本的有机磷农药(organophosphorus pesticides,Ops)作为有机氯的取代物[1]迅速在国内外大量生产或使用,并逐步发展成为一类高效、广谱的农药产品[2]。有机磷农药的广泛使用大大促进了农业生产[3],但由于其大多属于中高毒性农药,且多具有内吸毒性,在环境中残留量大,难以自然降解,因此在保护农作物的同时,也造成了严重的环境污染,己经给生态环境和人体健康造成了巨大的危害和深远的影响。因此迫切需要建立一种有效的方法消除或减少机磷农药的污染[4]。
目前,降解有机磷农药的方法主要有物理降解、化学降解和生物降解[5]。传统的物理和化学方法成本高,并可能产生新的污染物,且作用相对较慢。利用微生物或生物产品来降解污染物的生物修复法[6]是指在微生物作用下使农药的结构发生改变,导致农药的化学和物理性质改变的过程,通过将农药从大分子化合物降解为小分子化合物,最后成为H2O与CO2,实现对环境的无害化降解。与传统的物理、化学方法相比,微生物降解法是一个新的农药降解途径,其优势在于投入低、无毒、无残留、无二次污染,治理效果也相对明显[7]。随着农药残留问题的日益突出和人们环保意识的提高,目前国内外对于降解无机磷的菌株研究较多[8-10],而对于以卵磷脂和植酸磷为惟一磷源的有机磷降解菌的筛选则研究比较少[11-12]。
此研究选择以植酸钙和卵磷脂为唯一磷源,从当归根系土壤中分离筛选有机磷高效降解菌,分离筛选出一株或几株能够高效广谱降解有机磷农药的菌株,并对其进行形态学、生理生化特性、分子生物学鉴定及生长特性的研究,以期为降解土壤有机磷的微生物肥料提供高效稳定的生产菌种,为后续研制具有降解土壤有机磷功效的生物有机肥提供高效、稳定的菌种及基础资料。
1 材料与方法
1.1 材料与试剂
1.1.1 土样采集
2014年9月,利用对角线布点法,从岷县麻子川乡当归试验田采集当归根系土壤样品,4℃保存。
1.1.2 对照菌株
巨大芽孢杆菌(Bacillus megaterium)1.223:由中国普通微生物菌种保藏管理中心提供,是解磷微生物肥料生产的常用菌种。
1.1.3 培养基
植酸钙固体培养基:葡萄糖10.0 g,(NH4)2SO40.2 g,MgCl2·6H2O 5.0 g,MgSO4·7H2O 0.5 g,KCl 0.1 g,植酸钙2.0 g,琼脂15~18 g,蒸馏水1 L。用该培养基筛选得到的菌株为植酸钙降解菌。
蒙金娜固体培养基:葡萄糖10.0 g,(NH4)2SO40.5 g,MgSO4·7H2O 0.3 g,NaCl 0.3g,KCl 0.3 g,FeSO4·7H2O 0.03 g,MnSO4·4H2O 0.03 g,CaCO35.0 g,蛋黄卵磷脂1.0 g,琼脂15~18 g,蒸馏水1 L。用该培养基筛选得到的菌株为卵磷脂降解菌。
1.2 仪器与设备
AS型干燥箱:北京科伟永兴仪器有限公司;LBH-300T多功能粉碎机:永康科徠尔有限公司;SKY-100C恒温摇床:上海苏坤实业有限公司;岛津UV-120-02紫外可见分光光度计:杭州库仑科技有限公司;MJ-150Ⅱ培养箱:上海一恒科技有限公司;ZRN-PH-D型台式pH计:北京中瑞能仪表技术有限公司。
1.3 方法
1.3.1 解磷菌的初筛
菌株初筛采用稀释平板涂布分离法。准确称取10 g过100目筛的土样,加入无菌水100 mL,再加入适量玻璃珠,振荡30 min,按10倍稀释法配制土壤悬液,取三个稀释度(10-4~10-6)的土壤悬液,接种于有机磷平板培养基上,接种量为0.1 mL,设置3个重复,在28℃的恒温培养箱倒置培养7 d,观察记录具有透明圈的菌落。
1.3.2 解磷菌的分离纯化
将具有解磷圈的菌落分离纯化,进一步在有机磷分离培养基上进行筛选,测量解磷圈直径(D)和菌落直径(d)。
将D/d>1.5的菌株进一步通过划线法纯化[13],直至得到纯菌株之后,转至牛肉膏蛋白胨斜面培养基上,30℃条件下静置培养24 h,于4℃冰箱保存,作为后续试验用菌株。
1.3.3 解磷菌的复筛
将初筛获得的解磷菌及菌株1.223菌悬液按照接种量2%(V/V)接种至植酸钙液体培养基中,以培养基中加入等体积的无菌水作为对照,每个处理进行3次重复,28℃、120r/min条件下振荡培养8 d,分析菌株对有机磷的降解率。
1.3.4 分析检测[14]
采用钼锑抗比色法分别测定其培养前后总磷和无机磷含量,再计算出培养前后有机磷含量的变化情况,从而得出菌株对有机磷的降解率。有机磷含量、菌株对有机磷的降解率的计算公式如下:

1.3.5 细菌16SrDNA的扩增与测序
(1)细菌总脱氧核糖核酸(deoxyribonucleic acid,DNA)的提取
参照文献[15]采用十六烷基三乙基溴化铵(cetyltriethylammonium bromide,CTAB)法提取细菌总DNA。
(2)引物
采用细菌16SrDNA[16]通用引物进行聚合酶链反应(polymerasechain reaction,PCR)扩增,其引物序列:
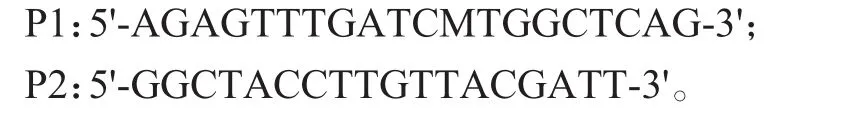
(3)聚合酶链式反应条件
97℃预变性5 min;96℃变性1 min,56℃退火1 min,76℃延伸2 min,30个循环;76℃再延伸10 min。将聚合酶链式反应产物纯化回收后,送上海生工生物工程股份有限公司测序。
1.3.6 菌株最适生长条件的研究
(1)最适pH的测定
用1 mol/L HCl和1 mol/L的NaOH调节有机磷培养基的初始pH[17],使培养基的初始pH分别为4.0、5.0、6.0、7.0、8.0、9.0、10.0,每个处理3个重复,接种量为5%,接种后在28℃、200 r/min条件下振荡培养24 h,测定OD600nm值[18],以确定其生长的最适pH。
(2)最适温度的测定
设置培养温度分别为(15℃、20℃、25℃、30℃、35℃、40℃、45℃),接种量为5%,200r/min条件下振荡培养24h[19],每个处理3个重复,测定OD600nm值,以确定其生长的最适温度。
2 结果与分析
2.1 解磷菌的初筛

图1 植酸钙平板培养条件下菌株w-1,w-2,w-3分解有机磷的能力Fig.1 Organophosphorus-degrading ability of strain w-1,w-2 and w-3 on calcium phytate plate
从使用过有机磷农药的当归生地育苗土壤采集被农药污染的土样,利用富集培养的方法,通过筛选、分离,共获得3株生长良好的土壤有机磷降解菌,命名为菌株w-1、w-2、w-3。这3株有机磷降解菌都是植酸钙降解菌,未分离得到卵磷脂降解菌,其产生透明圈见图1。由图1可知,菌株w-1、w-2、w-3在植酸钙固体培养基上均有明显的透明圈产生,表明得到的菌株为植酸钙降解菌,将其分别接种于牛肉膏蛋白胨斜面上成斜面菌种,于4℃保存备用。
2.2 有机磷降解菌在植酸钙固体平板上的解磷特性
通过上一步的初筛,获得了3株植酸钙降解菌,因此本研究采用含植酸钙的固体平板培养基测定分离菌株的解磷能力,利用菌落周围产生的透明圈大小(直径D)和菌落本身大小(直径d)比值来初步判断细菌的解磷能力,结果见表1。由表1可知,菌株w-1、w-2、w-3的D/d值分别为1.39、1.47、1.72,筛选出D/d>1.5的解有机磷菌株1株(菌株w-3)。
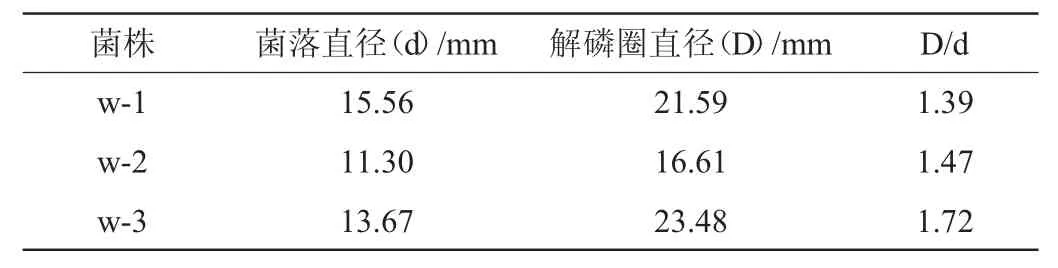
表1 不同解磷细菌菌株的特征Table1 Characteristics of different phosphate-degrading bacteria
2.3 解磷菌的复筛
将初筛获得的菌株w-3及菌株1.223的菌悬液按照接种量2%(V/V)接种至植酸钙液体培养基中,以植酸钙液体培养基中加入等体积的无菌水作为对照,探讨菌株w-3对植酸钙的解磷能力,其测定结果见表2。
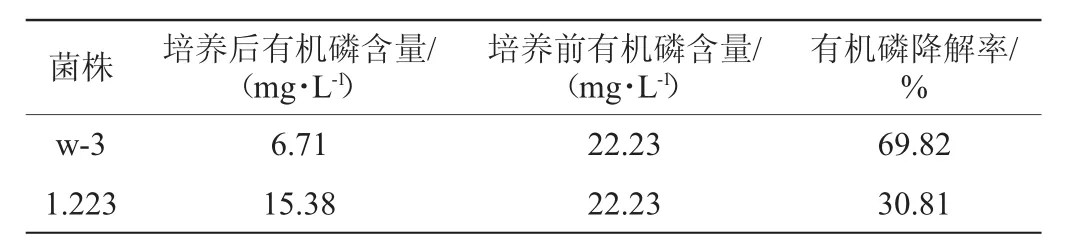
表2 基于植酸钙液体培养基法测定菌株w-3的有机磷降解能力Table2 Organophosphorus-degrading ability of strain w-3 by calcium phytate fluid medium method
由表2可知,菌株w-3的有机磷降解率为69.82%,高于对照菌株1.223的30.81%,是菌株1.223的2.27倍。结果表明,菌株w-3具有较强的分解植酸钙的能力。
2.4 菌株w-3的形态特征及生理生化特性
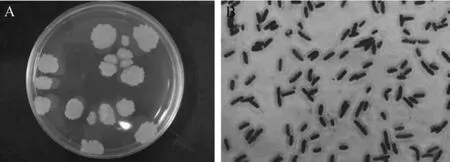
图2 菌株w-3的菌落(A)和细胞(B)形态Fig.2 Colonial(A)and cell(B)morphology of strain w-3
菌株w-3的形态特征及生理生化特性见图2。由图2A可知,菌株w-3在营养琼脂平板上生长48h后可形成较大菌落。菌落边缘不整齐,表面有褶皱、隆起,粗糙不透明,呈污白色或微黄色,湿润易挑起,单菌落一般呈圆形状。由图2B可知,经革兰氏染色观察,菌株w-3为革兰氏阳性菌。

表3 菌株w-3的生理生化特征Table3 Physiological and biochemical characteristics of strain w-3
2.5 16SrDNA的扩增与测序
以细菌16SrDNA通用引物对菌株w-3进行PCR扩增16SrDNA基因序列见图3。

图3 菌株w-3的16S rDNA序列Fig.3 16S rDNA sequence of strain w-3
由图3可知,获得了1.5 kb左右的16SrDNA片段。将测序序列利用Genbank DNA数据库进行BLAST相似性比较,利用MEGA6.0软件构建菌株w-3系统发育树,结果见图4。由图4可知,菌株w-3的16SrDNA序列和枯草芽孢杆菌(Bacillus subtilis)的同源性都在99%以上,依据细菌分类学家普遍认可的原则:当16SrDNA全序列同源性>97%为属内同一种,93%~95%为属外成员。因此,菌株w-3被鉴定为枯草芽孢杆菌(Bacillussubtilis)。

图4 菌株w-3基于16S rDNA基因序列系统发育树Fig.4 Phylogenetic tree of strain w-3 based on 16S rDNA gene sequence
2.6 菌株最适生长条件的研究
2.6.1 最适初始pH的测定
pH值是菌种生长的环境因子,对微生物的生长繁殖和代谢产物的积累有重要的影响,不同的微生物类群生长对pH的要求不同。一般而言,细菌适合在中性偏碱的情况下生长,而真菌则喜好微酸环境。有机磷降解菌是利用有机磷降解酶降解有机磷,因此确定合适的pH,有利于提高有机解磷酶的活性,从而提高降解有机磷的效率。不同pH条件下菌株w-3的生长状况见图5。
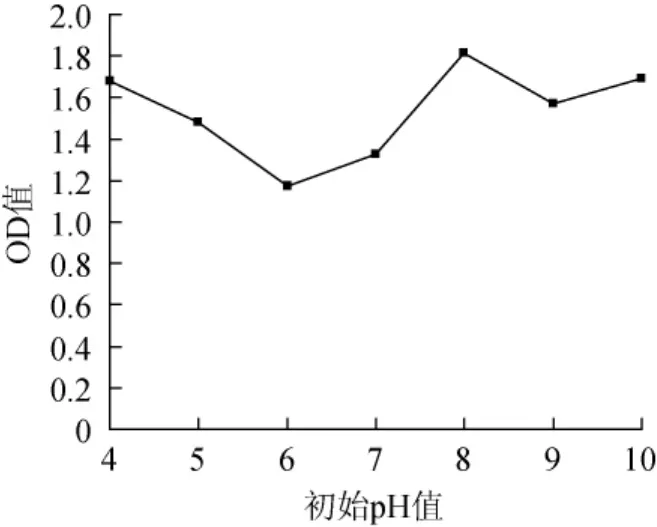
图5 培养基初始pH值对菌株w-3生长的影响Fig.5 Effect of initial pH value of medium on the growth of strain w-3
由图5可知,菌株w-3对生长pH的要求并不是很严格,在广泛的pH值4.0~10.0范围内生长良好,在pH 8.0的生长环境下,该细菌的生长最旺盛。因此,选择pH 8.0作为培养基最适初始pH值。
2.6.2 最适温度的测定
温度对微生物的影响突出,影响酶促反应动力学、微生物生长速率等,温度过高微生物无法生存,温度过低微生物的活性受到抑制,因此合理控制温度对微生物的生长非常的重要。不同温度条件下,菌株w-3的生长状况结果见图6。
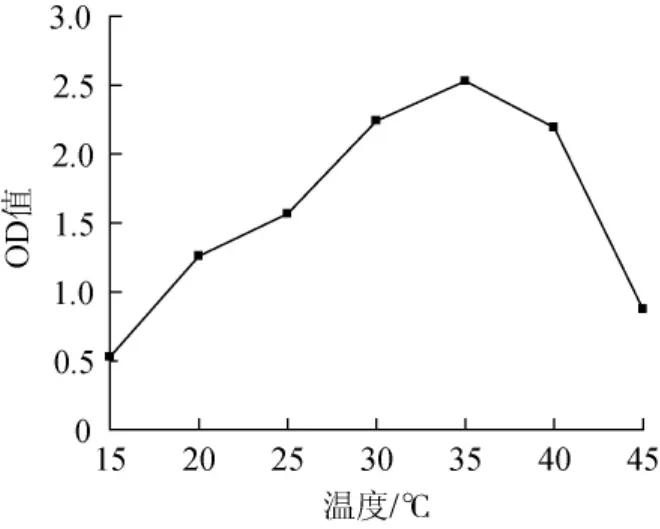
图6 温度对菌株w-3生长的影响Fig.6 Effect of temperature on the growth of strain w-3
由图6可知,在考察的7个温度梯度中,菌株w-3在15~35℃的生长量随着温度的升高而增大,在35℃时生长量最高,OD600nm值达到2.530;温度为40℃时,OD600nm值为2.189,略低于35℃时的生长量;当温度再升高至45℃时,生长量急剧下降,OD600nm值为0.878。因此,确定菌株w-3的最适生长温度为35℃。
3 结论
从当归生地育苗土壤中分离得到降解有机磷菌株w-3,其对植酸钙有较强的降解能力,其解磷率可达到69.82%;通过形态学观察、生理生化特征及16SrDNA同源性比较,鉴定该菌株为枯草芽孢杆菌(Bacillussubtilis)。
本实验所分离得到的有机磷降解菌w-3有较广的pH值的适应范围,可在pH4.0~10.0条件下生长良好,其最适pH值为8.0;温度对w-3活性影响较大,最适宜的生长温度为35℃。
菌株w-3于2017年06月15日保藏在甘肃省工业微生物菌种保藏中心,保藏号为GSCII 32901。本实验所分离筛选的菌株w-3对植酸磷具有良好的解磷效果,达到了实验筛选有机磷降解菌的目的。菌株w-3溶磷能力指标的相关性还有待进一步研究。
枯草芽孢杆菌降解有机磷农药具有重要意义,不仅可以达到为植物生长提供磷源的目的,而且能够在一定程度上消除农药污染。以此实验为基础,通过对菌株的开发可以加工成微生物菌肥,以基肥、准肥等形式施用到农田中,这样既可以改善土壤缺磷状况又能够降解土壤中残留的农药,为农业的可持续发展提供保障。
