过表达FOXC1基因对口腔鳞状细胞癌增殖凋亡及迁移能力的影响
2018-11-01任仪鹏董丽平
冯 晋 任仪鹏 董丽平
口腔鳞状细胞癌(Oral cavity squamous cell carcinoma,OSCC),是头颈部恶性肿瘤的一种,在所有新发的恶性肿瘤病例中约占3%[1]。其极具侵袭性、转移性以及复发性的特点使该肿瘤的治疗手段效果有限,严重威胁人类生命健康。因此阐明OSCC分子机制,探寻影响OSCC发生发展的关键靶分子是研究OSCC亟待解决的关键问题。大量文献报道,人类的叉头框(FOX)基因家族是一种至少由43个成员组成的转录因子家族,调节各种各样的生物进化过程,并参与肿瘤的发展[2]。叉头框C1(FOXC1)转录因子基因,是叉头框家族的一员,它位于染色体6p25[3],调节多种生物学过程,包括细胞分化状态、胚胎发育,此外也包括肿瘤发生和发展。然而FOXC1是否参与口腔鳞癌的发生、发展及预后报道较少。为进一步了解FOXC1在OSCC恶性生物学行为中的作用,本研究构建过表达FOXC1的OSCC细胞系SCC-9-FOXC1,通过上调FOXC1的表达,评估SCC-9细胞增殖活性、凋亡水平和细胞运动迁移能力,为阐明FOXC1在OSCC中的作用提供理论基础。
1.材料与方法
1.1材料 口腔鳞癌细胞系SCC-9细胞购自中国科学院。胰蛋白酶-EDTA消化液(0.25%)购自Solarbio公司;Lipofectamine R○3000购自invitrogen公司;Annexin V-FITC/PIApoptosis Kit、Cell Cycle Staining Kit购自联科生物;氨苄青霉素、LB琼脂购自海博生物;质粒小提试剂盒、普通琼脂糖凝胶DNA回收试剂盒购自天根生物;CCK8检测试剂盒、FOXC1抗体购自凯基生物。
1.2方法
1.2.1 FOXC1过表达慢病毒载体的构建NCBI查找FOXC1的基因的CDS序列,添加酶切位点BamHI/XbaI,与载体plvxpuro连接,构建慢病毒重组载体FOXC1-plvxpuro,转化感受态细胞,对质粒给予电泳验证。
1.2.2 FOXC1过表达慢病毒载体转染SCC-9细胞 实验分为三组:(1)空白对照组(2)慢病毒空载体组(3)FOXC1过表达组。按照Lipofectamine R○3000试剂使用说明,低温环境下配制DNA-脂质体复合物,并室温避光孵育1h后,将DNA-脂质体复合物加入至细胞中。在培养板上标记各组别,置于37℃,5%CO2培养箱孵育细胞。
1.2.3 q-PCR检测3组细胞FOXC1的表达情况 根据FOXC1基因序列,设计其特异检测引物,FOXC1和GAPDH特异检测引物见表1,以经FOXC1过表达慢病毒载体转染SCC-9细胞的总RNA为模板,q-PCR检测各基因的表达情况,空白对照和空载感染的SCC-9细胞的同样检测作为对照,GADPH基因的相同检测作为内参。
1.2.4 Western Blot检测3组细胞FOXC1的表达情况 取各组细胞进行加入组织裂解液,裂解30min后,4℃,10000rpm/min离心10min,小心吸取上清,即可获得总蛋白。根据BCA试剂盒测定蛋白浓度。蛋白变性后上样,再进行十二烷基苯磺酸钠凝胶电泳1~2h,后湿法转膜30~50min。4℃孵育一抗过夜;二抗溶液中室温孵育1~2h。在膜上滴加ECL曝光液,在凝胶成像系统中曝光。利用“Quantity one”软件进行各抗体条带灰度值的分析。
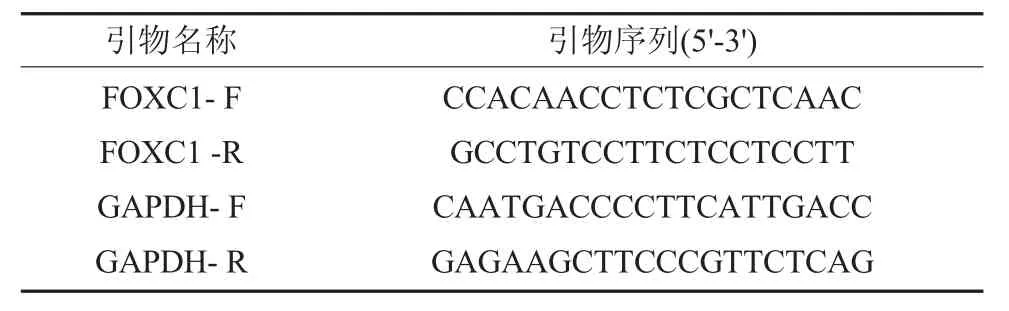
表1 本研究所用的引物序列
1.2.5 CCK8检测细胞增殖 弃含药培养基,每孔加入新鲜配制的含10μL的毒性检测液CCK8,置于培养箱中继续培养4h后,用酶标仪测波长为450nm的OD值。实验重复3次,取实验结果的平均值作为最终实验结果。
1.2.6细胞划痕实验检测细胞迁移 直尺和marker笔在操作前紫外照射30min(超净台内)。先用marker笔在24孔板背后,用直尺比着孔的正中央,均匀地划横线,横穿过孔。在孔中加入约5×105个细胞。次日用枪头比着直尺,尽量垂直于背后的横线划痕。PBS洗细胞3次,去除划下的细胞,加入无血清培养基。放入37度5%CO2培养箱培养48h。
1.2.7流式检测细胞周期 细胞进行转染48h后,弃去培养液,PBS洗2次,加入胰蛋白酶消化1min,加入含10%FBS的DMEM,将细胞吹打下来并吸取到1.50mL离心管中,离心,弃去上清液,用PBS洗涤细胞两次(2000rpm离心5min),收集1-5×105细胞,再加入1mL70%的乙醇溶液,放入4℃条件下两小时进行细胞固定。
1.2.8流式检测细胞凋亡 将细胞接种于6孔板。48h后,消化收集细胞,避光染色30min上机检测。按照Annexin V-FITC/PI细胞凋亡检测试剂盒说明书的方法,在1h内进行流式细胞仪检测。
1.2.9统计学分析 所有数据均用Graph Pad Prism 7统计分析。采用单因素方差分析比较三组及以上组间差异,两组比较时采用t检验进行统计分析,P<0.05作为显著性差异,以*表示。
2.结果
2.1过表达FOXC1细胞系SCC-9-FOXC1的构建与转染效率鉴定 首先提取重组质粒FOXC1-plvxpuro,经BamHI/XbaI酶切后,理论上应该得到8071bp和1674bp的条带,酶切结果如图1所示,电泳检测结果与理论值相符,证明FOXC1过表达慢病毒载体构建正确。
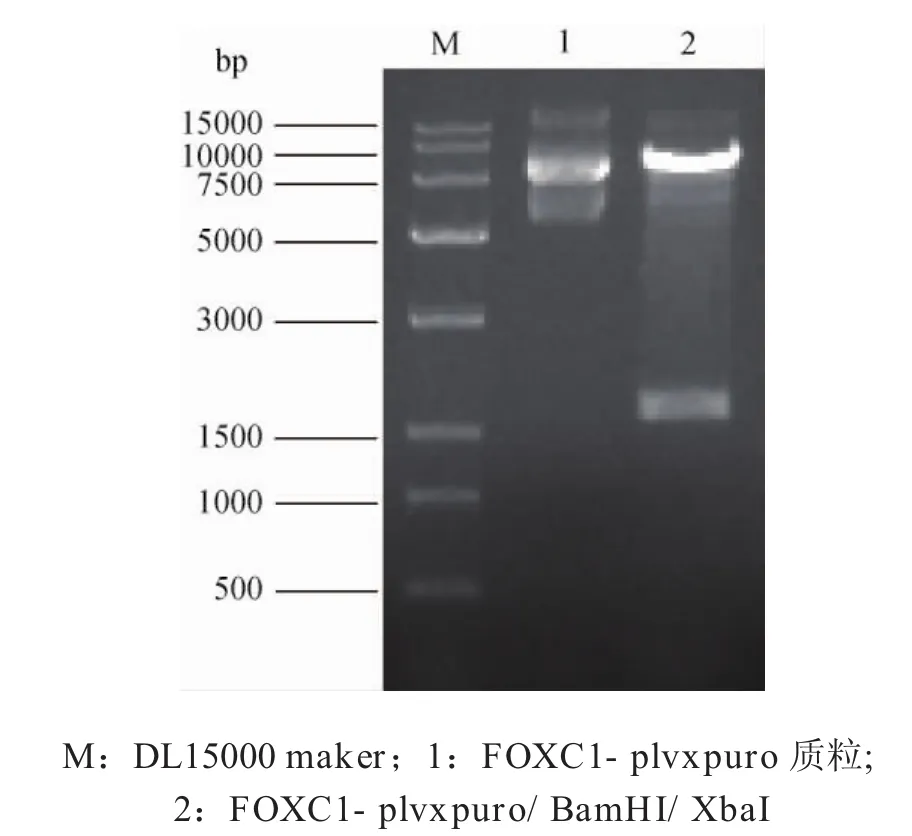
图1 酶切电泳示意图
随后Real-time PCR对三种口腔鳞癌细胞系SCC-9,转入空载体的SCC-9细胞SCC-9 vector以及过表达FOXC1基因的SCC-9细胞SCC-9 FOXC1中目的基因FOXC1的mRNA水平进行检测,结果如图2a所示。试验结果表明,与对照组细胞和转染空载体细胞组相比,转染FOXC1的细胞中,FOXC1 mRNA显著高表达(P<0.05)。进一步应用Western blot检测FOXC1在上述三种细胞中的蛋白表达水平。如图2b所示,FOXC1蛋白在三株细胞中均有表达,但是在与对照组相比,实验组细胞中FOXC1的表达更高。以上试验提示,上述基因转染体系成功、完整,所构建的FOXC1过表达的细胞可用于后续生物学功能的试验。
2.2过表达FOXC1基因显著抑制口腔鳞状细胞增殖 为了检测上调FOXC1是否对SCC-9细胞的增殖活力产生影响,我们应用CCK-8试剂对三株细胞的增殖活力进行了检测。如图3所示,与对照组SCC-9和SCC-9vector相比,过表达FOXC1细胞的活力受到显著抑制(P<0.05),在相同的培养时间和处理条件下,实验组细胞的增殖活力约为对照组的1/4。为了进一步明确其增殖活力被抑制可能的机制,我们又对三株细胞进行了细胞周期检测,试验结果表明(图4),实验组细胞周期与对照组不同,G2期细胞明显减少,S期细胞显著增多(P<0.05),提示过表达FOXC1后,肿瘤细胞出现了S期阻滞。上述试验结果表明,过表达FOXC1可以在一定程度上通过对肿瘤细胞生长过程中S期的阻滞,抑制肿瘤细胞的增殖活力。
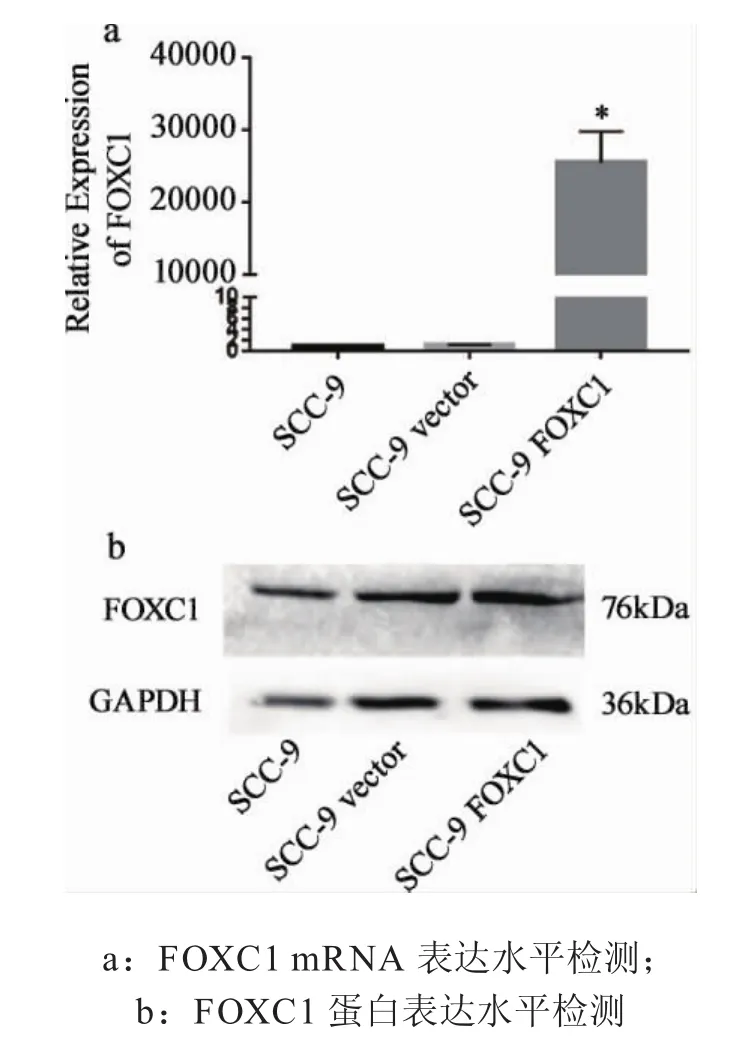
图2 FOXC1过表达于SCC-9细胞
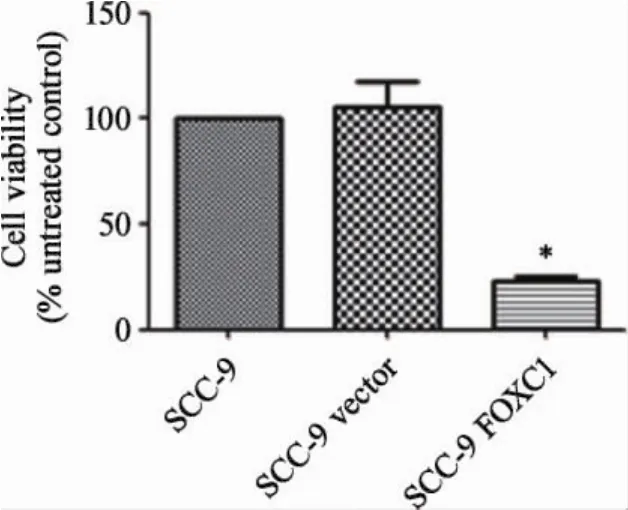
图3 过表达FOXC1抑制SCC-9细胞增殖
2.3过表达FOXC1基因显著促进口腔鳞癌细胞凋亡 通过流式细胞仪对三株细胞系的凋亡能力进行比较(图5),发现与对照组相比,实验组细胞凋亡能力明显升高,凋亡细胞比例约为对照组的3倍(P<0.05),提示FOXC1的上调可以促进SCC-9细胞的凋亡。
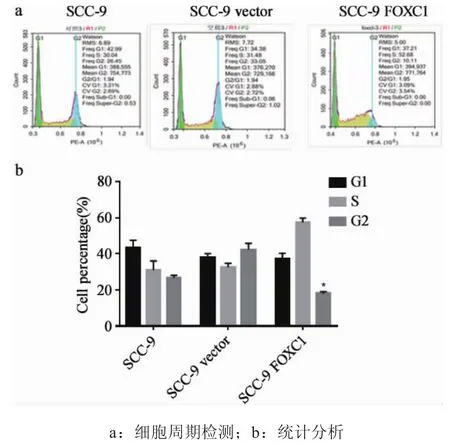
图4 过表达FOXC1阻滞细胞S期
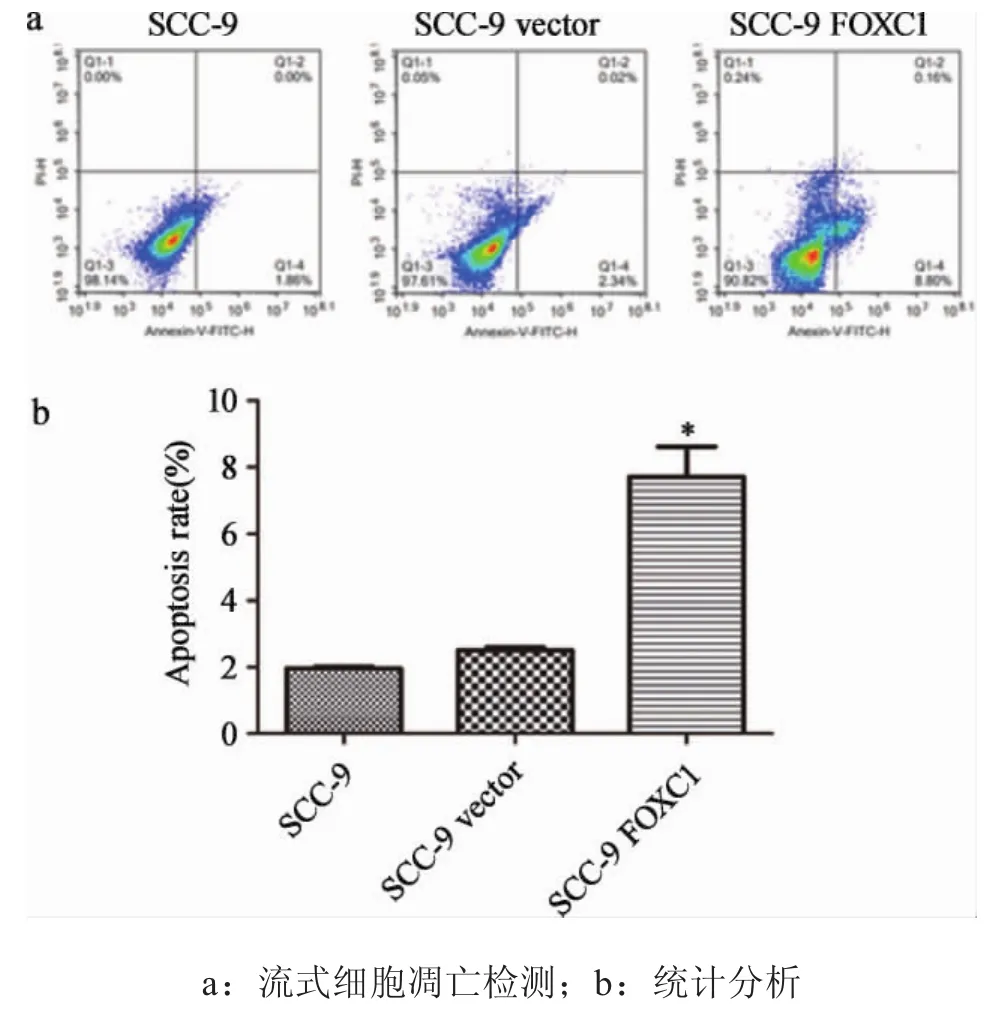
图5 过表达FOXC1促进肿瘤细胞凋亡
2.4过表达FOXC1基因显著抑制口腔鳞癌细胞迁移和运动 口腔鳞癌细胞因具有较强的迁移运动能力而更易发生侵袭转移,严重影响预后。通过细胞划痕试验,我们发现过表达FOXC1后,细胞的迁移能力有所下降,约为空白对照组的1/2。值得一提的是,在本实验中,我们发现转入空载体的细胞与空白对照相比,其运动能力也有所下降(P<0.05),这可能是由于在细胞转染的过程中,空载体对细胞的运动能力能够造成一定程度的抑制。尽管如此,我们可以看到,与空载体组相比,试验组细胞的运动能力仍显著降低(P<0.05),高度提示FOXC1的上调是造成SCC-9细胞运动能力下降的关键因素。
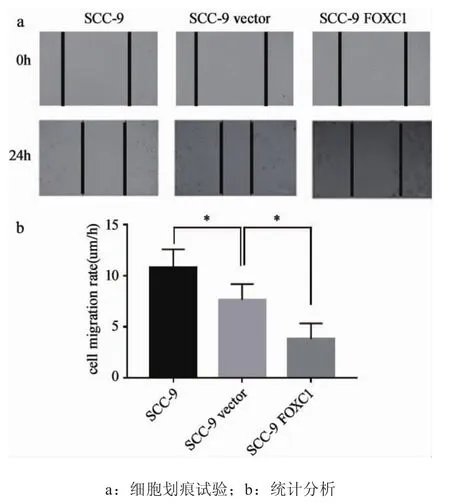
图6 过表达FOXC1抑制肿瘤细胞运动
3.讨论
口腔恶性肿瘤是头颈部恶性肿瘤的一种。由于该疾病起病隐匿,易于侵犯临近组织,给该疾病的治疗带来一定的难度,口腔恶性肿瘤的个体化和分子靶向治疗也发展较慢,上述种种因素最终导致该疾病预后较差,五年生存率较低[4,5]。
转录因子FOXC1属于FOXC家族,该家族目前发现2个成员,分别为FOXC1和FOXC2。早期对FOXC1的研究发现,其主要与Axenfeld-Rieger综合症和胚胎发育有关[6-9],近年来的研究表明,FOXC1在肿瘤发生、发展中也发挥重要作用。然而关于FOXC1在肿瘤中究竟扮演癌基因还是抑癌基因的角色,现有报道仍未达成普遍共识。一方面,Hayashi等[10]发现FOXC1与Notch信号和血管内皮生长因子相互作用多步骤地调节血管基因的表达,诱导肿瘤血管生成;Wang等[11]研究显示在人基底样乳腺癌中FOXC1可以通过激活NF-κB信号通路促进体外癌细胞系的增殖、侵袭及迁移。另一方面,Zhou等[12]的研究发现,TGF-β1可以通过上调FOXC1的表达从而负性调控多种肿瘤细胞的增殖,间接提示FOXC1可以抑制肿瘤的发生发展;我国学者任琛琛等[13]研究也表明,上调FOXC1的表达可以显著抑制胰腺癌细胞SKOV3细胞的增殖和侵袭能力。正因如此,科学家给出的解释是:FOXC1表达水平的精准调控是维持机体稳态的重要因素,一旦FOXC1表达失调,无论过高或过低可能都会引起机体稳态失衡,进而诱发肿瘤的发生。关于FOXC1表达精准调控的观点也有证据可循,有研究发现FOXC1拷贝数的增加或减少都可以导致视前段发育缺陷,这说明FOXC1基因表达水平的精确调控对正常发育亦至关重要[6]。
口腔鳞状细胞癌的分子生物学机制[14,15]是一个多基因参与的复杂的生物学过程,目前人们对口腔鳞癌潜在分子机制了解较少。因此,在本研究中,我们揭示了FOXC1参与口腔鳞癌的发生发展过程,并证实过表达FOXC1会在一定程度上抑制肿瘤细胞的增殖和迁移能力,并能够促进肿瘤细胞发生凋亡。通过进一步探讨FOXC1在口腔鳞癌中的确切分子机制,或可为今后口腔鳞癌的个体化治疗提供新的靶点和有效治疗策略。
