CYP7A1基因启动子克隆及萤光素酶报告基因载体构建
2018-10-23张照研王宇光高月
张照研,王宇光,高月
1.北京工业大学 生命科学与生物工程学院,北京 100124;2.军事科学院 军事医学研究院 辐射医学研究所,北京 100850
细胞色素 P450 7A1(cytochrome P450 7A1,CYP7A1)是细胞色素P450超家族的一个亚型,也称胆固醇7α-羟化酶,属于氧化还原酶类[1]。CYP7A1能将胆固醇转化为7α-羟基胆固醇,是胆汁酸合成中的第一步和限速步骤。内源性胆固醇和胆汁酸水平可严格调控CYP7A1的基因表达,以维持上述2种成分的体内水平[2-7],在胆酸和胆固醇代谢中起重要作用。因此,深入研究对CYP7A1具有调控作用的药物和天然产物,对以胆固醇和胆酸代谢为特征的相关疾病治疗具有重要价值。本研究旨在构建以CYP7A1基因启动子为启动序列的双萤光素酶报告基因系统,为进一步研究中药及其成分对CYP7A1的调控机制提供有效筛选模型。
1 材料和方法
1.1 材料
HepG2细胞购于中国医学科学院基础医学研究所,由本实验室冻存保种;大肠杆菌DH5α感受态细胞购于北京博迈德生物技术有限公司;限制性内切酶KpnⅠ和HindⅢ、T4DNA连接酶、DL2000和 DL10000 DNA marker、dNTP 混合物、10×缓冲液、ExTaqDNA聚合酶、pMD19-T质粒购于宝生物工程(大连)有限公司;LipofectAMINE 2000、TRIzol购于Invitrogen公司;PCR反转录试剂盒、小量质粒抽提试剂盒、DNA胶回收试剂盒购于天根生物技术公司;双萤光素酶报告基因检测试剂盒购于普洛麦格(北京)生物技术有限公司;引物由北京博迈德生物技术有限公司合成;24孔细胞培养板购于Corning公司;酵母提取物、胰蛋白胨、琼脂粉等试剂购于Oxford公司;DMEM培养基购于Gibco公司;胎牛血清购于Thermo Fisher Scientific公司;胰蛋白酶购于Sigma公司;青霉素链霉素双抗溶液购于HyClone公司。
PCR仪、Victor X多标记酶标仪(Perkin Elmer公司);电泳仪、电泳槽设备、成像系统(Bio-Rad公司);3110细胞培养箱(Thermo公司);Mi⁃crofuge 22R台式高速离心机(Beckman公司);Ax⁃iovert 40倒置显微镜(Zeiss公司)。
1.2 报告基因质粒的构建
1.2.1 目的片段获得 从L02细胞中提取基因组DNA。设计CYP7A1启动子PCR扩增引物,并分别引入KpnⅠ、HindⅢ酶切位点,根据启动子ATG上游2100 bp序列及载体的多克隆位点信息,分别设计上游引物(GCGGTACCCCATCAGATCTCA TGAAATT,添加KpnⅠ酶切位点)、下游引物(GG ATCCCATGCATGATGCACATGCTA,添加HindⅢ酶切位点),扩增的启动子位置为-2058~+2。
1.2.2 CYP7A1启动子PCR扩增 PCR采用20 μL反应体系(反应条件:94℃ 5 min;94℃ 30 s,60℃ 30 s,72℃ 1 min,36个循环;72℃延伸 10 min)。取5 μL PCR产物加入1 μL 6×上样缓冲液,用0.5% 的琼脂糖凝胶电泳分析。将扩增产物回收纯化,将扩增的启动子片段插入pUC57,构建pUC57-CYP7A1-promoter。
1.2.3 重组质粒的构建及鉴定 将pUC57-CYP7A1-promoter与pGL3-Basic载体双酶切,将2质粒的双酶切产物分别回收纯化后得到已含有粘性末端的载体和插入片段,用T4DNA连接酶于16℃低温恒温反应槽中连接16 h,得到重组质粒。将连接后的产物转化大肠杆菌DH5α感受态,在不含氨苄青霉素的LB液体培养基中于37℃培养1 h后,涂布于含氨苄青霉素的LB琼脂糖培养基上,37℃培养12 h,挑选阳性克隆扩增并提取重组质粒进行双酶切鉴定,将重组质粒进行双向测序拼接确定碱基序列,并进行Blast比对。
1.3 细胞转染和荧光值检测
1.3.1 细胞培养 完全培养基由含10% 胎牛血清、100 μg/mL青霉素和链霉素的DMEM高糖培养基构成,在37℃、5% CO2、饱和湿度的恒温培养箱中培养HepG2细胞,0.25% 胰酶消化传代,取对数生长期的细胞进行实验。
1.3.2 转染和荧光检测 采用转染试剂Lipo⁃fectAMINE 2000进行。取对数生长期HepG2细胞,消化后计数,按每孔2.5×105细胞接种于24孔板中,当细胞密度达约80% 时用Opti-MEM培养液稀释质粒。将500 ng pGL3-CYP7A1-promoterluc(采用测序无误的质粒2、3分别进行实验)、50 ng pRL-TK 内参质粒、2 μL LipofectAMINE 2000混匀;将500 ng pGL3-Basic、50 ng pRL-TK内参质粒、2 μL LipofectAMINE 2000混匀,设置为对照组;质粒与转染试剂室温孵育20 min,24孔板每孔加入100 μL混合转染液,在细胞培养箱中转染6 h,吸去混合液,换含2% 胎牛血清、不含青霉素链霉素双抗的DMEM高糖培养基,在37℃、5% CO2、饱和湿度的恒温培养箱中分别培养24、48 h,吸去各组培养液,PBS洗涤细胞1次,每孔加入100 μL 1×PLB溶液,室温静止裂解15 min,加入100 μL LABⅡ溶液,多功能酶标仪检测各孔的萤火虫萤光素酶活性;接着各孔加入100 μL Stop&Glo试剂,启动海肾萤光素酶反应后,检测海肾萤光素酶活性,并计算荧光值比值。
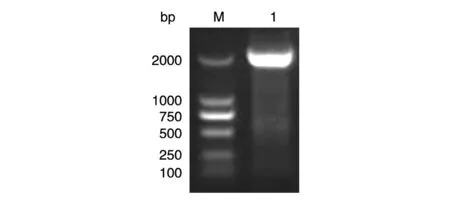
图1 CYP7A1启动子扩增片段(2060 bp)凝胶电泳
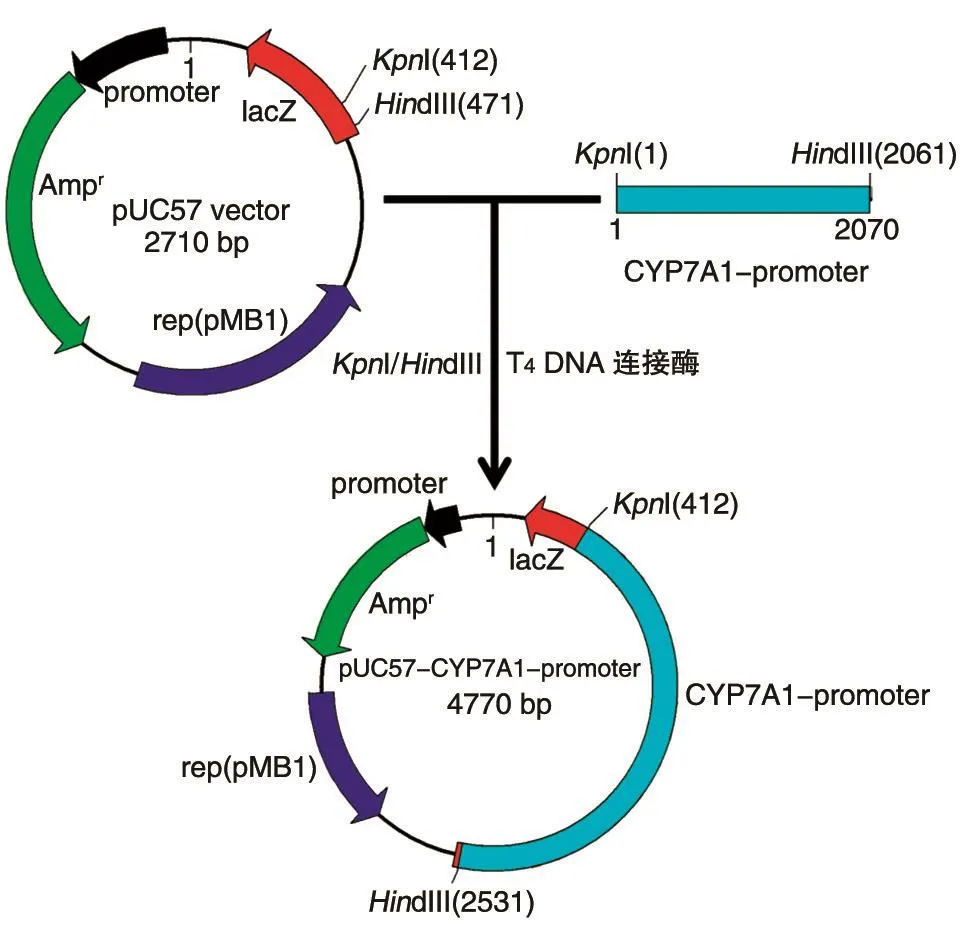
图2 pUC57-CYP7A1-promoter质粒构建示意图
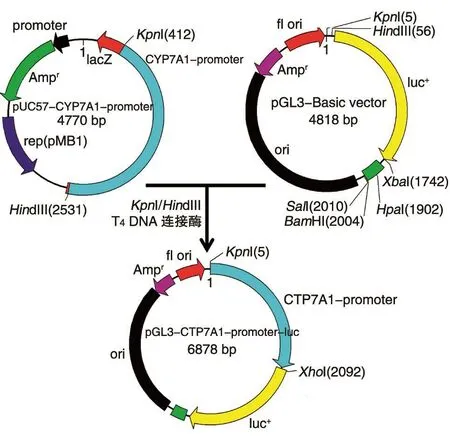
图3 pGL3-CYP7A1-promoter-luc构建过程示意图
1.4 统计学处理
实验数据使用软件SPSS 17.0进行统计学处理,多组数据间比较采用方差分析,两两比较采用t检验处理,P<0.05表示有统计学意义。
2 结果
2.1 CYP7A1启动子扩增的凝胶电泳测定
结果见图1。引物设计PCR的片段大小为2060 bp,PCR产物凝胶电泳显示目的条带约为2000 bp,与CYP7A1启动子大小相符,表明成功扩增了CYP7A1的启动子。对产物进行回收后再次PCR,胶回收产物。
2.2 质粒构建
pGL3-CYP7A1-promoter-luc质粒构建过程如图2、3所示。首先将克隆载体pUC57-vector与PCR扩增的CYP7A1启动子连接。之后,将构建的pUC57-CYP7A1-promoter与荧光载体pGL3-Basic vector用限制性内切酶KpnⅠ、HindⅢ双酶切(图4),回收2060 bp的CYP7A1启动子片段,与pGL3-Basic载体用T4DNA连接酶连接,连接后转化感受态大肠杆菌DH5α,挑单克隆振荡培养,进行菌液PCR验证(图5),经氨苄青霉素筛选得到重组荧光质粒pGL3-CYP7A1-promoter-luc,测序。双酶切pUC57-CYP7A1-promoter与荧光载体pGL3-Basic vector结果显示片段大小符合预期。菌液PCR结果表明,除泳道5、11外,均鉴定为阳性克隆质粒。测序比对发现构建的pGL3-CYP7A1-promoter-luc中的测序片段与CYP7A1启动子一致。以上结果表明成功构建了荧光质粒pGL3-CYP7A1-promoter-luc。
2.3 测序
构建质粒 pGL3-CYP7A1-promoter-luc2、3进行双向测序,拼接后经Blast比对,序列与CYP7A1启动子相同,测序结果显示质粒构建成功(图6)。
2.4 细胞转染和萤光素酶活性测定
分别将pGL3-CYP7A1-promoter-luc2、3质粒转染HepG2细胞,6 h后换含2% 胎牛血清的DMEM培养基,恒温培养箱中培养24、48 h后检测荧光,计算荧光值比值,分别与对照组(pGL3-Basicvector)进行组间t检测。转染pGL3-CYP7A1-promoter-luc2质粒24、48 h后,荧光响应值分别为对照组的13.1±2.8倍(P<0.001)和23.3±2.9倍(P<0.001);转染 pGL3-CYP7A1-promoterluc3质粒24、48 h后,荧光响应值分别是对照组的8.4±1.6倍(P<0.001)和22.1±1.9(P<0.01)倍;结果均有显著性差异(图7),表明质粒pGL3-CYP7A1-promoter-luc2、3均能响应。
3 讨论
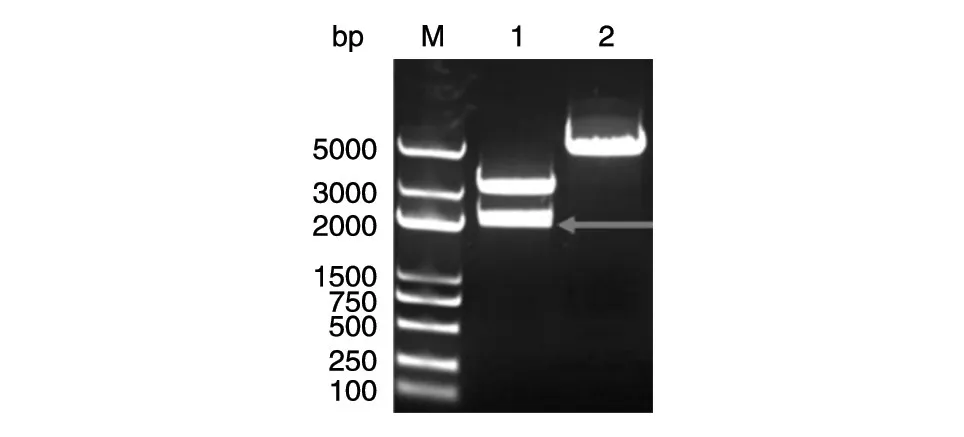
图4 pUC57-CYP7A1-promoter和pGL3-Basic vector的双酶切
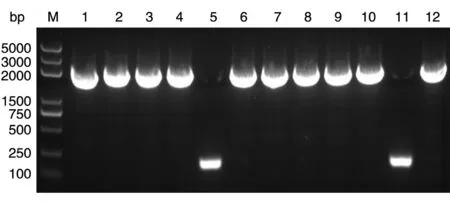
图5 琼脂糖凝胶检测菌液PCR扩增片段
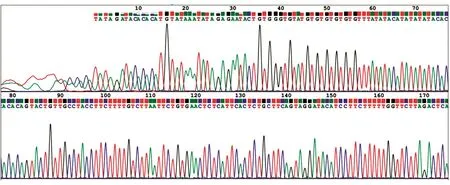
图6 质粒2测序示意图(-20~175 bp)
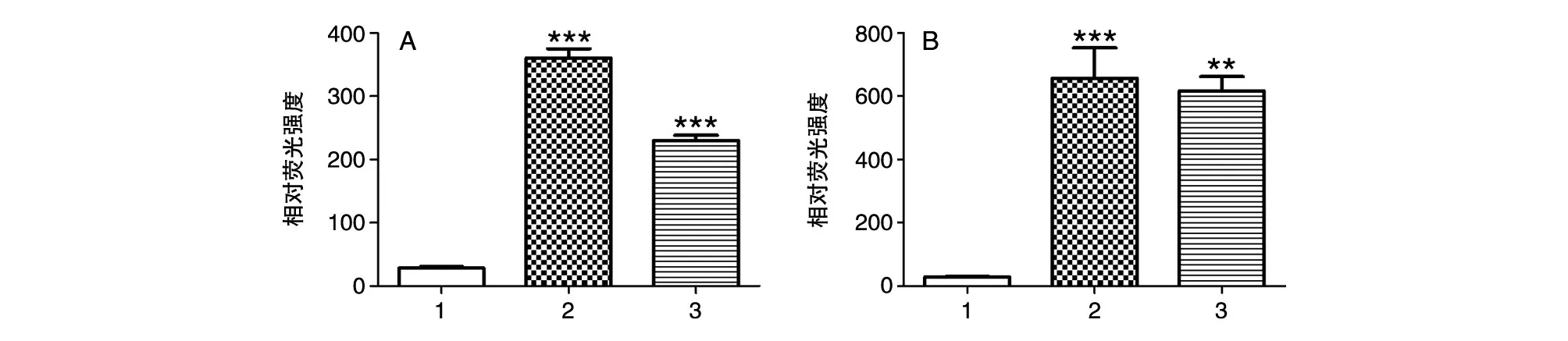
图7 萤光素酶活性测定
报告基因的表达产物为特定蛋白质或酶,可被检测和鉴定,从而间接反映基因调控的效率和特异性。报告基因在表达过程中对细胞或动物正常的生理作用或活性没有影响。常用的报告基因有萤光素酶基因、绿色和红色荧光蛋白基因等[8]。报告基因法在病毒检测和抗病毒药物筛选等方面具有广阔的应用前景[9-11]。本实验室前期曾构建过CYP1A1、CYP2B6、CYP3A4等荧光报告基因载体,并对乌头碱[12]、补骨脂[13]、人参皂苷[14]、麦冬皂苷[15]等成分进行筛选,发现了中药的配伍以及中药有效成分对药物代谢酶的影响规律,为相关中药的临床应用提供了重要依据。笔者采用实验室已构建的CYP3A4启动子的荧光报告基因质粒对何首乌的成分进行筛选,发现其中成分具有上调和下调CYP3A4的作用,该研究为何首乌在临床合理使用提供了实验层面的参考[16-17]。
胆固醇7α-羟化酶是体内胆固醇转化为胆汁酸的经典合成途径的第一限速酶[18],催化胆固醇为7α-羟化胆固醇。胆固醇转化为胆汁酸是其代谢的主要途径[19-20]。CYP7A1表达除受昼夜节律及基因多态性影响外,还可被激素、细胞因子等多种因素调控。其表达调控主要发生在转录水平,受到包括 FXR、HFN-4α、SHP、SREBP-1C、PGC-1α等诸多核因子调控。中药及其方剂对调脂和降低胆固醇具有较好的疗效。近来有转录组学研究表明,何首乌通过上调胆固醇和胆酸生物合成的关键酶CYP7A1从而产生肝损伤[21]。相比于转录组学通量大耗时长,萤光素酶报告基因系统具有检测速度快、灵敏度高、结果确切等优点,在药物筛选、疾病检测等方面具有广阔的应用前景。中药方剂和有效成分能通过调控CYP7A1,调解体内胆酸和胆固醇的稳态,从而发挥降脂治疗胆结石等药效[22-26]。探讨中药及其成分对CYP7A1的调控方式十分重要,构建的CYP7A1启动子萤光素酶报告基因载体为这一研究提供了新的工具。
综上,我们构建了CYP7A1启动子萤光素酶报告基因载体,下一步将利用构建的载体研究中药成分对CYP7A1的调控,以期发现其对内源性胆酸合成代谢的影响。
