血清尿酸对心血管系统及神经退行性病变的影响
2018-10-23姚波王禹
姚波,王禹
解放军总医院,北京 100853
尿酸是包括人类在内的高等灵长类动物嘌呤代谢的终产物,也是鸟类和爬行类动物的主要代谢产物。根据历史记载,早在1679年,Leeu⁃wenhoek就首次记录了痛风患者的尿酸结晶。50年后,Stukeley也在痛风患者的关节腔内发现了同样的物质,虽然在当时,人们既不清楚这种物质是什么,更不知道它具体的化学结构[1]。瑞典化学家Scheele在1776年发现了肾结石中的尿酸结石[2]。Garrod则首次测量了血清及尿液中的尿酸含量,并于1828年对此进行了报道[1,3]。
血清尿酸含量与痛风的发生有着直接的关系。痛风性关节炎是由急性炎症引起的一种反复发作的,以红肿胀痛为主要特征的关节炎。美国痛风的患病率已从1990年的每千人2.9例上升到1999年的每千人5.2例[4]。由于男性血清尿酸水平高于女性,因此,男性患痛风的概率大于女性。从病理角度而言,痛风是由血清尿酸水平升高引起的关节、肌腱、肾脏等组织中尿酸结晶的沉积导致的[5]。
1 尿酸的生物化学及代谢
尿酸是分子式为C5H4N4O3,相对分子质量为168的杂环有机化合物。尿酸是人体中嘌呤代谢的最终产物,并随尿液排出体外。在多种酶的作用下,腺嘌呤和鸟嘌呤最终被转化为尿酸。腺苷酸(AMP)通过2种方式转化为肌苷:第一种先通过脱氨酶脱去一个氨基酸形成肌苷酸(IMP),继而通过核苷酸酶去磷酸化形成肌苷;第二种先通过核苷酸酶去磷酸化形成腺苷,继而通过脱氨酶作用形成肌苷。鸟苷酸(GMP)也通过相同的2种途径转化为鸟苷。肌苷与鸟苷再通过嘌呤核苷磷酸化酶进一步转化为次黄嘌呤与鸟嘌呤。其中,次黄嘌呤通过黄嘌呤氧化酶被氧化成黄嘌呤。鸟嘌呤则通过鸟嘌呤脱氨酶形成黄嘌呤。黄嘌呤最终被黄嘌呤氧化酶氧化,形成最终产物尿酸(图1)。
在生理条件下,尿酸的pKα为5.8,是一种弱酸,在人体中主要以尿酸盐的形式存在。当血清尿酸浓度增加时,尿酸结晶形成。女性体内血清尿酸的浓度一般为1.5~6.0 mg/dL,而男性体内血清尿酸的浓度一般为2.5~7.0 mg/dL。尿酸在水中的溶解度极低,但在人体血液中的溶解度接近极限(6.8 mg/dL)。当人体血清尿酸水平高于6.8 mg/dL时,尿酸则形成尿酸钠结晶。
当人体血清尿酸含量过高或者缺乏尿酸酶时,尿酸将无法被氧化成溶解度更高的尿素排出,只能以尿酸结晶的形式在人体内沉积。健康成人体内尿酸含量为1200 mg,每日新生成600 mg,同时,每日有约600 mg随尿液排出。正常人体内尿酸的生成与排泄速度较恒定。
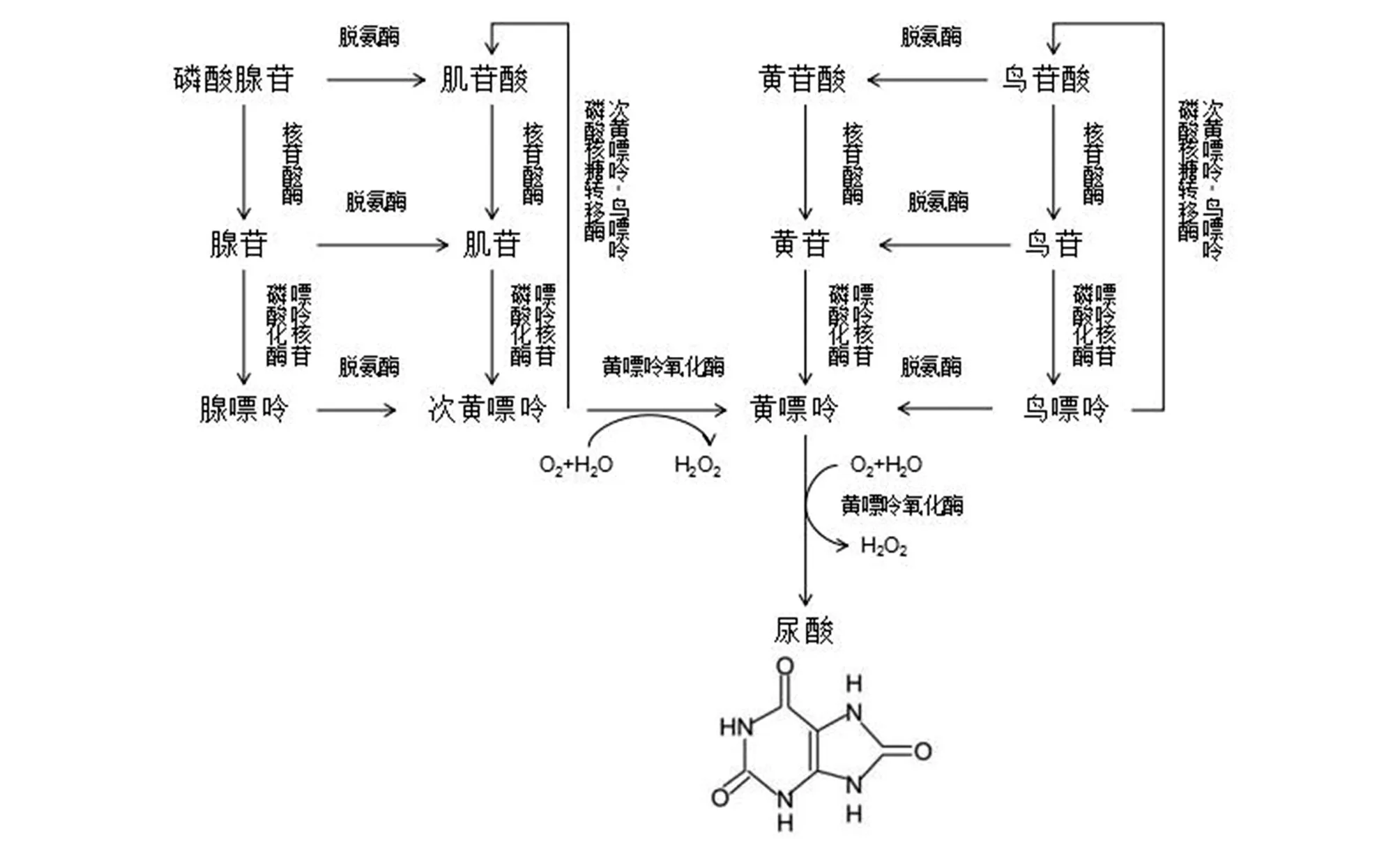
图1 尿酸的生物合成
2 高尿酸血症
研究者普遍认为,现代人尿酸水平升高有2个极为重要的原因:
距今约1500万年前(中新世中期),原始的人类祖先基因中尿酸酶启动子区域的基因突变导致尿酸酶的活性逐步丧失[6]。正是由于具有抗氧化能力的尿酸的含量升高,使得尿酸酶基因的缺失有助于人类在极端恶劣的自然环境中存活下来[7]。特别是当盐摄入较低时,高尿酸血症更有助于维持血压,这为灵长类动物的生存和进化提供了极大的优势[8]。
饮食结构与生活习惯的变化。现代生活中人们摄取的各类能量物质较古代要多得多。上世纪20年代,人们的平均血清尿酸约为3.5 mg/dL,而到了70年代,这一数字变成了6.0 mg/dL[7]。
这2个重要因素也影响了当下高尿酸血症的标准:成人高尿酸血症的定义为男性血尿酸浓度大于7.0 mg/dL,女性大于6.0 mg/dL。高尿酸血症的成因有很多,主要原因包括以下几种。
2.1 肾脏疾病
人体的尿酸绝大多数经肾脏排出体外。当肾脏疾病引发肾脏损害时,尿酸排出减少,从而引发高尿酸血症。出生时肾单位缺失的婴儿就是一个极为典型的例子。与对照组相比,这些肾单元缺失的婴儿所能处理的尿酸较少,同时,从母体获得的尿酸也更多。因此,这些婴儿极易患高尿酸血症[9]。在白血病、淋巴瘤等疾病的化学治疗中,当肿瘤细胞大量溶解破坏时,细胞内物质快速释放,引起代谢产物的增加,尿酸、无机盐等排泄量急剧增加,使得肾小管发生堵塞,从而引起急性肾功能衰竭(肿瘤溶解综合征)[10]。
2.2 尿酸生成增加
当人体摄入大量嘌呤或果糖后,也可导致较高的尿酸水平。果糖是一种特异性的糖分子,它可以迅速耗尽人体内的ATP并增加尿酸的生成量。Jones的一项研究表明[10-11],啮齿动物食用果糖后,尿酸的生成量和排泄量急剧增加。
2.3 关键酶的缺失
次黄嘌呤-鸟嘌呤磷酸核糖转移酶(HGPRT)可以催化次黄嘌呤与鸟嘌呤,使它们重新转化为IMP与GMP,从而进行嘌呤的回收。Lesch-Nyhan综合征,又称自毁容貌综合征,是X连锁隐性遗传的先天性嘌呤代谢缺陷病,即源于HGPRT缺失。HGPRT缺陷导致次黄嘌呤和鸟嘌呤积累,从而进一步导致血清高尿酸水平。该综合征患者自婴儿期开始,体内尿酸水平升高导致了严重的痛风、肾脏功能障碍、智力低下、神经功能障碍。
高尿酸血症对多个器官和系统均有不利影响。尿酸酶基因缺陷小鼠的血清尿酸水平增加了10倍。这些基因缺陷小鼠均有肾脏尿酸结石,并伴随浆细胞、淋巴细胞和巨噬细胞的浸润,超过一半的基因突变小鼠在4周龄前死亡[12]。
3 尿酸与心血管系统疾病
3.1 尿酸与冠心病
冠心病是一种以血液供应减少为主要特征的心肌疾病,通常由动脉粥样硬化和冠状动脉狭窄引发。高尿酸血症可以独立增加冠心病事件的风险,并增加女性冠心病患者的死亡率。近期一组前瞻性队列研究显示,冠心病患者血清尿酸水平每增加1 mg/dL,死亡率就会增加12%[13]。高尿酸血症的存在使得女性患冠心病的概率增加了近70% ,但对男性并没有影响。2005年的一项META分析揭示了高尿酸血症与冠心病之间的关系:男性的相对危险度为1.12,女性的相对危险度为1.22[14]。
3.2 尿酸和高血压
近期研究表明,高尿酸血症可能是高血压的一种独立危险因素[15]。高血压在全世界越来越普遍,尿酸水平在世界范围内也逐渐上升,同时,尿酸水平的升高总是先于高血压的进展[14]。血清尿酸水平的升高与成人高血压发病率的增加呈正相关[16-17]。准确地说,血清尿酸水平与舒张期高血压呈正相关,对收缩期高血压的影响并无数据支持[18]。
尿酸结晶可以损害肾脏小血管,导致不可逆的高血压。此后,无论尿酸水平是否下降,这种高血压都会持续存在[8]。在健康的正常血压个体中,血清尿酸水平的升高与肾功能下降相关[19],同时,大多伴随着肾间质与肾小血管炎症的发生。因此,高水平的尿酸可以诱导血管反应性高血压,进一步则发展为肾依赖性高血压。
过去200年中,果糖摄入量的急剧增加与高血压和高尿酸血症患病率的提高息息相关。现代人饮食中含有过量的果糖,包括但不限于糖浆、白砂糖、甜味剂等。在Nakagawa[20]对大鼠的相关研究中,摄入过量果糖,但没有摄入降尿酸药物(别嘌呤醇)的研究组大鼠胰岛素水平、甘油三酯水平、血压、体重均升高,同时大多数研究组大鼠均患有代谢综合征。而在摄入过量果糖,同时摄入降尿酸药物(别嘌呤醇或苯溴马隆)的对照组大鼠,相比空白对照组而言,并未出现高胰岛素血症、收缩期高血压、高甘油三酯血症及超重。
3.3 尿酸与2型心肌梗死
Larsen等[21]通过非增强的电子计算机断层扫描评价,对血清尿酸水平与冠状动脉粥样硬化程度进行了分析。结果表明,尿酸水平与动脉粥样硬化程度呈正相关;2型心肌梗死、缺血性心肌病亚组的受试者体内的血清尿酸含量明显高于1型心肌梗死、非缺血性心肌损伤、先天性心肌病及无cTnI升高的几个亚组。他们的研究也验证了Ndrepepa之前的发现[22]:在急性冠脉综合征的患者中,ST段抬高型心肌梗死患者的尿酸水平较高;同时,随着尿酸水平的下降,ST段抬高型心肌梗死的发病率也随之下降。
3.4 尿酸和中风
高尿酸血症在中风病程进展中起着十分重要的作用。中风是美国第三大死因,也是中国第二大死因,每年约有795 000名美国人中风[23]。2009年,Kim等发表了一项关于中风和高尿酸血症的META分析[24],这是一项包括230 000多名患者,分为16个项目的前瞻性队列研究。Kim等发现,相比于正常尿酸水平的对照组,高尿酸血症组患者脑卒中的发病率(相对危险度1.41)和死亡率(相对危险度1.26)均显著升高。Holme等的研究也表明尿酸水平的升高与出血性、缺血性脑中风的风险增加均有关[25]。
4 尿酸和神经退行性疾病
Annanmaki等[26]在2007年的研究显示,与对照组相比,帕金森患者的血清尿酸水平明显下降。他们的后续研究也证实了这一结论[27]。同时,该研究还提示,在男性患者中,血清尿酸水平与帕金森病的持续时间呈负相关。
既然低水平的血清尿酸可能诱发帕金森病,那么高尿酸水平人群,尤其是痛风患者,发生帕金森病的概率是否会降低?Alonso等进行了一项前瞻性对照研究,以确定痛风与帕金森病之间的关系[28],他们发现痛风患者组罹患帕金森病的概率远低于未患痛风组。但这一相关性结论仅针对男性有效,在女性患者中这一结论不成立。De Vera等[29]后来发表的大规模队列研究提示,在65岁以上人群中,排除年龄、性别、继往并发症、非甾体类抗炎药和利尿剂使用等因素后,11 258例痛风患者罹患帕金森病的概率,不论男女,均较56 199例对照组降低了30% 。因此,De Vera等认为尿酸极有可能成为帕金森病的一种生物标志物,同时,尿酸也有可能对帕金森病有治疗作用[30]。
此外,血清尿酸水平的降低也有可能与亨廷顿病和多发性硬化症的发病有关[26-27,29]。Auinger等的研究表明,血清尿酸水平升高会延缓亨廷顿舞蹈症的发作和恶化[31]。科学家们普遍认为尿酸的抗氧化作用可能起到保护神经的作用。
5 尿酸对血管的影响
作为次黄嘌呤和黄嘌呤的代谢产物,尿酸长期以来一直被认为是一种抗氧化剂[32-33]。作为抗氧化剂,尿酸减少了超氧化物对组织的侵蚀,因此对于血管炎症及功能障碍有一定的保护作用。然而,尿酸也介导了对包括低密度脂蛋白在内的部分促氧化分子的氨基羰基的产生[34-35]。Patterson等的研究表明,在人体血浆中提取的天然低密度脂蛋白存在时,尿酸起到了抗氧化剂的作用;但当低密度脂蛋白发生温和氧化时,尿酸起到了促进氧化的作用[35-36]。
在特定条件下,尿酸也会与其他小分子化合物发生反应,如一氧化氮等。一氧化氮对血管内皮细胞的舒张是不可或缺的。尿酸可以减少一氧化氮的产生[37],降低一氧化氮的生物利用度,并将一氧化氮转化为其他物质,如谷胱甘肽[38]。
Rao等的研究表明,尿酸可以促进血管平滑肌细胞(VSMC)的增殖[39]。进一步研究表明尿酸通过促分裂素原活化蛋白激酶(MAPKs)途径介导VSMC的增殖。此外,尿酸对血管细胞具有促进炎症发生的作用。在血管平滑肌细胞和血管内皮细胞中,尿酸也促进了C反应蛋白的上调[40],从而进一步促进动脉粥样硬化的发生。
针对大鼠模型的研究也证实,高尿酸血症引起的高血压和肾损伤主要是由于尿酸作用于肾素-血管紧张素系统,降低血管内皮细胞一氧化氮水平,抑制肾脏中神经元型一氧化氮合酶的功能[41]。由于尿酸还可以促进血管平滑肌细胞的增殖,这直接导致了肾脏微血管病变的进展,从而进一步使得血压升高。因此,高尿酸血症所致血管内皮功能障碍、血管平滑肌细胞功能障碍是导致高血压和肾损伤的主要原因。
6 尿酸和炎性反应
风湿病学家们在研究痛风的发病机制时,发现关节、组织内尿酸结晶的沉积与炎性反应的发生有着极强的因果关系[42]。正如之前所述,当尿酸水平超过6.8 mg/dL时,人体内会形成尿酸结晶,如尿酸单钠(monosodium urate,MSU)。
2003年,密歇根州立大学的研究人员首次提出MSU是人体内濒死细胞释放的内源性危险信号[43]。人体内的免疫系统除了识别非自身成分之外,还可以检测特定的危险信号分子,从而早一步建立有效的免疫反应。这个假设被称为“危险模型”。尿酸结晶就是死亡细胞对免疫系统发送的“危险信号”。MSU的免疫原性已得到验证,但MSU被免疫细胞感应的具体机制仍未详尽。之后进行的一些研究表明MSU诱导的炎症依赖于Toll样受体(TLRs)[44],同时IL-1β和IL-18在MSU介导的炎症中起关键作用[45]。
不同于传统的自身免疫系统疾病,MSU诱导的炎症与T细胞功能失调有关,被认为是“自身炎性疾病”。作为一种新概念,这些自身炎性疾病可以使用T细胞抑制类药物治疗[46],如抗肿瘤坏死因子α(TNF-α)、抗 CD20等。痛风、2型糖尿病、心力衰竭均属于这一类自身炎性疾病。由于已知的自身炎性疾病主要由caspase-1功能失调、炎性细胞凋亡、IL-1β异常分泌引起[46],因此,阻断IL-1β的分泌与作用可以快速并持续降低自身炎性疾病的严重程度。
7 结语
长期以来,高尿酸血症直接导致痛风,并间接导致冠心病、高血压、中风等其他疾病。目前主流医学界对此的解释集中于2点:MSU晶体被TLRs识别,促进IL-1β的释放;可溶性尿酸介导自由基的产生从而起到促氧化的作用。MSU诱导自身炎症疾病的机制、尿酸的生物学功能、高尿酸血症诱导心血管疾病的详细过程等,仍有待研究和发掘。
随着人类物质生活的极大丰富,随之而来的就是各式各样的,甚至是前闻所未闻的疾病。这固然有新型制剂带来的不良影响,但更多的是一些原本有利于人类在恶劣的自然环境中生存下来的代谢产物变得有害于人类健康。肥胖、白化、高尿酸血症等有助于原始人类抵抗饥饿、疟疾的生理行为,在现代社会反而成为威胁人类健康的因素。工业革命后的这几百年相对人类忍饥挨饿的数百万年来说太短太短,而我们为延长人均寿命要走的路还很长很长。
