冻藏对面团中面筋蛋白分子结构 及功能特性影响的研究进展
2018-10-22杨润强顾振新
邹 敏,杨润强,顾振新,王 沛
(南京农业大学食品科技学院,江苏南京 210095)
冷冻面团技术起源于20世纪50年代,其标准化、方便化等诸多优越性推动了烘焙行业品牌连锁经营模式的快速发展[1],这是实现主食工业化生产的重要途径之一。冷冻面团具有降低生产成本、提高产品质量、极大方便消费者等优点,其应用范围非常广泛,除可用于面包生产外,还可应用于加工生产具有中国特色的馒头、包子和饺子等速食食品[2]。但是由冷冻面团生产出的面包、馒头等发酵产品的醒发时间延长、体积变小、货架期缩短的不足之处也逐渐显现[3]。
面团品质劣变是缩短冷冻面团货架期的主要原因。这主要是因为在冷冻期间,面团的组分(面筋蛋白、酵母、水分、淀粉)会逐渐劣变。主要有三个方面:面团中的水分在冷冻过程中冻结形成冰晶,温度波动会导致冰晶发生重结晶,随着冰晶体积增大破坏了面筋的网络结构[4],面团的筋力逐步损失,面团持气力下降[5-6];在冻藏过程中,酵母细胞内的水会形成冰晶,冰晶体积增大会造成酵母细胞损伤、破裂,使其存活率和产气性都大大下降[7],最终导致产品体积变小、质量变差[8];冷冻会影响淀粉的老化,由冷冻面团生产的产品老化速度会加快,使产品的质构、口感等变差[9]。
诸多研究报道指出,冷冻面团品质下降的主要原因是面筋蛋白在冻藏过程中品质发生劣变。因此,研究面筋蛋白的品质在冻藏过程中发生的变化能够完善冷冻面团品质劣变机理,同时为改善冷冻面团品质提供理论依据[1]。本文综述了冻藏过程中面筋蛋白的分子组成、空间结构和功能特性等方面的变化。
1 小麦面筋蛋白的分类和结构
水洗去淀粉颗粒和水溶性部分后得到小麦面筋蛋白。根据洗涤的彻底性,干物质中含有75%~85%的蛋白质、5%~10%的脂质以及少量的淀粉和非碳水化合物。一般而言,面筋指的是蛋白质,其品质主要决定了面团的强度和粘弹性,对面制品食用品质起到关键作用[10]。面筋蛋白含有多种蛋白质成分,它们以单体存在或者通过链间SS键形成寡聚物或聚合体。其氨基酸组成中,含有大量的谷氨酰胺和脯氨酸及非极性氨基酸,带电的氨基酸含量低。天然面筋蛋白的分子量范围为3×104~1×107Da[11]。
Osborne[12]提出了小麦面筋蛋白的分类方法,即根据面筋蛋白在70%乙醇水溶液中的溶解度差异分为醇溶性的醇溶蛋白和醇不溶性的谷蛋白[1,13]。醇溶蛋白和谷蛋白的比例约为1∶1,两者相互交联形成面筋网络结构(图1),同时它们是面筋蛋白流变学特性和面制品品质的主要决定因素[14]。麦谷蛋白的分子量分布比较宽,它是由多肽链通过二硫键结合形成的大分子,主要赋予面筋蛋白弹性,决定面筋蛋白弹性性能的主要因素是谷蛋白分子链中的一些重复单元(富含脯氨酸、谷氨酸、结氨酸和赖氨酸)[15-16]。醇溶蛋白是由疏水性多肽通过分子内的二硫键形成的单链,赋予面筋蛋白粘性[17]。
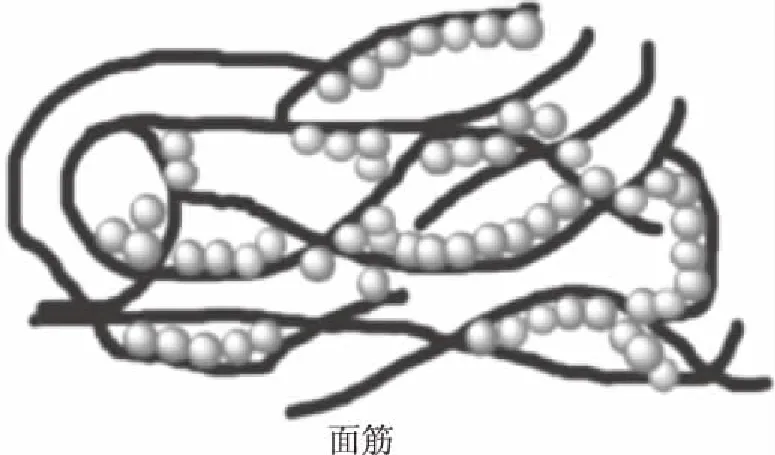
图1 面筋模型结构示意图[18]Fig.1 Schematic diagram of gluten model structure[18]
1.1 醇溶蛋白
大多数醇溶蛋白为单体蛋白,结构紧密呈球状(图2),其分子内无链外SS键[19],分子量为30~80 kDa,根据其在低pH条件下电泳迁移率的不同可分为α-醇溶蛋白、β-醇溶蛋白、γ-醇溶蛋白和ω-醇溶蛋白四种类型[20]。ω-醇溶蛋白含有大量的谷氨酰胺、脯氨酸、苯丙氨酸(合计占氨基酸组成的80%)和极少量的含硫氨基酸,被称为贫硫醇溶蛋白。相反,α-醇溶蛋白、β-醇溶蛋白、γ-醇溶蛋白含有少量的谷氨酰胺、脯氨酸、苯丙氨酸和大量的含硫氨基酸,被称为富硫醇溶蛋白[13]。
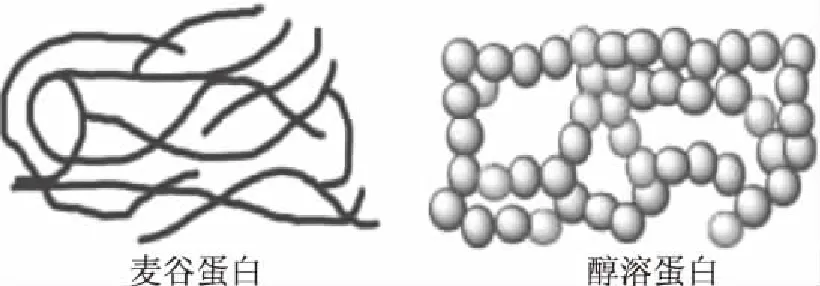
图2 谷蛋白和醇溶蛋白结构示意图[18]Fig.2 Schematic diagrams of glutenin and gliadin structure[18]
醇溶蛋白有两个不同的结构域:氮(N)端结构域和碳(C)端结构域(图3)。其中α-、β-、γ-三种醇溶蛋白结构相近,均有重复N端区域和非重复C端区域,肽链上存在3~4个分子内二硫键[21],分子量为30~45 kDa。α-醇溶蛋白的N段和C段几乎等长,N端结构域由两段重复的氨基酸序列(PGGPT和PGPGPPP)组成,α-醇溶蛋白重复域主要为β-转角结构,但β-转角在肽链上分布不规则,不能形成β-螺旋,因而无弹性,在溶液中呈棍棒状[21]。ω-醇溶蛋白结构特殊,以一个肽段单元(PGGPPPGG)为主要重复区域,该肽段单元无半胱氨酸残基,主要通过谷氨酰胺残基上氢键与其它亚基或蛋白质进行结合,其分子量较大,为65~80 kDa[22]。ω-醇溶蛋白中β-转角虽在整个肽链上分布较为规则,但由于分子缺乏半胱氨酸,肽链间不能交联形成弹性化合物[23]。

图3 醇溶蛋白的一级结构示意图[24]Fig.3 Schematic representation of primary structure of gliadin[24]
1.2 谷蛋白
谷蛋白是通过分子间二硫(SS)键形成的聚合体蛋白,呈纤维状(图2),分子量为100~1000 kDa[25]。谷蛋白在十二烷基磺酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)图谱中分为高分子量麦谷蛋白亚基(HMW-GS)和低分子量麦谷蛋白亚基(LMW-GS)[16,20],HMW-GS与LMW-GS所占比例是决定谷蛋白性能的主要因素,与面团强度和面包体积有着重要关系[21]。
HMW-GS可分为x-和y-两种类型,分子量分别为80~90 kDa和65~75 kDa,一级结构一般含有630~830个氨基酸,由17~20个多肽亚基构成,分子量约为675~880 kDa[23]。其肽链可分为三段(图4):非重复的N端,非重复的C端和重复的中心疏水区域[21]。其中N端含有80~105个氨基酸,C端含有42个氨基酸,两端含有全部的半胱氨酸残基,表现出较强亲水性,这有利于二硫键及首尾相连线状肽链分子形成,多个亚基通过二硫键形成纤维状谷蛋白分子[26];中心域由富含脯氨酸、谷氨酰胺和甘氨酸等重复序列的480~700个氨基酸残基组成,不含半胱氨酸[21]。N和C末端结构域的二级结构主要是α-螺旋,而中心域的二级结构主要为β-转角,多个β-转角进一步形成特殊β-螺旋的超二级结构,这种结构对面团的弹性具有一定的贡献作用[1]。

图4 谷蛋白的一级结构示意图[10]Fig.4 Schematic representation of primary structure of glutenin[10]
LMW-GS可分为B、C和D三种类型,大多数LMW-GS为B型,分子量为40~50 kDa,C型的分子量为30~40 kDa。由于基因编码的重叠,B和C型LMW-GS的一、二级结构与α-和β-型醇溶蛋白较为相似,D型LMW-GS则与ω-醇溶蛋白接近[1]。LMW-GS的N末端区域中的重复单元富含谷氨酰胺和脯氨酸,如QQQPPFS[27],该区域中主要为β-转角结构,可进一步形成规则的螺旋结构,具有刚性[28];C末端区域和α/β-醇溶蛋白、γ-醇溶蛋白序列相似,富含α-螺旋结构,结构较为紧凑[23]。
2 面筋蛋白的分子组成在冻藏过程中变化
面筋蛋白的分子量大小及分布与面团的延伸性能和面制品的品质有关,而二硫键与面筋蛋白网络结构的形成密切相关。因此,冻藏过程中面筋蛋白的分子组成变化会影响冷冻面团产品的品质。
2.1 面筋蛋白分子量的变化
面制品的品质受面筋蛋白分子量的大小及其分布的影响。例如,在面团的加工过程中,面筋蛋白分子量分布决定面团的物理性能。Southan 等[29]报导了面团拉伸强度的大小与分子量高于临界值(1×106Da)的面筋蛋白含量呈正相关。在面包的焙烤中,Sapirstein 等[30]发现面团的延展性和面包的体积与面筋蛋白分子量的大小以及分布存在着一定的联系。Ribotta 等[31]研究指出,在-18 ℃的冻藏条件下,分子量为 88700~129100 Da的谷蛋白亚基随着冻藏时间的延长而明显降低。Sharadanant 等[32]研究发现,面团在经过冻融处理后,小分子麦谷蛋白明显增加。Zhao 等[33]发现在冻藏过程中面筋蛋白内部二硫键发生断裂,高分子面筋蛋白(105~109Da)发生解聚,而分子量集中在3×105~4×108Da之间的面筋蛋白分子在反复冻融后解聚现象更为严重。Wang等[34-36]利用高效液相分子排阻色谱(SE-HPLC)对面筋蛋白分子量进行定量分析,发现冻藏后可溶性蛋白含量明显增加,并进一步验证了麦谷大分子蛋白(GMP)在冻藏过程中发生解聚造成了面筋蛋白的解聚,并且醇溶蛋白可促进GMP的解聚,直接导致面团持气能力下降,面制品感官品质下降。
2.2 面筋蛋白游离巯基(SH)变化
二硫(SS)键是维持面筋蛋白结构和决定其功能特性的最重要因素之一,对面筋蛋白网络结构的粘弹性至关重要,也与面制品的加工品质关系密切。SS键是由两个游离巯基氧化形成,因此游离SH含量的变化是反映SS键变化的一个重要指标[37]。赵雷等[38]研究表明,在冻藏过程中,面筋蛋白发生解聚,SS键断裂形成游离SH,冻藏120 d后,游离SH增加了3.1 μmol/L。造成这种结果的原因主要有两方面,一是冻藏会导致自由水含量降低,诱发冷冻浓缩效应,使蛋白质分子内和分子间二硫键交换反应机率增加[39];另外则是在冻藏过程中,冰晶随冻藏时间的延长不断生长或发生重结晶,导致蛋白分子内外部的二硫键部分断裂、分子内部的巯基暴露,进而致使游离巯基含量增加[40]。Wang 等[1]的研究也发现冻藏过程中面筋蛋白的SH含量升高,而谷蛋白的SH含量先降低后升高,醇溶蛋白的SH含量无明显变化,这说明在冻藏过程中,面筋蛋白和谷蛋白的链外SS均发生断裂,谷蛋白的链内SS键可能也受到冻藏影响,醇溶蛋白的链内SS键在冻藏过程中保持稳定。
2.3 面筋蛋白自由氨基的变化
面筋蛋白中含有一定量具有活性的蛋白水解酶,如偶氮酪蛋白酶(azocaseinase)和血红蛋白酶(haemoglobinase)[41],这些酶会切断面筋蛋白的肽链从而导致自由氨基含量增加[33]。Zhao等[38]研究发现,面筋蛋白在冻藏120 d期间,自由氨基含量几乎没有变化。这说明蛋白水解酶在低温下被抑制,面筋蛋白不会发生水解,肽链没有发生断裂。
2.4 面筋蛋白亚基的变化
范鹏辉[16]对面筋蛋白进行十二烷基磺酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)发现,随着冻藏时间的延长,麦谷蛋白和醇溶蛋白亚基的分子量大小和分布均未发生明显变化,表明冻藏时间对亚基无明显影响,亚基结构在冻藏过程中未遭到破坏。汪星星等[41]也发现冻融过程中面筋蛋白的各亚基无明显变化。Wang 等[34]发现恒温冻藏后的谷蛋白和醇溶蛋白各亚基含量基本保持不变,醇溶蛋白各亚基无共价聚集行为。
3 面筋蛋白的空间结构在冻藏过程中的变化
在冻藏过程中,由于水分的迁移及冰晶的重结晶会使面筋蛋白网络结构[42]、二级结构、疏水性等发生变化,诱导冷冻面团品质的劣变。
3.1 面筋蛋白网络结构的变化
潘振兴等[43]通过扫描电镜(SEM)观察冷冻面团中面筋蛋白的结构发现,面筋蛋白以膜状形态存在,构成网络结构,淀粉颗粒为圆球形,被包裹在面筋膜中,支撑网络结构。在未冻藏的面筋蛋白的显微结构图片中可以看到淀粉颗粒被紧密镶嵌在面筋膜中,面筋网络结构均匀,而面筋蛋白在冻藏后面筋膜变薄,淀粉颗粒暴露在面筋网络结构之外,出现空洞,面筋结构严重破坏[43]。Esselink 等[44]观察冻藏6周后的面团结构发现,面筋蛋白网络结构发生明显的断裂,并且和淀粉颗粒分离。而这种现象的主要原因归咎于冰的重结晶现象。冯俊敏等[45]和Gelinas 等[6]的研究也证实了以上结论,冰晶的重结晶会导致面筋蛋白结构的弱化。Kontogiorgos等[46]结合SEM和透射电子显微镜(TEM)观察了面筋蛋白的网络结构,在扫描电镜下,低倍镜观察到液氮速冻的水合面筋蛋白结构是均匀的,而冻藏30 d后,面筋网络结构被均匀且不规则的空隙包围。在透射电子显微镜下观察到,这些不规则的空隙主要被冰晶所填充。面筋蛋白网络结构劣变由主要是因为两个机制[46]:冰晶在毛细管内生长以及毛细管外大尺寸冰晶的持续生长。
3.2 面筋蛋白二级结构的变化
刘国琴等[47]发现面筋蛋白的二级结构主要由无规则卷曲和β-折叠组成,在冻融冻藏模式下,当冻藏时间达到60 d时,面筋蛋白的二级结构变化显著;而在恒温冻藏模式下,冻藏时间达到90 d时,其二级结构才发生变化。Wang 等[48]研究了冻藏60 d期间面筋蛋白、醇溶蛋白和谷蛋白二级结构的变化,发现三种蛋白的二级结构均有α-螺旋、反向平行β-折叠、分子间β-折叠、β-折叠和β-转角五种类型。反向平行β-折叠、α-螺旋和β-转角结构对冻藏较为敏感,在冻藏后三种蛋白的α-螺旋结构含量均减小;反向平行β-折叠和β-转角结构的含量增大,这说明α-螺旋结构受冻藏影响部分转变为了后两种结构。这种变化主要是由于冻藏导致面筋蛋白中水合环境发生改变,自由水的减少、冰晶生长产生的机械力等使维持α-螺旋的氢键断裂、螺旋结构被破坏[40],蛋白分子发生重排以达到能量最低来保持相对稳定状态。Meziani等[49]发现面团冻藏的前四周,β-折叠的含量稍有增加,β-转角结构的含量基本不变。Georget和Belton等[50]提出β-折叠含量的增加可能是因为新的β-折叠结构的形成和一些氢键较弱的结构的转变。
3.3 面筋蛋白疏水性的变化
疏水相互作用是维持蛋白质结构的主要作用力之一,它对蛋白质结构的稳定和蛋白质的功能特性具有重要作用[51]。Wang等[48]研究发现,冻藏后面筋蛋白、谷蛋白和醇溶蛋白的分子构象发生重排,分子表面的疏水位点暴露增加,从而导致蛋白水合能力下降,冻藏是通过诱发醇溶蛋白和谷蛋白疏水位点的暴露来使面筋蛋白疏水性增加。刘国琴等[52]研究发现面筋蛋白的表面疏水性随着温度波动次数、冻藏时间和冻藏循环次数的增加而增加,推测是在冻藏过程中冰晶不断生长,大冰晶破坏面筋蛋白的结构,进而导致面筋蛋白的结构发生改变,面筋蛋白表面暴露的疏水基团增多,其表面疏水性增强。范鹏辉等[16]研究发现,在冻藏60 d的过程中,面筋蛋白的表面疏水指数随着冻藏时间的延长而逐渐下降。这可能是由于面筋蛋白分子部分发生聚集,致使面筋蛋白表面的疏水基团被掩埋,表面疏水性降低[53]。
4 面筋蛋白的功能特性在冻藏过程中的变化
4.1 面筋蛋白起泡性的变化
起泡性是小麦面筋蛋白的一个重要的功能特性,直接影响面团在醒发和初期烘烤过程中气泡的分布。分布均匀、稳定的气泡不仅可使发酵面制品的质地松软和润滑,还可提高风味物质的分散性,使面制品的口感变得更佳。蛋白质的起泡性取决于蛋白质的分子组成和结构特征,同时受外界环境的影响,如温度、pH、盐浓度、压力等[54]。面筋蛋白冷冻后,蛋白分子的结构伸展松散,有些侧链基团,如羟基、酚基、羧基暴露出来,蛋白质活性中心的各个基团相互分散,氢键、疏水作用力等次级键被破坏,蛋白质空间构型可能发生解体,球状蛋白质失去了天然蛋白质的结晶能力,水化膜被破坏,面筋蛋白的起泡性随冷冻时间的增加不断降低[55]。Wang等[56]研究发现,冻藏45 d后,醇溶蛋白的起泡体积降低了26.18%,起泡性能发生劣变。这表明面筋蛋白的起泡性主要由醇溶蛋白决定。
4.2 面筋蛋白流变特性的变化
面筋蛋白对面团流变学性能起主要贡献,同时影响着最终产品的食用品质。通常,醇溶蛋白赋予面筋延展性和粘性,而谷蛋白赋予其强度和弹性[17]。Jia等[57]研究了面筋蛋白的流变学性能在冻藏前后的变化。发现与新鲜面筋蛋白相比,冻藏后面筋蛋白的粘性模量(G″)、弹性模量(G′)及损耗角(tanδ)均显著性下降,并且冻藏时间越长,其粘弹性越低。Xuan[58]和Ribotta[59]等的研究也得到相似的结果。Wang等[34]研究发现,冻藏后面筋蛋白和谷蛋白的粘弹性下降,醇溶蛋白的粘弹性无明显变化,其指出谷蛋白流变参数降低可能是造成面筋蛋白粘弹性的损失的主要原因。诸多研究表明,面筋蛋白粘弹性的退化主要是由冰晶对面筋蛋白网络结构造成的机械损伤、谷蛋白聚集体的解聚以及面筋蛋白二级结构的变化共同作用所致。
4.3 面筋蛋白热特性的变化
面筋蛋白的热特性主要反映面筋蛋白的结构在加热过程中的变化。热变性过程可看成是温度的动态函数,蛋白质吸收热量后,分子内的次级键被破坏,多肽链被打开,蛋白分子从原来的有序状态变为无序状态[60]。Xuan等[58]研究了冻藏60 d的面筋蛋白的热稳定性变化,发现天然面筋蛋白的变性温度(Tp)为52.95 ℃,冻藏60 d后,变性温度增至60.35 ℃。Wang等[48]的研究也有相似的结果。这说明经过冻藏后面筋蛋白的低温热稳定性提高。有研究报道,疏水相互作用是影响蛋白质的热稳定性的重要因素,蛋白质的热变性温度会随着疏水性的增加而增加,并且蛋白质的热变性温度也会因聚合交联程度的加剧而提高[61]。
5 总结与展望
目前,冻藏对面筋蛋白的分子组成、空间结构和功能特性等的影响研究较为深入,完善了冷冻面团在冻藏阶段的劣变机理。面筋蛋白的品质劣变虽源于冻藏,且经冻藏的面筋蛋白品质不稳定,但在熟制阶段其品质的可调性依然很强。这是因为在熟制阶段,面筋蛋白的分子链先展开,其中的氢键、离子键等非共价相互作用被破坏,面筋蛋白结构变得松散,随后谷蛋白与谷蛋白发生聚集,再与醇溶蛋白发生聚集形成稳定的面筋蛋白网络结构,这对最终产品体积及质构的定型起主导作用[62]。已有的研究虽然阐明了冻藏阶段面筋蛋白的品质劣变机制,但对熟制阶段冻藏面筋蛋白在热聚集作用下的品质变化缺乏系统和深入研究。因此,今后需系统研究冻藏面筋蛋白的结构和功能特性在加热过程中的动态变化,进而从整个加工过程完善面筋蛋白劣变机制,并为有效调控冷冻面团品质提供理论依据。
