蓝莓花色苷对小鼠淋巴细胞 和腹腔巨噬细胞的免疫调节作用
2018-10-22刘玉晨李敬双
刘玉晨,李敬双,于 洋
(锦州医科大学食品科学与工程学院,辽宁锦州 121001)
蓝莓(Blueberry),又名越橘、蓝浆果、红豆果等,是杜鹃花科越橘属多年生落叶或常绿果树。蓝莓果实中含有大量类黄酮、花色苷、酚酸等生物活性物质,具有防止脑神经老化[1]、抗炎[2]、抗氧化[2]、保护肝脏[3]、提高机体免疫力[4]、减肥[5]等多种功能。
蓝莓中花色苷的含量很高,原果含量达到 3.86%(果皮4.61%,汁1.29%),是其最重要的生物活性成分[6]。现代研究表明,蓝莓花色苷具有抗氧化[7]、清除自由基[7]、降血糖[7]、降血脂[7]、防止动脉粥样硬化[8]、防治骨质疏松[7]、预防眼疾[7]、减肥[7]等作用。花色苷能激活免疫系统,使血清免疫球蛋白免受自由基的侵害,激活巨噬细胞,增强人体免疫力[1]。蓝莓花色苷可破坏细胞壁和细胞膜的完整性,导致微生物释放胞内成分而死亡;可抑制 DNA、RNA和蛋白质的合成,导致细菌死亡;能破坏菌体结构成分(如膜蛋白),改变菌体形态,使孢壁破裂,细菌死亡,从而发挥抗炎作用[1]。有研究表明,蓝莓花色苷是至今为止所发现的最有效的抗氧化剂,也是最强效的自由基清除剂,其抗氧化强度为维生素E(VE)的50倍,维生素C(VC)的20倍[1]。蓝莓果实中的花色苷因其鲜艳的颜色和天然无毒的性质,特别适宜用作食品添加剂,目前已广泛应用到果酱、果冻、雪糕、冰淇淋、糖果、腌制品等食品中。近年来,作为药品来防治疾病的研究已经初具规模,对蓝莓花色苷的生物学功能,如作用基因、相关酶类、大分子活性物质、靶器官、受体、分子信号传导途径、作用机制等方面应进行深入的研究。
为探讨蓝莓花色苷的免疫调节活性,本实验以蓝莓花色苷作用于体外培养的淋巴细胞和腹腔巨噬细胞,通过检测淋巴细胞增殖、腹腔巨噬细胞吞噬活性及相关因子的作用,考察其提高机体免疫力的功能,为蓝莓花色苷的进一步开发和利用提供实验依据。
1 材料和方法
1.1 材料与仪器
Balb/c小鼠 SPF级,体重(20±2) g,6~8周龄,锦州医科大学生命科学院,生产许可证号 SCXK(辽)2014-0004;蓝莓花色苷 晨光生物技术有限公司,纯度≥85%;新生牛血清 浙江天杭生物科技有限公司产品;甲基噻唑蓝(MTT)、台盼蓝、RPMI-1640培养基、二甲基亚砜(DMSO)、三羟甲基氨基甲烷(Tris)和磷酸盐缓冲溶液(PBS) 北京索莱宝科技有限公司;小鼠TNF-α、IL-4、IL-6、IL-12细胞因子检测试剂盒 武汉博士德公司。
Varioskan FlashT多功能酶标仪 Thermo Fisher Scientific;SW-CJ-1F型超净工作台 苏州净化设备有限公司,;CKX41SF倒置显微镜 日本OLYMPUS公司,;TD5A低速离心机 湖南赫西仪器装备有限公司,;96孔或24孔板台式离心机 上海安亭(TDL80-2B);CO2培养箱 日本SHELLAB。
1.2 实验方法
1.2.1 淋巴细胞悬液制备 参考桑卡娜等[9]、马玉芳等[10]实验方法,小鼠用颈部断髓法处死,75%酒精浸泡3 min消毒,在无菌超净工作台内取脾,用PBS冲洗2次,置于RPMI-1640培养基中,用注射器拉杆柄将其磨碎,200目滤网过滤。收集滤液置于离心管中,1500 r/min 4 ℃离心5 min,弃上清,加入Tris-NH4Cl 3 mL裂解红细胞,静置5 min,加入D-Hanks液终止反应,D-Hanks液洗涤3次后,用RPMI-1640完全培养基悬沉淀细胞并过滤,经台盼蓝染色检测,细胞活力达95%以上。加入RPMI-1640完全培养基,调整细胞密度为5×106个/mL,制成淋巴细胞悬液。
1.2.2 巨噬细胞悬液制备 参考张思哲等[11]、戴艺等[12]实验方法,每只小鼠腹腔注射2 mL 5%淀粉肉汤,36 h颈椎脱臼法处死小鼠,75%酒精浸泡3 min消毒,在无菌超净工作台内从腹白线处剪开皮肤,将皮肤剥离向两侧,暴露出腹壁肌肉,腹腔注入4 mL RPMI-1640培养基,轻揉腹部3 min,静置5 min后抽取腹腔洗液,置于离心管中,1500 r/min 4 ℃离心5 min,弃上清,PBS洗两遍。贴壁3 h,去除非贴壁细胞,台盼蓝染色计数细胞活力,细胞活力达到95%以上。加入RPMI-1640完全培养基,将细胞密度调整为5×106个/mL,制成巨噬细胞悬液。

1.2.4 蓝莓花色苷对巨噬细胞吞噬活性的影响 用中性红吞噬实验法检测,参考杨平等[13]实验方法,实验设空白组、阳性组、蓝莓花色苷处理组。用96孔细胞培养板,每组均设5复孔,每孔加入100 μL巨噬细胞悬液。空白组每孔加入100 μL RPMI-1640完全培养基,阳性组每孔加入100 μL含有左旋咪唑(终浓度为5 μg/mL)的RPMI-1640完全培养基;蓝莓花色苷处理组每孔分别加入100 μL含不同浓度蓝莓花色苷(终浓度为4、8、16、32和64 mg/mL)的RPMI-1640完全培养基。37 ℃ 5% CO2培养24 h。各细胞培养孔用PBS 洗涤后加入1 g/L的中性红生理盐水100 μL,继续培养 30 min,吸弃上清并用PBS洗涤3次,各孔加入细胞裂解液100 μL,4 ℃过夜裂解细胞,酶标仪检测570 nm的OD值,以OD值判定小鼠腹腔巨噬细胞吞噬活性。
1.2.5 蓝莓花色苷对淋巴细胞分泌细胞因子的影响 用ELISA法检测,参考Xie等[14]实验方法,实验设空白组、阳性组、蓝莓花色苷处理组。用24孔细胞培养板,每组均设5复孔,每孔加入1 mL淋巴细胞悬液。空白组每孔加入 1 mL RPMI-1640完全培养基,阳性组每孔加入1 mL含有左旋咪唑(终浓度为5 μg/mL)的RPMI-1640完全培养基;蓝莓花色苷处理组每孔加入1 mL含不同浓度蓝莓花色苷(终浓度为4、8、16、32和64 mg/mL)的RPMI-1640完全培养基。37 ℃ 5% CO2培养48 h后,1 500 r/min 4 ℃离心5 min,收集上清。用ELISA 法检测蓝莓花色苷对淋巴细胞TNF-α、IL-6分泌的影响,参考小鼠细胞因子试剂盒说明书进行操作。
1.2.6 蓝莓花色苷对腹腔巨噬细胞分泌细胞因子的影响 用ELISA法检测,参考Xie等[14]实验方法,实验设空白组、阳性组、蓝莓花色苷处理组。用24孔细胞培养板,每组均设5复孔,每孔加入1 mL腹腔巨噬细胞悬液。空白组每孔加入 1 mL RPMI-1640完全培养基,阳性组每孔加入1 mL含有左旋咪唑(终浓度为5 μg/mL)的RPMI-1640完全培养基;蓝莓花色苷处理组每孔加入1 mL含不同浓度蓝莓花色苷(终浓度为4、8、16、32和64 mg/mL)的RPMI-1640完全培养基。37 ℃ 5% CO2培养24 h后,1500 r/min 4 ℃离心5 min,收集上清。用ELISA法检测蓝莓花色苷对腹腔巨噬细胞IL-4、IL-12分泌的影响,参考小鼠细胞因子试剂盒说明书进行操作。
1.3 统计学分析

2 结果与分析
2.1 蓝莓花色苷对淋巴细胞增殖的影响
由图1可知,MTT 检测结果显示,蓝莓花色苷各浓度组和阳性组与空白对照组比较,淋巴细胞增殖率均显著高于空白对照组(p<0.05);蓝莓花色苷在4~32 mg/mL浓度范围内,淋巴细胞增殖率随蓝莓花色苷浓度的升高而增大,呈良好的剂量-效应关系,继续升高蓝莓花色苷浓度至64 mg/mL,淋巴细胞增殖率反而显著下降(p<0.05);蓝莓花色苷各浓度组与阳性组相比,蓝莓花色苷为32 mg/mL 浓度组淋巴细胞增殖率无显著差异(p>0.05),蓝莓花色苷其他浓度组淋巴细胞增殖率显著下降(p<0.05)。

图1 蓝莓花色苷对淋巴细胞增殖的影响Fig.1 The effects of blueberry anthocyanins on proliferation of lymphocytes注:不同小写字母表示差异显著(p<0.05);图2~图6同。
2.2 蓝莓花色苷对巨噬细胞吞噬功能的影响
由图2可知,蓝莓花色苷各浓度组与阳性组腹腔巨噬细胞吞噬活性值均显著高于空白对照组(p<0.05);蓝莓花色苷在4~32 mg/mL浓度范围内,腹腔巨噬细胞的吞噬活性随蓝莓花色苷浓度的升高而升高,呈良好的剂量-效应关系,继续升高蓝莓花色苷浓度至64 mg/mL,腹腔巨噬细胞的吞噬活性反而下降;与阳性组相比,蓝莓花色苷为8、16、32、64 mg/mL 浓度组腹腔巨噬细胞的吞噬活性无显著性差异(p>0.05),蓝莓花色苷为4 mg/mL 浓度组腹腔巨噬细胞的吞噬活性显著降低(p<0.05)。
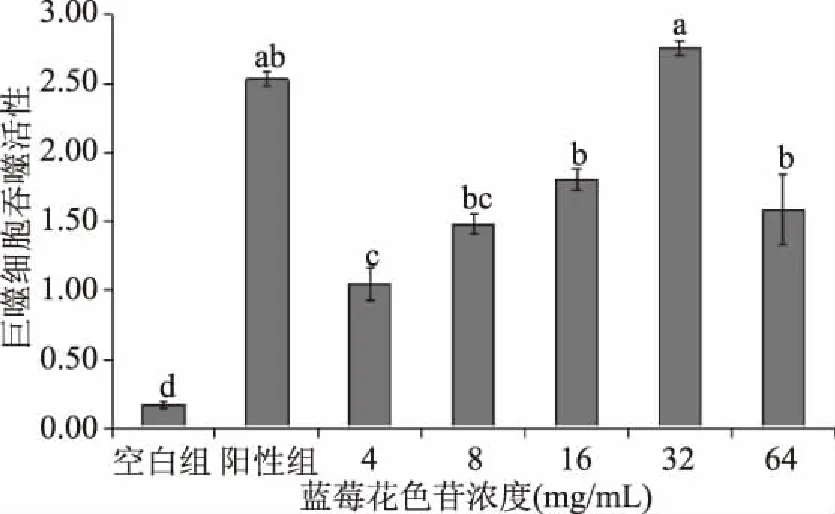
图2 蓝莓花色苷对腹腔巨噬细胞吞噬功能的影响Fig.2 The effects of blueberry anthocyanins on phagocytosis of macrophages
2.3 蓝莓花色苷对淋巴细胞分泌细胞因子的影响
2.3.1 蓝莓花色苷对淋巴细胞IL-6分泌的影响 由图3可知,ELISA检测结果显示,蓝莓花色苷各浓度组与阳性组淋巴细胞IL-6分泌量均高于空白对照组(p<0.05);在4~32 mg/mL浓度范围内,淋巴细胞IL-6分泌量随蓝莓花色苷浓度的升高而升高,呈良好的剂量-效应关系,继续升高蓝莓花色苷浓度至64 mg/mL,淋巴细胞IL-6分泌量反而下降;与阳性组相比,蓝莓花色苷为16、32 mg/mL浓度组淋巴细胞IL-6分泌量无显著差异(p>0.05),蓝莓花色苷为4、8、64 mg/mL浓度组淋巴细胞IL-6分泌量显著降低(p<0.05)。

图3 蓝莓花色苷对淋巴细胞IL-6分泌的影响Fig.3 The effects of blueberry anthocyanins on secretion of IL-6 in lymphocytes
2.3.2 蓝莓花色苷对淋巴细胞TNF-α分泌的影响 由图4可知,ELISA 检测结果显示,蓝莓花色苷各浓度组与阳性组淋巴细胞TNF-α分泌量均高于空白对照组(p<0.05);在4~32 mg/mL浓度范围内,淋巴细胞TNF-α分泌量随蓝莓花色苷浓度的升高而升高,呈良好的剂量-效应关系,继续升高蓝莓花色苷浓度至64 mg/mL,淋巴细胞TNF-α分泌量反而下降;与阳性组相比,蓝莓花色苷为32 mg/mL浓度组淋巴细胞TNF-α分泌量显著升高(p<0.05),蓝莓花色苷为16、64 mg/mL浓度组淋巴细胞TNF-α分泌量无显著差异(p>0.05),蓝莓花色苷为4、8 mg/mL浓度组淋巴细胞TNF-α分泌量显著降低(p<0.05)。
2.4 蓝莓花色苷对腹腔巨噬细胞分泌细胞因子的影响
2.4.1 蓝莓花色苷对腹腔巨噬细胞IL-4分泌的影响 由图5可知,ELISA 检测结果显示,蓝莓花色苷各浓度组与阳性组腹腔巨噬细胞IL-4分泌量均低于空白对照组(p<0.05);在4~32 mg/mL浓度范围内,腹腔巨噬细胞IL-4分泌量随蓝莓花色苷浓度的升高而降低,继续升高蓝莓花色苷浓度至64 mg/mL,腹腔巨噬细胞IL-4分泌量反而显著(p<0.05)升高;与阳性组相比,蓝莓花色苷为32 mg/mL 浓度组腹腔巨噬细胞IL-4分泌量无显著差异(p>0.05),其余各浓度组腹腔巨噬细胞IL-4分泌量均显著升高(p<0.05)。

图5 蓝莓花色苷对巨噬细胞IL-4分泌的影响Fig.5 The effects of blueberry anthocyanins on secretion of IL-4 in macrophages
2.4.2 蓝莓花色苷对腹腔巨噬细胞IL-12分泌的影响 由图6可知,ELISA检测结果显示,蓝莓花色苷各浓度组与阳性组腹腔巨噬细胞IL-12分泌量均高于空白对照组(p<0.05);在4~32 mg/mL浓度范围内,腹腔巨噬细胞IL-12分泌量随蓝莓花色苷浓度的升高而升高,呈良好的剂量-效应关系,继续升高蓝莓花色苷浓度至64 mg/mL,腹腔巨噬细胞IL-12分泌量反而下降;与阳性组相比,蓝莓花色苷为16、32 mg/mL 浓度组腹腔巨噬细胞IL-12分泌量无显著差异(p>0.05),其余各浓度组腹腔巨噬细胞IL-12分泌量显著降低(p<0.05)。

图6 蓝莓花色苷对巨噬细胞IL-12分泌的影响Fig.6 The effects of blueberry anthocyanins on secretion of IL-12 in macrophages
3 讨论
3.1 蓝莓花色苷对淋巴细胞及其相关因子的作用
脾脏占全身淋巴组织总量的25%,正常情况下,脾脏作为体内最大的外周免疫器官,淋巴细胞受抗原激活即分化增殖,吞噬消除衰老红细胞、细菌及异物,产生大量抗体,参与机体免疫反应[15]。淋巴细胞由淋巴器官产生,是机体免疫应答功能的重要细胞成分[16]。杜联峰等[17]利用西红花苷研究其对小鼠脾淋巴细胞增殖,发现西红花苷具有刺激小鼠脾淋巴细胞增殖的作用。高笑笑等[18]采用MTT 法检测雪灵芝粗多糖对体外培养的小鼠脾淋巴细胞增殖的影响。结果显示,雪灵芝粗多糖处理组对小鼠脾淋巴细胞的增殖具有体外激活作用。活细胞线粒体中的琥珀酸脱氢酶能使外源性的MTT还原为难溶性的蓝紫结晶物formazan,并沉积在细胞中,而死细胞无此功能[19],因此,本实验以左旋咪唑为阳性对照,采用MTT法观察蓝莓花色苷对体外培养淋巴细胞增殖功能的影响,结果显示,蓝莓花色苷与左旋咪唑对小鼠脾淋巴细胞增殖均表现出明显的促进作用。
细胞因子是参与机体免疫调节的重要介质,TNF-α是炎症反应过程中出现最早、最重要的炎性介质,能调节其它组织代谢活性并促使其它细胞因子的合成和释放。IL-6由巨噬细胞、Th2细胞、B淋巴细胞及内皮细胞等多种细胞产生的一种多效应细胞因子,能够刺激B细胞增殖,分泌抗体,刺激T细胞增殖及CTL活化,增强自然杀伤细胞(NK细胞)及T细胞的抗肿瘤活性,在细胞免疫应答和造血调节中以自分泌或旁分泌方式发挥重要作用[20]。Xie等[21]利用蓝莓花色苷对巨噬细胞抗炎作用的研究中,发现蓝莓花色苷能降低小鼠血清中TNF-α和IL-6含量,降低腹腔巨噬细胞的TNF-α、IL-6 mRNA的表达;抑制RAW264.7巨噬细胞TNF-α、IL-6 mRNA的表达,其机制可能是蓝莓花色苷通过抑制RAW 264.7 细胞的NF-κB、MAPK p38和JNK信号通路活化有关。刘英姿等[22]利用碎米花杜鹃叶中分离得到的化合物原花青素A-1研究其免疫增强的作用机制。结果显示,原花青素A-1各浓度在体外能增加Con A刺激的脾细胞分泌的辅助性T细胞亚群(Th1)细胞因子(IL-2、IL-12、IFN-γ、TNF-α)的分泌量和Con A刺激的脾细胞分泌的抑制Th2细胞因子(IL-4、IL-10)的分泌量。王志宏等[23]采用MTT法和ELISA技术,通过考察不同纯度的杜仲黄酮对淋巴细胞增殖及细胞因子IL-2和IFN-γ诱生作用的影响。结果显示,杜仲黄酮粗品及槲皮素均对经Con A或LPS刺激下的淋巴细胞的增殖和细胞因子IL-2与IFN-γ的分泌有协同作用。在本实验中,蓝莓花色苷可使淋巴细胞培养上清中 IL-6、TNF-α水平呈浓度依赖性升高,并提示蓝莓花色苷可通过刺激淋巴细胞IL-6、TNF-α分泌来提高淋巴细胞的免疫调节功能。同时蓝莓花色苷不仅可直接性激活腹腔巨噬细胞,并可通过上调 IL-6、TNF-α水平间接性地增强腹腔巨噬细胞吞噬、杀伤功能。本实验所利用的蓝莓花色苷与原花青素、杜仲黄酮同属黄酮类物质,且同刘英姿、王志宏等利用原花青素、杜仲黄酮对小鼠免疫功能影响的研究结果是一致的。
3.2 蓝莓花色苷对腹腔巨噬细胞吞噬能力及其相关因子的作用
吞噬作用在巨噬细胞中是一个受到高度调节的功能,静止、循环的巨噬细胞仅有最低限度的吞噬能力,接触其他信号,如抗原和细胞因子等可激活巨噬细胞,并使巨噬细胞功能增强[24]。Mantovani等[25]认为巨噬细胞不但能够通过分泌促炎性细胞因子和趋化因子,介入免疫应答,发挥免疫监视功能,还可通过抑制细胞因子IL-10/TGF-B等下调免疫应答,在免疫调节中发挥作用。李佳等[26]等利用原花青素与熟地对小鼠免疫功能的影响,发现原花青素与熟地能够提高免疫器官的增长指数、增强巨噬细胞吞噬功能以及DNFB所致迟发型超敏反应的能力,两种药物配合使用能显著调节小鼠免疫功能。本实验以左旋咪唑为阳性对照,采用中性红吞噬实验检测腹腔巨噬细胞吞噬能力,结果显示,蓝莓花色苷与左旋咪唑对腹腔巨噬细胞中性红吞噬活性显著或极显著提高,并提示蓝莓花色苷对体外培养的小鼠固有性免疫细胞功能均具有明显的促进作用。花色苷是花青素与糖以糖苷键结合而成的一类化合物,植物中花青素多以花色苷的形式存在。本实验与李佳等[26]利用原花青素与熟地对小鼠免疫功能影响的研究结果是一致的。
IL-4对于B细胞、T细胞、肥大细胞、巨噬细胞都有免疫调节作用,具有促进巨噬细胞提呈抗原和杀伤肿瘤细胞的功能,可能与调节MHC Ⅱ类抗原和FcR表达有关。IL-4是小鼠巨噬细胞趋化因子,并促进IL-1ra产生,但抑制单核细胞IL-1、TNF和IL-6的产生。IL-12主要由B淋巴细胞产生,IL-12通过诱导产生的IFN-γ激活巨噬细胞,诱导其TNF-α的分泌。IL-12可诱导Th1亚群的形成,此作用可能通过两种途径,一是IL-12直接作用于Th1亚群;二是IL-12刺激T细胞、NK细胞产生IFN-γ诱导Th1亚群形成。王晓利等[27]为探讨甘草的3种主要成分甘草甜素、甘草多糖和光甘草定对小鼠腹腔巨噬细胞的毒性与免疫功能的调节作用,将3种药物分别与巨噬细胞作用12、24和36 h后,用ELISA试剂盒检测3种药物对巨噬细胞分泌细胞因子的影响。结果显示,所有实验浓度的3种药物均能显著增强巨噬细胞分泌IL-1β、IL-6、IL-12和TNF-α的能力(p<0.01),高剂量抑制IL-4、IL-10和TGF-β的分泌(p<0.01),而低剂量没有明显变化。在本实验中,蓝莓花色苷可使小鼠腹腔巨噬细胞培养上清中IL-12水平呈浓度依赖性升高,并提示蓝莓花色苷可通过刺激小鼠腹腔巨噬细胞IL-12分泌来提高巨噬细胞的免疫调节功能。4、8、16、32 mg/mL的蓝莓花色苷抑制小鼠腹腔巨噬细胞分泌IL-4,浓度为64 mg/mL开始促进IL-4分泌。提示蓝莓花色苷呈剂量依赖性地分泌促炎性细胞因子以及降低抑炎性细胞因子的分泌,来发挥腹腔巨噬细胞的免疫功能。本实验所利用的蓝莓花色苷与光甘草定同属黄酮类物质,且同王晓利等[27]利用甘草的3种主要成分甘草甜素、甘草多糖和光甘草定对小鼠腹腔巨噬细胞的免疫功能调节作用的研究结果是一致的。
4 结论
蓝莓花色苷可通过促进脾淋巴细胞增殖和细胞因子IL-6、TNF-α的分泌,来提高淋巴细胞免疫调节活性;通过促进巨噬细胞吞噬功能和细胞因子IL-12的分泌以及降低IL-4的分泌,来提高巨噬细胞的免疫调节活性,从而提高机体免疫功能。
