副溶血性弧菌微滴数字 PCR定量方法的建立
2018-10-22方佩佩赵丽青王昌军李正义贾俊涛姜英辉
方佩佩,赵丽青,马 云,王昌军,唐 静,李正义,贾俊涛,姜英辉
(山东出入境检验检疫局检验检疫技术中心,山东青岛 266002)
副溶血性弧菌(Vibrioparahemolyticus,VP)是一种嗜盐的革兰氏阴性致病菌,是我国沿海地区引起食物中毒最常见的病原菌[1-2]。当食品中副溶血性弧菌达到106CFU/mL时,即能引起食物中毒,其潜伏期为2~26 h,主要症状有腹痛、腹泻、呕吐和发烧等,严重可能危及生命[3-4]。副溶血性弧菌具有多种表型、血清型和产毒型菌株,针对溶血素设计的探针、引物不能检测所有致病菌株[4-7]。不耐热溶血毒素(Thermolabilehemolysin,TLH)由H. Taniguchi[8]等发现,它不是一个毒素基因,但存在于所有副溶血性弧菌的临床分离株和环境分离株中[6],因此本研究选取TLH基因作为靶基因进行检测。
近些年对副溶血性弧菌的定量检测越来越受到关注和重视,常用的检测副溶血性弧菌的方法有常规培养法、分子检测法和免疫检测法等,这些方法存在检测周期长、特异性低、不能准确定量等缺点。国标规定,自2014年7月起水产制品中副溶血性弧菌的检测为MPN定量法[9],检测周期为3~5 d,此法敏感性及特异性差,且耗时长[1]。免疫磁分离和环介导等温扩增快速检测[2]、环介导等温扩增技术(LAMP)[10-11]、实时荧光PCR技术[12-16]、多重PCR技术等,这些技术已发展较为成熟,且操作简便、检测周期短,但是免疫磁珠法灵敏度及特异性较低,分子检测法不能对副溶血性弧菌进行准确定量[2]。
微滴式数字PCR技术(Droplet digital PCR,ddPCR)是近年来发展起来的快速、精确、可实现DNA绝对定量的PCR方法[17-18]。其原理是利用微滴生成器将含有核酸分子的反应体系分散成2万个独立的纳升级微滴,并进行扩增,最终根据阳性微滴比例及泊松分布原理,计算待测目标拷贝数。微滴式数字PCR技术从核酸提取至完成检测,最快能在2~3 h内完成,它既解决了传统培养法周期长的缺点,又能够对检测目标进行准确定量。目前,ddPCR技术已经应用于金黄色葡萄球菌、大肠杆菌O157∶H7、沙门氏菌、阴沟肠杆菌、单核增生细胞李斯特氏菌[17,19-23]等食源性致病微生物检测中,但在副溶血性弧菌的定量检测中研究较少,针对现有检测方法的不足,本研究拟采用ddPCR技术建立起副溶血性弧菌的快速准确定量方法,提高检出率及精确度,满足公共卫生事件快速应急处理的需要。
1 材料和方法
1.1 材料与仪器
试验菌株及材料等详见表1。

表1 试验菌株及材料Table 1 Test strains and materials
QX200微滴式数字PCR系统 美国伯乐公司;罗氏480实时荧光定量PCR系统 罗氏公司;CF16RXII高速冷冻离心机 日本日立公司;U-3010紫外-可见分光光度计 日本日立公司;DYY-8C型电泳仪及凝胶成像分析系统 北京市六一仪器厂。
1.2 实验方法
1.2.1 引物的设计探针 采用V.parahaemolyticus较常用的不耐热溶血毒素基因TLH基因引物和探针[24]见表2。

表2 副溶血性弧菌特异性PCR扩增引物和探针序列Table 2 Primer and probe sequence for V. parahaemolyticusby polymerase chain reaction(PCR)
1.2.2 菌株活化 菌株取自-80 ℃冰箱,TSA-YE培养基37 ℃活化24 h,挑取单菌落在TSA-YE培养基上37 ℃过夜纯培养。挑取纯培养后的菌到10 mL的营养肉汤中,120 r/min摇床培养24 h。
1.2.3 菌悬液浓度的测定及DNA提取 取活化的ATCC 17802副溶血性弧菌菌悬液,生理盐水梯度稀释至10-1、10-2、10-3、10-4、10-5、10-6、10-7,标记备用。用3M细菌总数测试纸片计数不同梯度菌悬液浓度,每个梯度3个平行。同时取各梯度菌液各3 mL,采用北京Tiangen提取试剂盒提取基因组DNA备用。本文中除特异性验证外,皆采用ATCC 17802副溶血性弧菌进行试验。
采用北京Tiangen提取试剂盒,提取表1中剩余16株细菌DNA,分别标记备用。
1.2.4 数字PCR试验 反应体系:12.5 μL ddPCRTMSuperMix for Probes(no dUTP),上、下游引物各1 μL(终浓度10 pmol),探针0.5 μL(终浓度5 pmol)[25],DNA模板(60 μg/mL)2.5 μL,用双蒸水补足总体积25 μL。分装预混液各20 μL,至对应的微滴生成卡的sample孔位里,在微滴生成卡的oil孔位分别加入70 μL的Droplet generator oil,进行微滴生成。将生成的40 μL微滴全部转入96孔反应板,PCR扩增。PCR反应条件:95 ℃预变性10 min;95 ℃变性30 s,60 ℃退火1 min,40个循环;98 ℃固化微滴10 min。最后用微滴分析仪对扩增产物进行计数分析。
1.2.5 数字PCR方法特异性验证 将1.2.3中提取的17株菌DNA进行104倍稀释,按照1.2.4条件进行ddPCR检测,验证引物、探针特异性。
1.2.6 实时荧光PCR试验 参照行业标准《SN/T 1870-2016 出口食品中食源性致病菌检测方法 实时荧光PCR法》[26]。
1.2.7 数字PCR方法的检出限及灵敏度、COPY数和菌液浓度的线性关系 将提取得到的ATCC 17802副溶血性弧菌DNA,进行琼脂糖凝胶电泳(TAE配制0.8%琼脂糖凝胶,使用GelRed核酸染料,样品进样量为3 uL,电压130 V,电泳40 min,λ DNA/Hind Ⅲ Marker,6×DNA Loading Buffer),确定DNA片段的完整性。将1.2.3提取的不同梯度副溶血性弧菌DNA,按照1.2.4和1.2.6所述方法分别进行数字PCR和荧光定量PCR,每个梯度重复3次。确定PCR检测副溶血性弧菌的检出限及检测灵敏度,建立ddPCR的Copy数和菌液浓度的线性关系。
ddPCR的Copy数与对应菌悬液浓度的换算关系公式如下:
(1)
式中:C-根据ddPCR的Copy数换算得到菌悬液的浓度(CFU/mL);X-ddPCR中20 μL体系的Copy数(个/20μL);V1-DNA提取最终的定容体积(μL);V2-DNA提取的菌悬液体积(mL);V3-ddPCR反应体系中DNA模板体积(μL)。
本试验中,DNA提取最终的定容体积V1为150 μL,DNA提取的菌悬液体积V2为3 mL,ddPCR反应体系中DNA模板体积V3为2 μL。
1.2.8 人工污染样品检测 无菌混匀的鳕鱼肉称取25份,每份25 g,放于无菌均质袋中,加入225 mL的BPW彻底混匀。采用人工污染的方式制备样品,特异性验证添加表1中的17株菌,定量检测ATCC 17802副溶血性弧菌样品的污染水平大约在100、101、102、103、104、105、106、107CFU/g,并进行阴性、阳性对照,按照1.2.2提取DNA,进行ddPCR检测。
1.3 数据处理
每个试验重复3次,应用SPSS对数据做显著性及相关性分析,显著性水平为0.05。
2 结果与分析
2.1 数字PCR方法特异性验证结果
提取表1中所列菌株的DNA,用1.2.1中副溶血性弧菌引物探针进行ddPCR扩增,ddPCR结果如图1所示,三株副溶血性弧菌呈阳性微滴信号,而其他菌株及阴性对照均未出现扩增,表明1.2.1中副溶血性弧菌引物探针的特异性较强。

图1 数字PCR方法特异性验证结果图Fig.1 Specific verification results diagram of ddPCR
2.2 PCR方法的检出限及灵敏度结果
副溶血性弧菌DNA进行琼脂糖凝胶电泳结果如图2所示,两组副溶血性弧菌条带单一,DNA链完整,在提取过程中未出现断裂,每个菌对应一个模板和一个copy,因此通过ddPCR扩增能够较准确计算菌浓度。

图2 副溶血性弧菌琼脂糖凝胶电泳图Fig.2 Agarose gel electrophoresis diagram of Vibrio parahemolyticus注:1和4为marker,2和3为副溶血性弧菌DNA。
副溶血性弧菌的各梯度菌悬液浓度如表3所示,其中原倍浓度为4.4×107CFU/mL。各梯度副溶血性弧菌DNA模板ddPCR检测结果如图3所示,对应的有效菌悬液浓度即检出限为4.7×105~4.7×101CFU/mL,各梯度换算浓度C(根据ddPCR的Copy数换算得到菌悬液的浓度)与3M测试片所得菌悬液浓度之间无显著性差异(p>0.05)。反应1、2中由于模板浓度过高,无阴性微滴,无法正常推测菌悬液浓度,数值无效,此情况如需确定浓度可通过稀释菌悬液解决。本方法中,ddPCR能够检测到副溶血性弧菌最低检出限为菌悬液浓度4.7×101CFU/mL,对应ddPCR拷贝数为2 copies/20 μL,推测得模板的拷贝数为5.0×101copies/mL,灵敏度为0.2 copies/20 μL,与菌悬液浓度不具有显著性差异(p>0.05)。
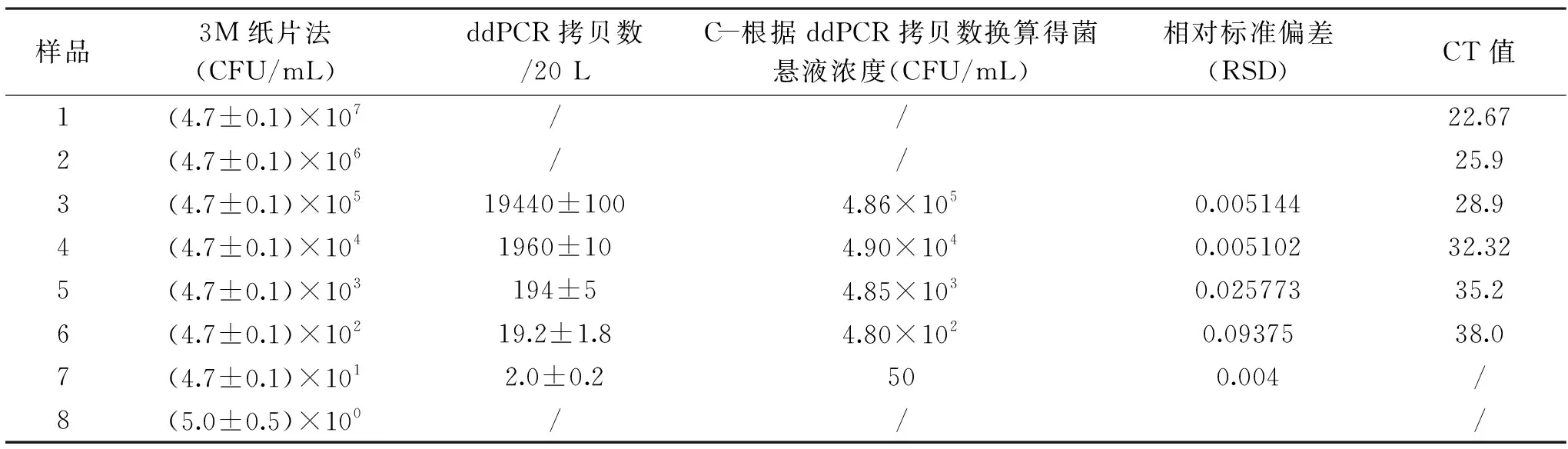
表3 检出限及灵敏度结果Table 3 Sensitivity results

图3 ddPCR灵敏度结果图Fig.3 Sensitivity diagram of ddPCR注:1~8分别代表菌悬液浓度为4.4×107、4.4×106、4.4×105、 4.4×104、4.4×103、4.4×102、4.4×101、4.4×100 CFU/mL。
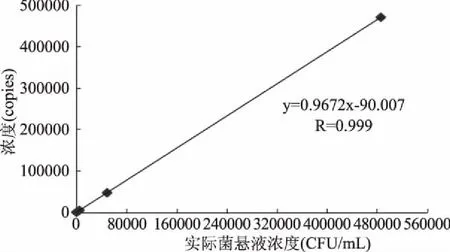
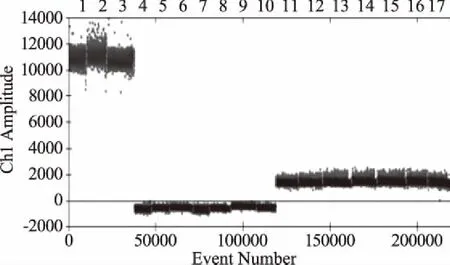
各梯度副溶血性弧菌DNA模板荧光PCR检测结果如图4及表3所示。当浓度≥4.7×104CFU/mL时,对应CT值≤35,检测结果为阳性;当浓度为4.7×103、4.7×102CFU/mL时,35 图4 荧光定量PCR灵敏度结果图Fig.4 Sensitivity map of qPCR注:1~8分别代表菌悬液浓度为4.4×107、4.4×106、4.4×105、 4.4×104、4.4×103、4.4×102、4.4×101、4.4×100 CFU/mL。 以副溶血性弧菌菌悬液浓度为横坐标,以浓度C(根据ddPCR的Copy数换算得到菌悬液的浓度)为纵坐标,生成标准曲线线性关系良好,R2≥0.99,说明采用ddPCR技术进行副溶血性弧菌的定量有可行性,为进一步的实际应用提供数据支持。 图5 ddPCR拷贝数与菌悬液浓度的线性关系Fig.5 Standard curve for copies of ddPCR and suspension concentration of Vibrio parahaemolyticus 鳕鱼样品中分别添加3株副溶血性弧菌及14株其他菌进行特异性验证,结果如图6所示,3株阳性菌出现明显扩增,阴性菌株无扩增,结果与2.1相一致,证明TLH基因引物探针特异性较强。鳕鱼样品中添加梯度浓度副溶血性弧菌,提取DNA进行ddPCR扩增,结果如图7所示,与2.2直接提取菌悬液DNA进行ddPCR扩增的结果相吻合,说明采用ddPCR技术对副溶血性弧菌进行定量实际检测具有可行性。 图6 人工污染样品特异性验证结果图Fig.6 Specific verification results diagram of artificially contaminated sample 图7 梯度浓度人工污染样品检测结果图Fig.7 Detection results diagram of gradient concentration artificially contaminated sample 按照副溶血性弧菌的国家标准检测要求GB 4789.7-2013[27],经过前增菌、分离纯化、生化鉴定和血清学鉴定,检测周期为3~5 d,从提取DNA到ddPCR技术仅需几个小时,成倍缩短周期,提高了检测效率。 ddPCR分析浓度结果与3M测试片相比,ddPCR检测结果偏高于3M纸片结果,这可能是由于,PCR技术主要针对生物因子核酸片段检测,已经死亡的或亚死亡的副溶血性弧菌DNA可能存在并被检测到,因此可能出现假阳性的结果[28-29]。 王忠发等[30]采用快速荧光定量PCR检测副溶血性弧菌定量的线性范围为2×103~2×108CFU/mL,王建昌等[31]采用基于内参的副溶血性弧菌实时荧光定量PCR,以10倍梯度稀释的菌液经水煮法提取DNA为模板,最低检测限为4×102CFU/mL,张蕾[2]等采用免疫磁分离和环介导等温扩增快速检测得检测限为140 CFU/mL,胡兴娟[13]等采用荧光定量PCR技术得最低检测限为72 CFU/mL。另外,相兴伟[10]等采用环介导等温扩增技术(LAMP)得检测限50 CFU/mL。 本试验中,ddPCR检测得到副溶血性弧菌有效基因组DNA浓度范围为2~19440拷贝/20 μL,灵敏度为0.2 copies/20 μL,菌悬液浓度即检出限为50~4.86×105CFU/mL,与3M测试片结果无显著性差异(p>0.05)。与荧光定量PCR及LAMP等技术相比,ddPCR低浓度检测限灵敏度高、能进行准确定量。本试验中当副溶血性弧菌浓度≤4.7×103CFU/mL时,荧光PCR检测信号较弱,需要进行反复试验验证结果可靠性,而本实验中ddPCR低浓度检测限为50 CFU/mL,操作简单,同时ddPCR下限可以低至单拷贝,与荧光定量PCR相比不依赖标准曲线和Ct值,能够实现真正意义上的绝对定量[32]。 以副溶血性弧菌菌悬液浓度为自变量,以对应分析得COPY数为因变量,得到标准曲线R2≥0.99,线性关系良好。以容易检出副溶血性弧菌的鳕鱼为人工污染样品进行特异性验证及梯度浓度副溶血性弧菌阳性添加,结果证明采用ddPCR技术进行副溶血性弧菌的定量有可行性,具有实际应用价值。 综上,副溶血性弧菌ddPCR定量检测技术特异性良好,副溶血性弧菌ddPCR定量结果与实际菌浓度无显著差异(p>0.05),因此采用ddPCR技术对突发公共卫生事件应急检测、控制疫情扩散、提高病原菌检出率等均有重要意义[30,33]。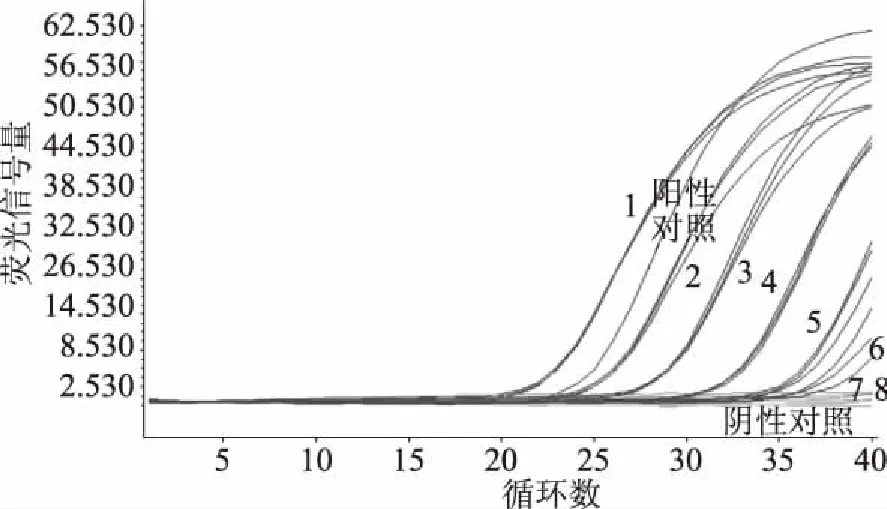
2.3 人工污染样品检测
3 结论与讨论
