壳聚糖固定化海藻糖合酶
2018-10-22黄珍,王慧,黄芳,李欣,王志,代俊,陈雄
黄 珍,王 慧,黄 芳,李 欣,王 志,代 俊,陈 雄
(湖北工业大学生物工程学院,发酵工程教育部重点实验室, 工业发酵湖北省协同创新中心,湖北武汉 430068)
海藻糖(Trehalose)是由两个葡萄糖分子通过α,α-1,1糖苷键缩合形成的一种非还原性的双糖,化学名为D-吡喃葡萄糖基-α-D-吡喃葡萄糖苷(α-D-glucopyranosyl-α-D-glucopy ranoside)。最早从麦角菌(Clavicepspurpurea)中分离得到,之后陆续在低等植物、藻类、细菌、真菌、酵母菌、昆虫及无脊椎动物中被发现[1]。海藻糖不仅是一种重要的有机碳源,更是一种生物体对抗冷、热、氧化等胁迫条件的重要保护剂;还能阻止高渗、高盐条件下物质的相变,保持细胞膜双分子层结构,减少膜的通透性和维持蛋白正常折叠形式;当存在某种逆境胁迫时,酵母细胞能富集海藻糖对抗胁迫环境,最高可达干重的15%以上[2]。基于海藻糖的上述特性,其常被作为稳定剂或食品添加剂应用于食品、药品及化妆品等工业领域[3]。
传统的海藻糖生产方法主要为酵母抽提法,其成本高,过程复杂,分离难度大,限制了海藻糖的应用;虽然酶转化法是目前研究和开发的重点,但游离酶只能一次性使用、可操作性低、储存中稳定性不高、对热和有机试剂敏感等缺点制约其在工业化方面的应用[4]。固定化酶具有增加酶稳定性、能重复使用、容易分离等优点,日益受到人们的重视[5]。
本研究中,用作固定化的海藻糖合酶来源于一种耐热嗜酸古菌(Picrophilustorridus),该菌在温度60 ℃、pH0.7的环境中依然能存活[6],其海藻糖合酶具有耐热性、耐酸性强的特点[7]。壳聚糖又名脱乙酰壳多糖,化学名称为聚葡萄糖胺(1-4)-2-氨基-B-D葡萄糖,由于来源广泛、生物相容性好、成本低廉等优点[8],选作本研究固定化酶的载体。本文利用基因工程菌生产海藻糖合酶,纯化后以壳聚糖为载体制备成固定化酶,研究固定化条件并比较固定化前后酶学特性,旨为工业化酶法生产海藻糖提供理论依据。
1 材料与方法
1.1 材料与仪器
pET-28a(+)-TreS BL21(含有pET-28a(+)-TreS质粒的EscherichiacoliBL21工程菌株) 由本实验室构建并保存;Bradford蛋白质定量试剂盒 天根生化科技(北京)有限公司;蛋白分子量标准 赛默飞世尔科技公司;超滤管(30 kDa,50 mL) Millipore公司;海藻糖、麦芽糖标准品 色谱级,Biosharp公司;壳聚糖 国药集团化学试剂有限公司;Ni-IDA-Sefinose Column BBI Life Sciences公司;其余试剂均为国产分析纯。
WFJ2000型可见分光光度计 尤尼柯(上海)仪器有限公司;UltiMate 3000型高效液相色谱仪 Thermo scientific公司;YXQ-LS-100SⅡ型高压蒸汽灭菌锅 上海博讯实业有限公司;5810R型高速冷冻离心机 eppendorf公司;JY92-Ⅱ型超声波细胞粉碎机 宁波新芝生物科技有限公司;DELTA 320型pH计 梅特勒-托利多仪器(上海)有限公司,等。
1.2 实验方法
1.2.1 海藻糖合酶(TreS)的制备 将37 ℃活化后的pET-28a(+)-TreS BL21菌株按1%接种量分别接种于5瓶含50 μg/mL卡那霉素的200 mL LB培养液中,37 ℃、200 r/min培养至OD600=0.6,分别添加终浓度为0.1 mmol/L的IPTG,置于20 ℃、200 r/min诱导12 h。离心收集诱导表达后的pET-28a(+)-TreS BL21菌体,水洗三次,每克湿菌体添加10 mL Ni-Native-0缓冲液(50 mmol/L NaH2PO4,300 mmol/L NaCl,pH8.0)悬浮,冰浴下250 W超声破碎10 min,12000 r/min离心20 min取上清,即为粗酶液。粗酶液的纯化依据Ni-IDA-Sefinose Column说明书进行,分别按顺序用含20、50、100、250和500 mmol/L咪唑的洗脱缓冲液对蛋白进行梯度洗脱,然后用SDS-PAGE检测梯度洗脱液中的纯化蛋白有无情况。接着将层析柱纯化的酶洗脱液再用超滤管进行脱盐浓缩,使用20 mmol/L磷酸钠缓冲液(pH6.0)作为置换缓冲液。酶浓度使用Bradford蛋白质定量试剂盒测定。
1.2.2 TreS固定化条件研究 依据岳振峰固定化酶的方法[9],先称取1 g壳聚糖,分别按4.0、5.6、7.2、8.0、12.0、16.0、20.0、24.0、32.0、40.0、48.0 mg/g给酶量(海藻糖合酶与壳聚糖的质量比)加入纯化酶,再用50 mmol/L磷酸钠缓冲液(pH6.0)定容到20 mL,15 ℃吸附过夜,静置,离心,弃去上清液,用50 mmol/L磷酸钠缓冲液(pH6.0)洗至洗液无蛋白质检出为止,研究不同给酶量对固定化酶酶活的影响。在上述最优给酶量条件下,进一步研究不同吸附时间(0.5、1.0、1.5、2.0、2.5、3.0、4.0 h)对固定化酶相对酶活的影响。在最适给酶量和最适吸附时间条件下,测定固定化海藻糖合酶的酶活回收率。相对酶活(%)是在考察最适催化条件时,将某一条件下测定的酶活最高值记为100%,其他条件下测定的酶活与最高酶活的比值[10]。酶活回收率的计算公式为:酶活回收率(%)=固定化酶的总酶活/固定化中加入的游离酶的总酶活×100[11]。
1.2.3 游离酶和固定化酶的酶学特性研究
1.2.3.1 最适酶反应温度 在反应pH为6.0的条件下,将游离酶和固定化酶分别置于不同温度(4、20、30、40、45、50、60、70、80 ℃)反应,研究温度分别对游离酶和固定化酶相对酶活的影响,确定最适酶反应温度。
1.2.3.2 最适酶反应pH 在最适反应温度下,将游离酶和固定化酶分别置于不同pH(3.5、4.5、5.5、6.0、6.5、7.5、8.5)反应,研究pH分别对游离酶和固定化酶相对酶活的影响,确定最适酶反应pH。
1.2.3.3 反应进程曲线 按照1.2.5中酶活的测定方法,在20 mL体系中测定游离酶和固定化酶的反应进程,分别绘制海藻糖、麦芽糖和葡萄糖的反应进程曲线[4],根据海藻糖的最大生成量数值,计算游离酶和固定化酶的最大海藻糖得率[12],海藻糖得率的计算公式为:海藻糖得率(%)=反应中产物海藻糖的浓度/反应前底物麦芽糖的浓度×100。
1.2.4 固定化酶的稳定性研究
1.2.4.1 重复使用性 评价固定化酶稳定性的两个主要指标是酶活残留率和重复使用次数[13]。用1.2.2的最优固定化酶条件,将制备的固定化酶进行9次重复分批催化试验,每次反应后用缓冲液洗涤3次,再进行反应,测定酶活力,计算每次重复使用后的酶活残留率。酶活残留率的计算公式为:酶活残留率(%)=处理后残留的酶活/处理前酶活×100[10]。
1.2.4.2 热稳定性 将游离酶和固定化酶在不同温度(4、20、30、40、45、50、60、70、80 ℃)放置20 min,再分别测定两者的相对活性[7],比较两者的热稳定性。
1.2.4.3 酸碱稳定性 将游离酶和固定化酶在不同pH(3.5、4.5、5.5、6.0、6.5、7.5、8.5)放置20 min,再分别测定两者的相对活性[7],比较两者的酸碱稳定性。
1.2.5 酶活的测定
1.2.5.1 游离酶 将16 μg纯化酶加入100 μL麦芽糖含量为150 mmol/L的磷酸钠缓冲液(pH6.0)中,45 ℃反应25 min,沸水浴15 min结束反应。酶活力定义为:在上述条件下,每分钟催化产生1 μmol海藻糖所需的酶量(mg)为一个酶活力单位(U/mg)。
1.2.5.2 固定化酶 在1 g壳聚糖固定化酶中加入20 mL含150 mmol/L麦芽糖的磷酸钠缓冲液(pH6.0),40 ℃搅拌反应25 min,沸水浴15 min结束反应。酶活力定义为:在上述条件下,每分钟催化产生1 μmol海藻糖所需的固定化酶量(g)为一个酶活力单位(U/g)[4]。
1.2.5.3 色谱分析方法 酶催化反应液经12000 r/min离心5 mim后,取上清液用高效液相色谱-蒸发光散射检测法(HPLC-ELSD)分析麦芽糖、海藻糖与葡萄糖含量。色谱条件为:氨基柱(Agilent,ZORBAX NH2,4.6 mm×250 mm,5 μm),柱温30 ℃,检测器Alltech 2000ES蒸发光散射检测器,漂移管温度90 ℃,流动相为乙腈∶水(19∶6),流速1 mL/min。
1.3 数据处理
每个样品设3个平行,利用Origin 8.0软件进行数据分析,测定结果以平均值±标准差表示。
2 结果与分析
2.1 海藻糖合酶的纯化
用Ni-IDA亲和层析柱纯化重组蛋白,不同浓度咪唑洗脱液对蛋白的洗脱情况如图1。由图中泳道1和2对比可知,粗酶液经过层析柱后,重组蛋白被层析柱吸附,由泳道3、4、5、6和7对比可知,泳道4、5和6在预期结果处含有蛋白条带,即在50、100和250 mmol/L咪唑洗脱液中成功纯化出重组蛋白。

图1 SDS-PAGE分析纯化结果Fig.1 SDS-PAGE analysis of the purification results注:M为蛋白分子量标准;泳道1为超声破碎后的粗酶液; 泳道2为过层析柱后的粗酶液;泳道3、4、5、6、7分别为 20、50、100、250和500 mmol/L咪唑的洗脱液。
2.2 海藻糖合酶固定化条件的研究
2.2.1 固定化海藻糖合酶的给酶量 由图2可知,给酶量在4.0~32.0 mg/g时,酶活性迅速增加,这可能由于壳聚糖吸附的酶量随给酶量增加而增多;当给酶量大于32.0 mg/g时,酶活性变化不大,这时壳聚糖吸附的酶量基本达到饱和状态,再增加给酶量,酶已不能被吸附。因此,选择最佳固定化给酶量为32.0 mg/g。

图2 给酶量对酶活的影响Fig.2 Effect of different enzyme loading on the activity
2.2.2 固定化海藻糖合酶的吸附时间 从图3中可看出,吸附时间在0.5~2.5 h时,酶活逐渐增加,这可能因为壳聚糖吸附的酶量随时间增加而增多,而吸附3.0 h之后,由于后期酶变性速度大于吸附速度,使得固定化酶活性逐渐下降。因此,选择2.5 h为最适固定化吸附时间。采用研究后的固定化条件:给酶量为32.0 mg/g,吸附时间为2.5 h,测定固定化海藻糖合酶的酶活回收率为40.17%。

图3 吸附时间对相对酶活的影响Fig.3 Effect of different adsorption time on the relative activity
2.3 固定化酶酶学特性和稳定性研究
2.3.1 固定化酶最适反应温度和热稳定性 研究中分别测定了温度对游离酶和固定化酶相对酶活的影响,发现固定化酶的最适反应温度为40 ℃,游离酶最适反应温度为45 ℃,该酶固定化后最佳反应温度下降(见图4)。经过测定不同温度的热稳定性,发现固定化酶的温度稳定性与游离酶相比差距不大,其在4~60 ℃范围内放置20 min后,相对酶活均高于87%(见图5)。

图4 温度对游离酶和固定化酶相对活性的影响Fig.4 Effects of temperature on the relative activity of the free and immobilized enzyme
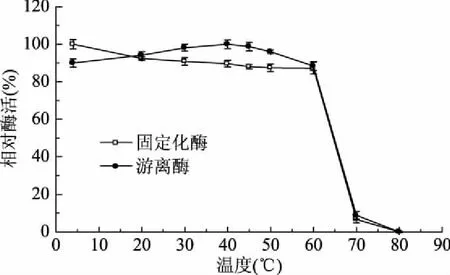
图5 温度对游离酶和固定化酶稳定性的影响Fig.5 Effects of temperature on the stability of the free and immobilized enzyme
2.3.2 固定化酶最适反应pH和酸碱稳定性 分别测定pH对游离酶和固定化酶相对酶活的影响,如图6所示,该酶经固定化后,最适反应pH仍为6.0,但pH适用范围变宽,在pH3.5~8.5间,相对酶活均高于50%,而游离酶在pH3.5和pH8.5下则完全失活。

图6 pH对游离酶和固定化酶相对活性的影响Fig.6 Effects of pH on the relative activity of the free and immobilized enzyme
固定化酶在pH3.5~8.5范围内放置20 min后,相对酶活均高于60%,尤其在pH3.5中放置20 min后,固定化酶相对酶活还有62.36%,而游离酶完全丧失活性。由以上研究可知,该酶经固定化后,酸碱稳定性增强,且酸稳定性明显高于游离酶,如图7所示。
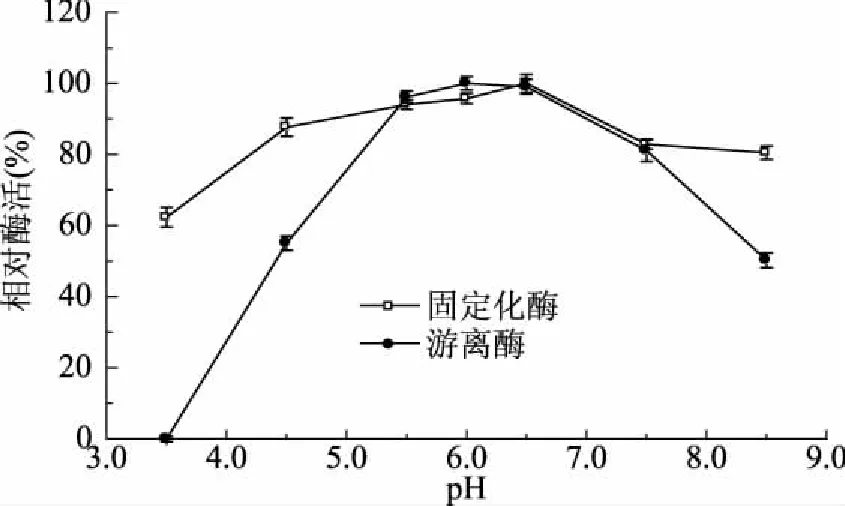
图7 pH对游离酶和固定化酶稳定性的影响Fig.7 Effects of pH on the stability of the free and immobilized enzyme
2.3.3 重复使用性 游离酶由于不易从反应体系中分离出来,因此不具有可重复操作的特性[14],而固定化酶则具有可重复使用的优势[15]。为了验证本次固定化酶的重复使用稳定性,进行了9次重复使用酶活试验。从图8可知,酶活性的下降主要发生在第一次反应和第二次反应之间,降低了19.48%,这可能是由于载体壳聚糖的稳定性较差[16],此后多次重复使用对酶活影响不大,经9批次重复使用之后,酶活残留率为64.64%。因此该固定化海藻糖合酶具有一定的重复使用稳定性,可重复使用,能降低工业化的使用成本。

图8 固定化海藻糖合酶的重复使用性Fig.8 Reusability of the immobilized TreS
2.3.4 反应进程曲线 图9描述了固定化酶和游离酶的反应进程,从中可以看出,固定化酶与麦芽糖在反应2 h时,海藻糖的生成量最高,最大得率为61.4%;随着反应时间的增加,海藻糖的含量有所下降,这可能由于反应的持续进行,海藻糖发生了部分水解造成。而游离酶的酶促反应较固定化酶平缓,在反应4 h时,海藻糖的生成量达最高,最大得率为60%。经比较可知,固定化酶的转化率与游离酶相当,但反应速率比游离酶快。
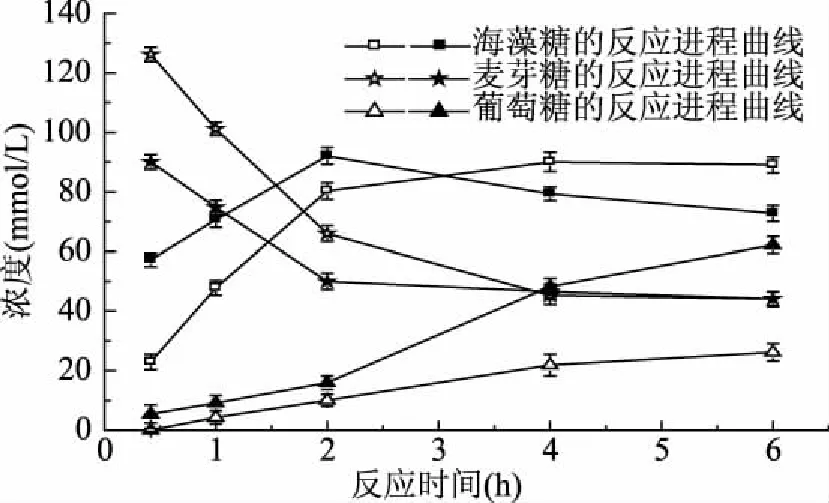
图9 固定化酶和游离酶催化麦芽糖反应的进程曲线Fig.9 Reaction progress curves of maltose catalyzed by the free and immobilized enzyme
3 结论
本实验利用大肠杆菌工程菌表达海藻糖合酶,纯化后,利用壳聚糖为载体直接吸附制备成固定化酶,探索出最适给酶量为32.0 mg/g,最适吸附时间为2.5 h。利用该固定化方法,固定化酶最适反应温度为40 ℃,最适反应pH为6.0,酶活回收率为40.17%,重复使用9次之后,酶活残留率为64.64%。与游离海藻糖合酶相比,固定化酶在4~60 ℃范围内放置20 min后,相对酶活均高于87%,温度稳定性两者没有显著变化;但固定化酶在pH3.5~8.5范围内放置20 min后,相对酶活均高于60%,酸碱稳定性优于游离酶。反应进程试验表明,固定化酶在反应2 h时,有最大海藻糖得率为61.4%,反应速率较游离酶快。综上所述,固定化的海藻糖合酶不仅酸碱稳定性明显改善,而且具有可重复使用性,有利于酶的工业化生产和储存,为工业化酶法生产海藻糖提供一定理论依据。
欢迎订阅《食品工业科技》
