分离纯化胰岛细胞超薄切片的琼脂预包埋制备方法
2018-10-19首都医科大学100069金良韵姬曼孙竹林
首都医科大学(100069)金良韵 姬曼 孙竹林
利用电子显微镜对样品进行观察和研究,不仅要有先进精密的仪器,更要有制备样品所需的各种技术技巧[1]。由于胰岛细胞体积小,分布分散,给电镜取材造成了困难;而在人类胰岛细胞数量庞大,仅占胰腺总体积的1%~2%,如常规电镜取材则费时费力。本研究采用了胶原酶Ⅺ灌注法对小鼠进行取材,避免了取不到胰岛细胞的尴尬。同时采用琼脂预包埋的方法,该方法对样品进行多次离心沉淀不会损伤样品超微结构。
1 材料与方法
1.1 实验动物 健康C57/6J雄性小鼠
1.2 主要仪器设备与试剂 ①超薄切片机(leica UC7),透射电镜(HITACHI HT7700)。②戊二醛、锇酸、乙醇、丙酮、Epon812、醋酸双氧铀、柠檬酸铅,均购自美国EMS(Electron microscopy science)公司。琼脂糖为美国Sigma公司产品。胶原酶Ⅺ(#C7657)为美国Sigma-Aldrich公司产品。
1.3 方法
1.3.1 分离、纯化胰岛细胞团 将小鼠麻醉,打开腹腔充分暴露十二指肠及周边胰腺,探查胆总管,用动脉夹夹闭靠近十二指肠的乳头处,经胆总管注射2.5mL胶原酶Ⅺ溶液,可见胶原酶沿胰尾顺序充盈,再将其胰尾及其他部分完整摘取,放入50mL离心管中,38℃水浴箱消化10min,加入遇冷HBSS缓冲液至40mL停止消化,1400rpm离心1min,弃掉上清液,重复离心3次。加入4℃ Histopaque1077 7mL重悬,再沿离心管管壁缓慢加入4℃DMEM培养基7mL,可见离心管内液体分液,2000rpm,离心10min。并缓慢吸出两液间的胰岛移至含有6mLHBSS的细胞培养皿(60mm)中。在体式显微镜下,用移液枪挑取完整胰岛,将挑取出来的胰岛放入另一个含有6mLHBSS的细胞培养皿(60mm)中,手动挑取重悬胰岛3次。
1.3.2 戊二醛预固定 在培养皿中加入预冷的4℃戊二醛3~5mL,固定10min,再将液体移至离心管中,离心1500rmp,10min,弃掉上清,重复加入预冷的戊二醛,放入4℃冰箱固定2h。后去掉上清液,加入0.1MPB缓冲液洗3次,每次10min。待后续包埋。
1.3.3 琼脂预包埋 用0.1MPB缓冲液配制琼脂,将其配成2%琼脂溶液,用酒精灯加热至琼脂完全溶解,待琼脂溶液温度降到43℃,仍然保持溶液状态。将胰岛细胞离心(1500rpm,5min),吸出离心管中的PB缓冲液,仅留少量缓冲液浸过胰岛细胞,待琼脂溶液温度降至43℃,向胰岛细胞离心管中快速加入适量液态的2%琼脂溶液,再加入适量PB,迅速离心(1500rpm,3~5min),胰岛细胞呈团状同琼脂块一同沉于离心管底,放入4℃冰箱中凝固。
1.3.4 锇酸后固定 用1%锇酸对其进行后固定,时间以不超过2h为宜。固定后样品组织呈黑色,将带有胰岛细胞的块状琼脂取出,并向其修整为1mm3的小块,再放入试管中继续后续步骤。双蒸水对细胞清洗3次,每次10min。
1.3.5 脱水、置换、渗透及包埋 分别对其进行50%、70%、90%、100%酒精脱水,每次10min;环氧丙烷置换2次,每次15min;Epon812树脂低纯度(1∶1)渗透40min室温,中纯度(1∶3)渗透40min室温,纯树脂渗透40min室温。包埋聚合35℃5h,60℃5h,70℃9h。
1.3.6 超薄切片 将聚合完成的树脂块在leica UC7徕卡切片机上切成70nm厚度的超薄切片。捞至100目的铜网,待红外线烘干后,醋酸双氧铀染色20min,柠檬酸铅染色2min,蒸馏水冲洗后于透射电镜(HITACHI HT7700)下观察。
2 结果
超薄电镜下(透射电镜HT7700)观察胰岛细胞,核为圆形,核膜清晰完整,核周间隙正常,胞质内可见结构清晰的线粒体、核糖体、粗面内质网等细胞器,另可见较多的内分泌颗粒,多数为胰岛B细胞的分泌颗粒,内部为胰岛素,少数为其他类型的内分泌颗粒,均获得结构清晰完整的胰岛细胞。
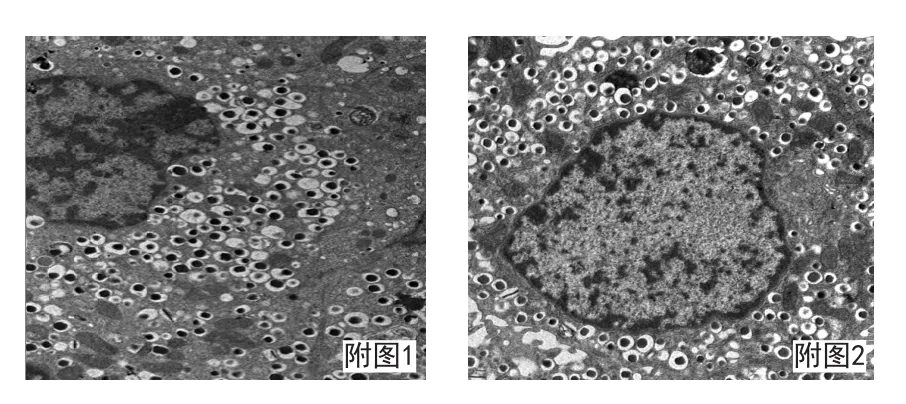
附图1、附图2 小鼠胰腺细胞。可见细胞膜界限清晰、细胞核完整、胞浆内见大量内分泌颗粒。透射电镜×2000倍、×2500倍。
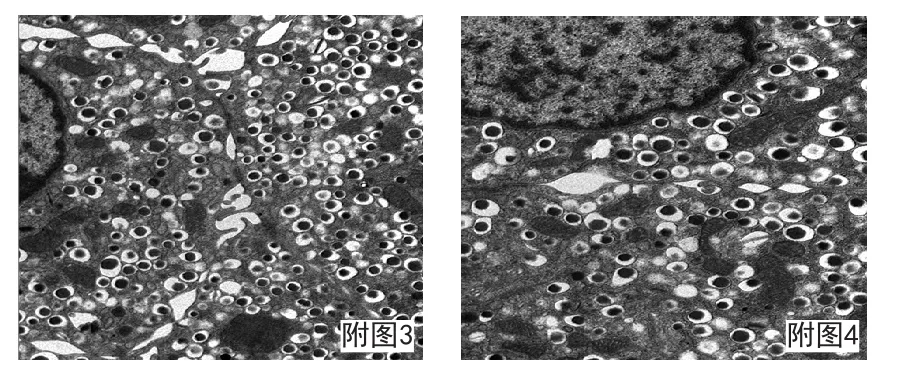
附图3、附图4 小鼠胰腺细胞。细胞膜结构清晰、可见细胞膜间连接,胞浆内见大量内分泌颗粒和线粒体。透射电镜×3000倍、×4000倍。
3 讨论
要想获得最终完美的电镜图像,每一个步骤都会是其影响因素,因此在制作过程中不能放过任何一个细节。本实验的取材采取了胶原酶Ⅺ灌注法,并用琼脂预包埋的方法,成功地得到了小鼠胰岛细胞的透射电镜样品,获得了良好的超微结构。张旭东等[2]利用直接取材法也成功得到了胰岛细胞的超薄切片,但本实验方法的优点在于:①制成树脂包埋块以后无需半薄定位,直接超薄切片,避免反复定位,更快速,省去时间成本。②直接取材的方法,经常定位不准确,取不到有效区域,则需要重新取样,反而费时费力。而本实验可以做到精准取材,高速有效,能够在有限的观察视野下,看到更多的胰岛细胞。而后利用琼脂预包埋法,把相对松散又细小的胰岛细胞集中在一起,更加提高了超薄切片上的有效区域,有利于实验人员更为全面地观察和判断胰岛细胞的超微结构。本实验的关键不是琼脂的浓度,而是琼脂低熔点的特性,在高温煮沸琼脂后将温度降至40℃时,琼脂仍然为液体状态,加入后与胰岛细胞混合,离心,待温度降到40℃以下时则琼脂凝固,此时胰岛细胞已经离心、团聚至琼脂最下方。此外,琼脂的低熔点也避免了细胞内超微结构受损。除了琼脂低熔点的特性以外,胶原酶Ⅺ的浓度和时间也是决定获取胰岛细胞多与少的关键因素:如若浓度过低或时间过短,会使胰岛尚未完全分离,而外分泌腺则会混入其中;若浓度过高或时间过长,则会破坏胰岛包膜,消化过度。
本实验方法中需要注意的细节有:①锇酸进行后固定以后,带有琼脂的胰岛细胞会显色,被氧化成黑色,需要修掉多余的琼脂块,最后留少量琼脂,以便后续的脱水和渗透。如果琼脂浓度过高也不利于脱水和渗透。②将琼脂加入到胰岛细胞时的温度:温度过高容易烫损细胞,温度过低容易使琼脂凝固,无法离心沉淀。
综上所述,本实验通过胶原酶Ⅺ灌注的方法取材,后经利用低熔点琼脂预包埋,成功制备出胰岛细胞的超薄切片,可有效获得数量较多的并且超微结构不受损伤的胰岛细胞结构。在利用胶原酶Ⅺ灌注取材的时候会相对比直接取材相对更费事,但是这种方法可以在制样后段有效地提高工作效率,并对胰岛调节血糖的机制提供了可靠而有效的方法。
