响应面法优化芡茎多糖脱蛋白工艺
2018-10-16吴啟南许一鸣戴仕林乔晶晶黄晓燕
王 倩,吴啟南,2,*,许一鸣,戴仕林,乔晶晶,薛 敏,黄晓燕
(1.南京中医药大学药学院,江苏南京 210023;2.江苏省中药资源产业化过程协同创新中心,江苏南京 210023)
芡(EuryaleferoxSalisb)为睡莲科单属种水生植物,有苏芡和刺芡两个品种[1]。芡茎是芡的叶柄和花梗,又称鸡头菜,嫩茎在夏秋季节常作为时令蔬菜食用[2]。据《本草纲目》记载,芡茎有“止烦渴,除虚热”之功效[3]。
芡茎中氨基酸和膳食纤维等为多糖的获得提供了丰富的原材料[4]。目前多糖的药理作用有免疫调节[5-6]、抗肿瘤[7-8]、降血糖[9]、抗氧化[10-11]、抗疲劳[12]等。多糖的药理活性与其结构密切相关,从植物中提取的多糖常与蛋白形成糖蛋白复合物,这往往会直接或间接影响其药理活性。故研究植物多糖一个重要环节就是去除多糖中的蛋白质。根据以往研究结果发现,物理法、化学法、生物法是目前多糖脱蛋白最常用的方法[13]。其中物理方法常见的有反复冻融法[14],生物法常见的有蛋白酶法,化学法研究较多的有Sevag法[15]、TCA法[16-17]等。TCA法脱蛋白时多糖损失一般较大,而Sevag法需要反复多次且会导致部分多糖水解,故现在多有将化学方法与酶法相结合[18]。因此,本实验以芡茎多糖为研究对象,主要对比研究芡茎粗多糖不同脱蛋白方法,以期从这些方法中找到一个最适合芡茎多糖脱蛋白的方法,并对优选出的方法进行工艺优化,为后续的药理药效以及食品、化妆品的研究提供科学依据。
1 材料与方法
1.1 材料与仪器
芡茎 采集于高邮界首,经南京中医药大学吴啟南教授鉴定为睡莲科芡属(EuryaleferoxSalisb.)芡的叶柄和花梗;牛血清蛋白 美国Sigma公司;木瓜蛋白酶 800 U·mg-1,上海源叶生物有限公司;葡萄糖 上海阿拉丁生物化学科技有限公司;考马斯亮蓝G250、蒽酮、正丁醇、三氯乙酸 分析纯,南京建成;浓硫酸、三氯甲烷 分析纯,溧阳市东方化学试剂有限公司。
KH-300SP型超声波清洗器 昆山禾创超声仪器有限公司;AUW220D百万分之一电子天平 日本岛津公司;UV-1100型紫外分光光度计 南京以马内利仪器设备有限公司;SAGA-10TY实验室级超纯水仪 南京易普易达科技发展有限公司;HH-S数显恒温水浴锅 江苏金坛市金城国胜实验仪器厂。
1.2 实验方法
1.2.1 芡茎多糖制备 原料预处理:将芡茎切3~5 cm小段,50 ℃烘干,粉碎过20目筛。称取500 g芡茎粉末,加10倍量无水乙醇,回流提取三次,每次2 h,抽滤,弃滤液,滤渣挥干溶剂,以除去芡茎中的有色物质、小分子多糖、低聚糖及小分子化合物,得到预处理的芡茎粉末备用[19]。
多糖提取:称取预处理的芡茎粉末按液料比40∶1加入超纯水,超声提取(40 kHz,80 ℃)32 min,抽滤,滤液加无水乙醇使得含醇量为80%,4 ℃过夜,离心(3000 r·min-1,10 min),弃滤液,无水乙醇洗3次,冷冻干燥,得芡茎粗多糖[19]。
1.2.2 脱蛋白方法
1.2.2.1 Sevag法 参考张帅、王世佳、吴春[20-22]等方法,取10 mg·mL-1芡茎多糖溶液,加入1/5体积Sevag试剂[氯仿∶正丁醇=5∶1 (v/v)],摇床剧烈振摇20 min后,3000 r·min-1离心10 min,去除分界层以下部分,重复5次,取上清液测蛋白质脱除率和多糖损失率。
1.2.2.2 三氯乙酸(trichloroacetic acid,TCA)法 参考林翔凯[23]的方法,取6个锥形瓶,分别加入10 mL 5 mg·mL-1芡茎多糖溶液,再加入10 mL体积分数分别为0、2%、4%、6%、8%、10%三氯乙酸溶液,振摇20 min,4 ℃过夜,离心(3000 r·min-1,10 min)除去沉淀,取上清液测蛋白质脱除率和多糖损失率。
1.2.2.3 木瓜蛋白酶法 参考杨斌[24]的方法,取10 mg·mL-1芡茎粗多糖溶液25 mL,加入0.1 mL木瓜蛋白酶(1 g·L-1)温度55 ℃,时间2.5 h进行反应,反应结束后沸水浴10 min灭活,冷却至室温,3000 r·min-1离心10 min,取上清液测蛋白质脱除率和多糖损失率。
1.2.2.4 木瓜蛋白酶-TCA法 参考何沂飞、徐丹鸿、刘小攀[25-27]等方法,取10 mg·mL-1芡茎多糖溶液25 mL,加入0.1 mL木瓜蛋白酶液(1 g·L-1),温度55 ℃,酶解2.5 h进行反应,反应结束后沸水浴10 min灭活,冷却,3000 r·min-1离心10 min,除去沉淀,取上清液。上清液再加入等体积的2.0% TCA溶液,振摇20 min,4 ℃过夜,离心(3000 r·min-1,10 min)除去沉淀,取上清液测蛋白质脱除率和多糖损失率。
1.2.3 木瓜蛋白酶法脱蛋白的单因素实验
1.2.3.1 加酶量对蛋白质脱除率和多糖损失率的影响 取芡茎多糖溶液25 mL,分别加入浓度为160、320、480、640、800 U·mL-1的木瓜蛋白酶液1 mL,调节酶解时间为1 h,酶解温度为60 ℃,pH7,反应结束后沸水浴灭活10 min,冷却至室温,3000 r·min-1离心10 min,除去沉淀,取上清液测蛋白质脱除率和多糖损失率。
1.2.3.2 酶解温度对蛋白质脱除率和多糖损失率的影响 取芡茎多糖溶液25 mL,加入浓度为480 U·mL-1木瓜蛋白酶液1 mL,调节酶解时间为1 h,pH7,酶解温度分别为30、40、50、60、70 ℃,反应结束后沸水浴灭活10 min,冷却至室温,3000 r·min-1离心10 min,除去沉淀,取上清液测蛋白质脱除率和多糖损失率。
1.2.3.3 酶解时间对蛋白质脱除率和多糖损失率的影响 取芡茎多糖溶液25 mL,加入浓度为480 U·mL-1木瓜蛋白酶液1 mL,调节酶解温度为40 ℃,pH7,酶解时间分别为0.5、1.0、1.5、2.0、2.5 h,反应结束后沸水浴灭活10 min,冷却至室温,3000 r·min-1离心10 min,除去沉淀,取上清液测蛋白质脱除率和多糖损失率。
1.2.4 响应面法优化木瓜蛋白酶法脱蛋白 在单因素实验结果的基础上,按照中心组合试验设计原理[32],选取加酶量(A)、酶解温度(B)、酶解时间(C)为主要因素,以蛋白脱除率和多糖损失率为指标,进行三因素三水平的实验设计,见表1。

表1 响应曲面设计试验因素水平与编码Table 1 Independent variables and levels of the response surface design
1.2.5 蛋白质及多糖含量测定
1.2.5.1 考马斯亮蓝法测定蛋白质含量 考马斯亮蓝G-250溶液:精密称取考马斯亮蓝G-250 100 mg,加入95%乙醇50 mL,再加入85%磷酸100 mL,最终用超纯水定容至1000 mL,置于棕色瓶中备用。
牛血清白蛋白标准曲线:精密称取结晶牛血清白蛋白10.000 mg,加水溶解并定容至100 mL,即得100 μg·mL-1的蛋白质标准储备液。取蛋白质标准储备液0.0、0.2、0.4、0.6、0.8、1.0 mL用去离子水配成0、20、40、60、80、100 μg·mL-1的蛋白质标准液,分别取上述溶液各1 mL于10 mL离心管,加入5 mL考马斯亮蓝G-250溶液,密塞,摇匀,静置5 min于595 nm测定吸光度[29-30]。
1.2.5.2 多糖含量测定 蒽酮硫酸溶液:精密称取蒽酮0.050 g,加入80%浓硫酸50 mL,置于50 mL烧杯中,得1 mg·mL-1的蒽酮硫酸溶液。
葡萄糖标准曲线:精密称取105 ℃干燥至恒重的葡萄糖0.025 g,于250 mL容量瓶中,加蒸馏水溶解并稀释至刻度得100 μg·mL-1葡萄糖标准储备液。取葡萄糖标准储备液0.0、0.2、0.4、0.6、0.8、1.0、1.2、1.4 mL用去离子水配成0、20、40、60、80、100、120、140 μg·mL-1的葡萄糖标准液,分别取上述溶液各2 mL于10 mL离心管,加入6 mL蒽酮硫酸溶液,密塞,摇匀,冰浴,待全部加完,沸水浴15 min,冰水浴15 min,取出摇匀于620 nm测定吸光度[31-32]。
按照下式计算蛋白脱除率和多糖损失率

式(1)

式(2)
式中:Ri为粗多糖中蛋白含量(μg);Rj为脱蛋白处理后样品中蛋白含量(μg);Ti为粗多糖中多糖含量(μg);Tj为脱蛋白处理后样品中多糖含量(μg)。
1.3 数据统计

2 结果与分析
2.1 蛋白质及多糖含量测定的标准曲线
按照“1.2.5.1”方法得到牛血清白蛋白标准曲线(图1)以牛血清白蛋白质量浓度为横坐标(X),吸光度为纵坐标(Y)之间的回归方程为Y=0.0054X-0.0045(R2=0.9992),线性范围为0~100 μg·mL-1。按照“1.2.5.2”方法得到葡萄糖标准曲线(图2)以葡萄糖质量浓度为横坐标(X),吸光度为纵坐标(Y)之间的回归方程为 Y=0.0045X+0.0002(R2=0.9996),线性范围为0~140 μg·mL-1。
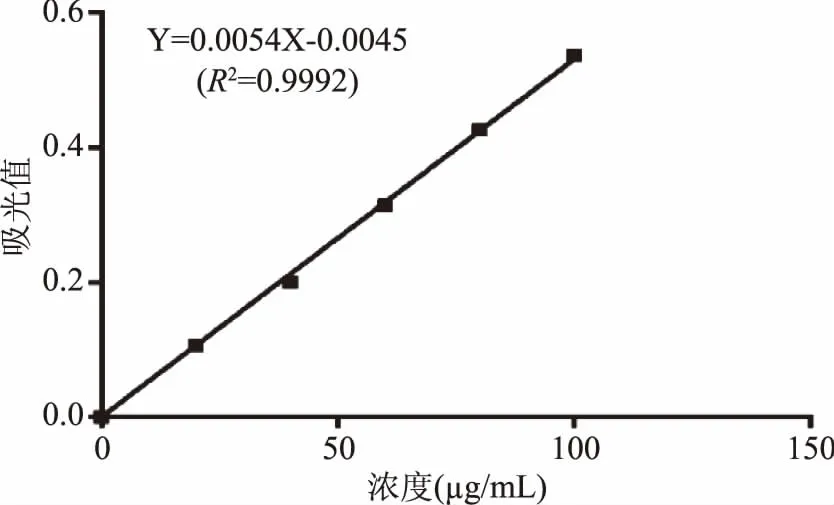
图1 考马斯亮蓝法测定牛血清白蛋白标准曲线Fig.1 Standard curve of bovine serum albumin determination by coomassie brilliant blue method

图2 蒽酮硫酸法测定葡萄糖标准曲线Fig.2 Standard curve of glucose determination by anthrone-sulfuric acid method
2.2 四种脱蛋白方法比较
2.2.1 Sevag法脱蛋白 Sevag法脱蛋白是利用有机溶剂使溶液中蛋白质变性沉淀而清除蛋白质的原理。由图3可知,随着脱蛋白次数的增加蛋白脱除率变化不显著,而多糖损失率(前3次)却随着脱蛋白次数的增加而显著(p<0.05)增加,第4、5次随着脱蛋白次数的增加变化不显著,综合考虑选取第5次脱蛋白结果与其他三种方法进行比较。

图3 Sevag法脱蛋白效果Fig.3 The effect of removal with the sevag method注:图中字母不同为差异显著,p<0.05,图4~图7同。
2.2.2 TCA法脱蛋白 TCA作为一种有机酸能使蛋白质带正电荷并与负离子结合成不溶性盐。由图4可知,随着TCA体积分数的增加,蛋白脱除率显著增加(p<0.05),说明脱蛋白效率在不断提高,但同时多糖损失率也高达50.0%以上。故TCA法除蛋白有利有弊,虽然除蛋白效率高,但对多糖的影响较为严重,综合考虑,利用体积分数8.0%的TCA法脱蛋白的效果较Sevag法好。
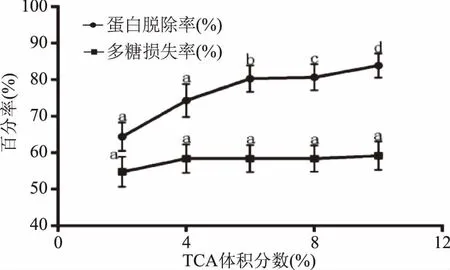
图4 TCA法脱蛋白效果Fig.4 The effect of removal with the TCA
将四种脱蛋白方法进行综合比较,由表2可知,从蛋白脱除率来看,木瓜蛋白酶-TCA法极显著(p<0.01)优于单一的木瓜蛋白酶法和Sevag法,显著(p<0.05)劣于单一TCA法;再分析其多糖损失率,木瓜蛋白酶-TCA法显著(p<0.05)优于其他三种方法,综合考虑蛋白脱除率和多糖损失率木瓜蛋白酶-TCA法不仅脱蛋白效果好且多糖损失少,因此,确定利用木瓜蛋白酶-TCA法对芡茎多糖进行脱蛋白处理,该法既可较大程度地脱除杂质蛋白又能保证最小程度损失多糖,所以针对木瓜蛋白酶-TCA法进一步设计响应面优化木瓜蛋白酶法脱蛋白工艺,并将优化出的木瓜蛋白酶法脱蛋白最优工艺与TCA法最佳工艺结合处理一次,以确定木瓜蛋白酶-TCA法最佳的脱蛋白工艺条件。
表2 四种脱蛋白方法效果比较Table 2 The comparison of deproteinization effect of four
2.3 木瓜蛋白酶法脱蛋白的单因素实验
2.3.1 加酶量对蛋白质脱除率和多糖损失率的影响 由图5可知,其蛋白脱除率呈现出先增加后下降的趋势,加酶量为480 U·mL-1时,蛋白脱除率达到最大值此时多糖损失也最少,故综合考虑二者,选取加酶量为480 U·mL-1为宜。

图5 加酶量对蛋白脱除率和多糖损失率的影响Fig.5 Effect of enzyme concentration on the rate of protein-removed and polysaccharide losing rate
2.3.2 酶解温度对蛋白质脱除率和多糖损失率的影响 由图6可知,蛋白脱除率先增加后下降且在40 ℃时达到一个峰值,这是因为温度过高会破坏酶的活性;其多糖损失率也在40 ℃损失最少,表明40 ℃可能是其适宜的酶解温度。

图6 酶解温度对蛋白脱除率和多糖损失率的影响Fig.6 Effect of hydrolysis temperature on the rate of protein-removed and polysaccharide losing rate
2.3.3 酶解时间对蛋白质脱除率和多糖损失率的影响 由图7可知,随着酶解时间的延长,蛋白脱除率先增加后减少且在1.5 h时取得最大值,可能的原因是随着酶解时间的延长酶与底物特异性结合趋于饱和以及长时间酶解破坏了酶该有的活性。多糖损失率则随着时间的延长变化不显著,故综合二者来看,选取酶解时间1.5 h作为适宜的酶解时间。

图7 酶解时间对蛋白脱除率和多糖损失率的影响Fig.7 Effect of hydrolysis time on the rate of protein-removed and polysaccharide losing rate
2.4 响应面优化实验
采用Box-behnken实验方案,对木瓜蛋白酶法脱蛋白的条件进行优化,响应面分析结果见表3。以蛋白脱除率和多糖损失率为响应值,各因素经回归拟合后得到的回归方程分别为:
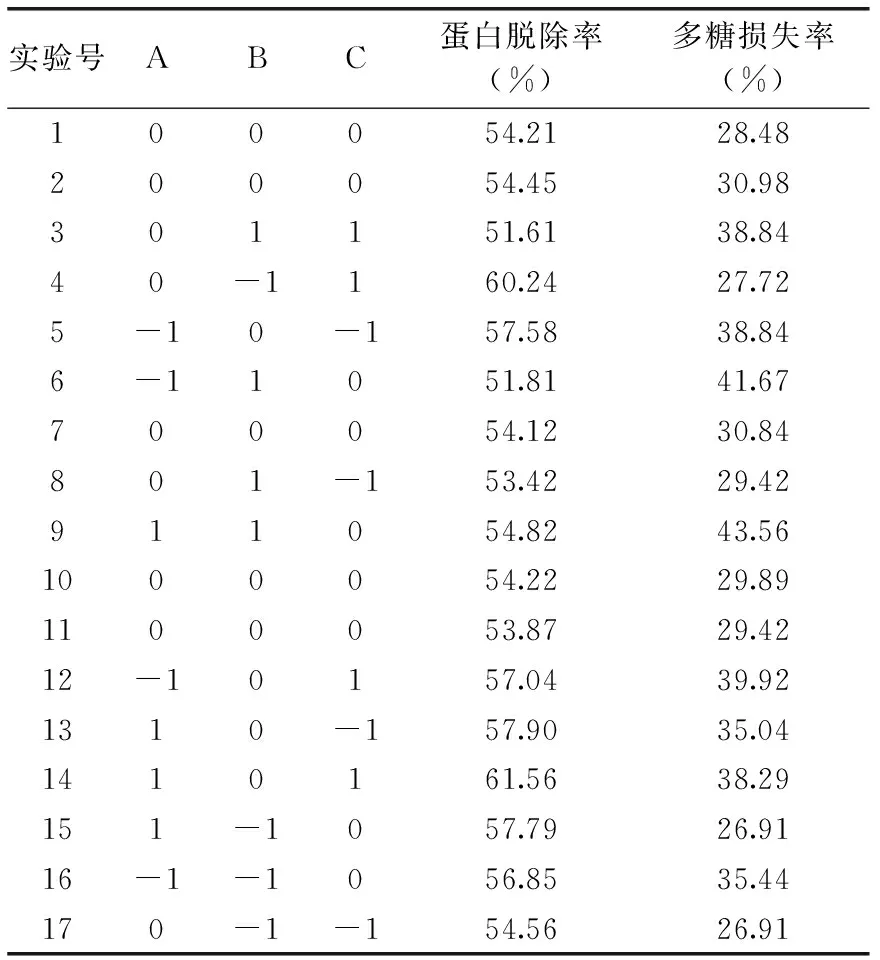
表3 Box-Behnken设计方案及结果Table 3 The Box-Behnken experimental design and results for response surface analysis
蛋白脱除率Y1(%)=54.17+1.10A-2.22B+0.87C+0.52AB+1.05AC-1.87BC+2.35A2-1.21B2+1.99C2
多糖损失率Y2(%)=29.92-1.51A+4.56B+1.82C+2.60AB+0.54AC+2.15BC+7.14A2-0.16B2+0.96C2
表4方差分析表明,该模型回归极显著(p<0.01),失拟项(p=0.0983>0.05)不显著,表明二次多项式回归模型可靠;R2=0.9940,表明响应值蛋白脱除率的实际值与预测值之间具有较好的拟合度,因此该模型可用于预测响应值的实际情况。F值可以反映出各因素对实验指标影响的重要性,各因素的贡献率为:B>A>C,即酶解温度>加酶量>酶解时间。

表4 蛋白脱除率回归模型方差分析结果Table 4 Protein removal rate of the regression model of variance analysis results
对模型进行回归方程系数显著性检验,得到模型一次项A、B、C,二次项A2、B2、C2及交互作用项AB、AC、BC差异显著(p<0.05),表明加酶量、酶解温度、酶解时间以及加酶量与酶解温度、加酶量与酶解时间、酶解温度与酶解时间的交互作用对芡茎多糖蛋白脱除率有显著影响,由图8可以直观地看出各因素交互作用对芡茎多糖蛋白损失率的影响,若曲线越陡峭,表明响应值对于操作条件的改变越敏感,该因素的交互作用对蛋白损失的影响越大;反之曲面坡度越平缓,操作条件的改变对响应值的影响也就越小。从图8可知酶解温度与酶解时间交互作用的影响最大,加酶量与酶解时间以及加酶量与酶解温度交互作用的影响次之。表4回归分析结果也与此相吻合。

图8 各因素交互作用对蛋白脱除率影响的响应面图Fig.8 Three-dimensional response surface diagram showing interactive effects of different factors on the rate of protein-removed rate
表5方差分析表明,该模型回归极显著(p<0.01),失拟项(p=0.0838>0.05)不显著,表明二次多项式回归模型正确;R2=0.9610,表明响应值多糖损失率的实际值与预测值之间具有较好的拟合度,因此该模型可用于预测响应值的实际情况。F值可以反映出各因素对实验指标影响的重要性,由表5可知,各因素的贡献率为:B>C>A,即酶解温度>酶解时间>加酶量。
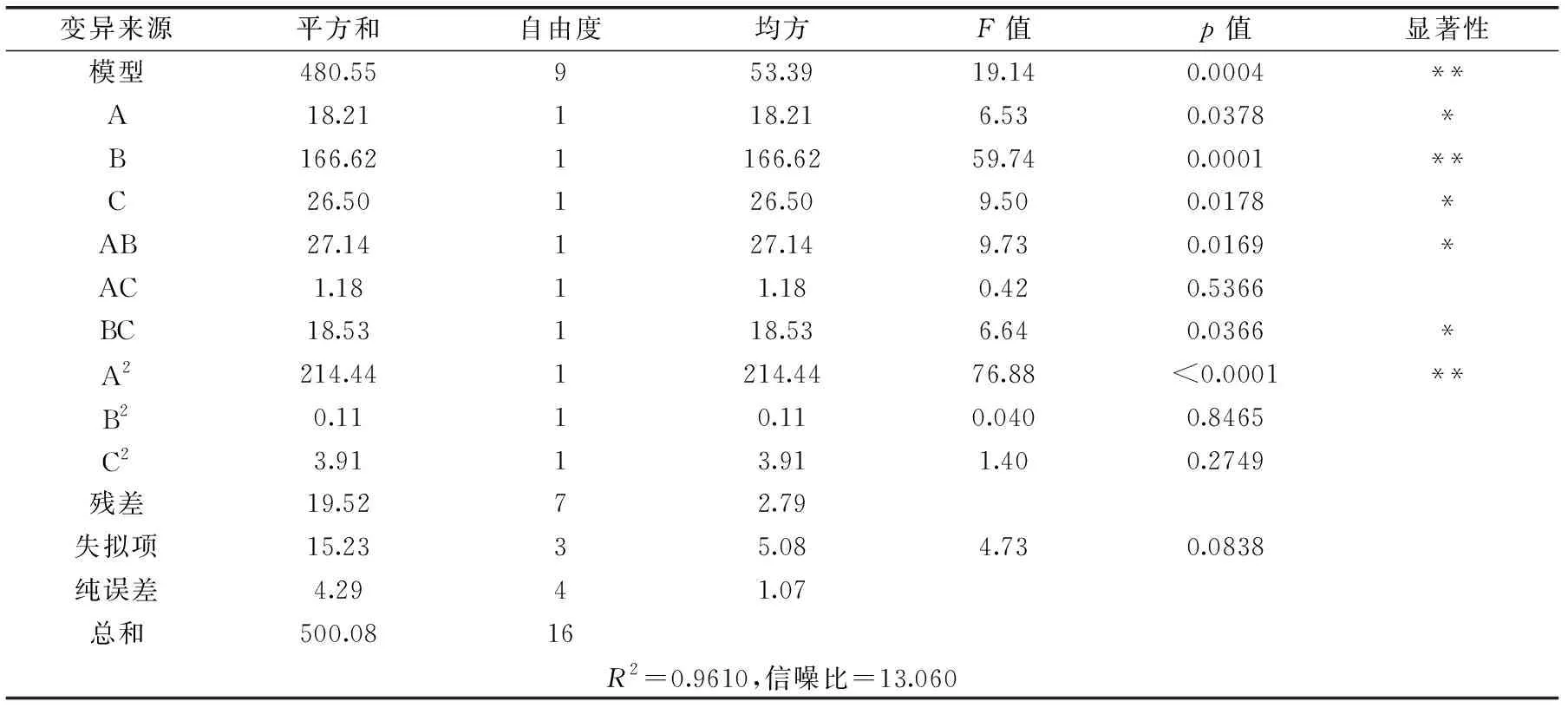
表5 多糖损失率回归模型方差分析结果Table 5 Polysaccharide loss rate of the regression model of variance analysis results
对模型进行回归方程系数显著性检验,得到模型一次项A、B、C,二次项A2及交互作用项AB、BC差异显著(p<0.05),表明加酶量、酶解温度、酶解时间以及加酶量与酶解温度、酶解温度与酶解时间的交互作用对多糖损失率有显著影响,且各具体实验因素对响应值的影响不是简单的线性关系。由图9可以直观地看出各因素交互作用对芡茎多糖损失率的影响,若曲线越陡峭,表明响应值对于操作条件的改变越敏感,该因素的交互作用对芡茎多糖损失的影响越大;反之曲面坡度越平缓,操作条件的改变对响应值的影响也就越小。从图9可知加酶量和酶解温度的交互作用影响较大,加酶量和酶解时间以及酶解温度和酶解时间的交互作用影响次之。表5回归分析结果也与此相吻合。

图9 各因素交互作用对多糖损失率影响的响应面图Fig.9 Three-dimensional response surface diagram showing interactive effects of different factors on polysaccharide losing rate
2.5 最佳条件预测及验证实验
通过Design-Expert 8.0.5b软件进行数据分析,得到芡茎多糖木瓜蛋白酶法脱蛋白的最佳工艺条件为加酶量为578.26 U·mL-1、酶解温度30.34 ℃、酶解时间为1.99 h,此条件下由回归方程计算出的芡茎多糖蛋白脱除率和多糖损失率理论值分别为61.7%、26.6%。考虑实际可操作性,将最佳工艺参数修正为加酶量为580 U·mL-1、酶解温度30 ℃、酶解时间为2.0 h,此条件下进行蛋白脱除率和多糖损失率的验证实验,经3次平行实验,实际蛋白脱除率和多糖损失率平均值分别为62.1%和25.9%。实验结果与模型符合良好,说明该模型能较好预测芡茎多糖脱蛋白工艺。
2.6 响应面优化最优条件结合TCA法
将利用响应面优化且修正后的工艺参数即加酶量为580 U·mL-1、酶解温度30 ℃、酶解时间为2.0 h结合TCA法优化出最佳体积分数8.0%处理一次,经三次平行实验,蛋白脱除率和多糖损失率平均值分别为85.1%、16.3%。
3 结论
本研究通过不同脱蛋白方法的比较,发现木瓜蛋白酶结合TCA法的蛋白脱除效果优于其他3种方法,这可能与两者脱蛋白原理和性质有关。TCA法是经典的蛋白脱除法,其原理是化学试剂使蛋白质变性沉淀而被去除,与常见的Sevag法相比,TCA法蛋白脱除效果更优,另外从生产和实验者安全角度考虑,TCA法无需用到氯仿这种有毒试剂,更加安全。酶法条件温和、有机试剂污染少,操作方便,在促进蛋白质水解的同时,多糖损失较少,故采用木瓜蛋白酶法和TCA法结合应用脱蛋白是一种较优的芡茎多糖脱蛋白方法。
