PMA诱导人单核细胞白血病细胞株THP-1 细胞表面标志物CD14和CD11b的表达
2018-10-10李晓琴陈利荣
李晓琴,陈利荣
(山西医科大学汾阳学院医学检验系,汾阳 032200)
巨噬细胞(macrophage)是一类由血液中单核细胞分化而来的固有免疫细胞[1],是机体固有免疫系统的重要成分之一,具有吞噬、抗原提呈和分泌多种细胞因子的功能,在炎症、防御、修复、代谢等生理过程中发挥重要作用,同时也是机体维持自身稳定的关键因素[2]。在激活和平衡宿主免疫系统的促炎和抑炎途径中,巨噬细胞发挥着核心作用[3]。但是由于细胞数量少,分离过程较复杂,因此多用豆蔻佛波醇乙酯(phorbol myristate acetate, PMA)诱导THP-1单核细胞分化而来的THP-1-巨噬细胞作为研究巨噬细胞功能的体外细胞模型[1],因在某些方面可替代人血液及组织中的单核/巨噬细胞,成为目前最常用的巨噬细胞模型之一[4]。虽然是目前比较通用的巨噬细胞模型,但既往文献关于PMA诱导THP-1模型中,不同PMA诱导条件对细胞表面标志物CD11b、CD14表达等尚无系统的比较研究。基于此,本研究拟对不同浓度PMA作用THP-1细胞后,其CD11b、CD14的表达进行分析,初步考察了PMA诱导THP-1细胞分化的条件,为后续相关实验提供实验依据。
1 材料与方法
1.1 细胞株及主要试剂
人来源的单核细胞白血病细胞株THP-1(中科院上海细胞库);佛波醇PMA(美国Sigma公司);RPMI-1640培养基、胎牛血清(美国Gibco公司);CD14-FITC流式抗体、CD11b-PE流式抗体(美国eBioscience公司)。
1.2 THP-1细胞培养
THP-1细胞生长于含10%FBSRPMI-1640培养基的培养瓶中,37 ℃、5%CO2饱和湿度培养,2-3 d传代1次。THP-1细胞以4×105/ml的密度接种于12孔板,培养12 h。实验分为对照组(PMA浓度为0 ng/ml)和实验组(加入PMA终浓度分别为10 ng/ml、50 ng/ml),处理24 h和48 h。
1.3 CCK-8法检测细胞活力
THP-1细胞悬液接种于96孔板,细胞数5 000/孔,100 μl/孔,置于37 ℃培养箱过夜培养。根据实验要求对接种的细胞进行处理,分组如下:空白对照(只有培养基)、对照组(细胞+培养基)。PMA组(细胞+培养基+PMA):终浓度分别为25,50,100,200,400 ng/ml。每组3个复孔,24 h后吸除原培养基,更换含有10%FBS及10%CCK-8溶液的新鲜完全培养基,37 ℃孵育1-4 h,测定450 nm处的OD值。最后的实验结果得数为各个OD值与空白对照OD值的差。
1.4 流式细胞仪检测CD11b、CD14
24 h、48 h后弃上清,PBS 洗一次,将贴壁细胞处理并收集于流式管内。设置空白对照组、单标组,分别加入FITC-CD14、PE-CD11b。其他管均加入两种抗体,4 ℃孵育30 min。PBS洗3次,用100 μl PBS重悬,上流式细胞仪检测。
1.5 统计学分析
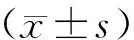
2 结果
2.1 不同浓度的PMA对THP-1细胞活力的影响
PMA处理后,在光镜下可见THP-1细胞紧密贴壁,并且丧失增殖能力,呈现梭形,并有伪足形成。用CCK-8法检测了PMA对THP-1细胞活力的影响。我们在0-400 ng/ml的浓度范围内检测了THP-1的活力。结果表明,在PMA处理24 h,与对照组(0 ng/ml)相比,浓度为0-100 ng/ml时,PMA对细胞活力没有影响,而200 ng/ml、400 ng/ml PMA对细胞有一定毒性(P<0.05,见图1)。根据结果和结合文献,筛选后续实验中PMA的浓度分别为10 ng/ml和50 ng/ml。
2.2 PMA处理后THP-1细胞表面标志物CD11b、CD14的表达
流式结果显示:10 ng/ml PMA处理THP-1细胞48 h、24 h,细胞表面标志物CD11b、CD14表达均升高,与对照组相比,差异有统计学意义(P<0.05),CD11b增加单核细胞的黏附性;同样50 ng/ml PMA处理THP-1细胞48 h、24 h,CD11b、CD14表达也增加(P<0.05,见图2)。结果提示:PMA具有诱导THP-1单核细胞向巨噬细胞分化的潜能,结果说明细胞表面标志表达上有向巨噬细胞分化的特征。
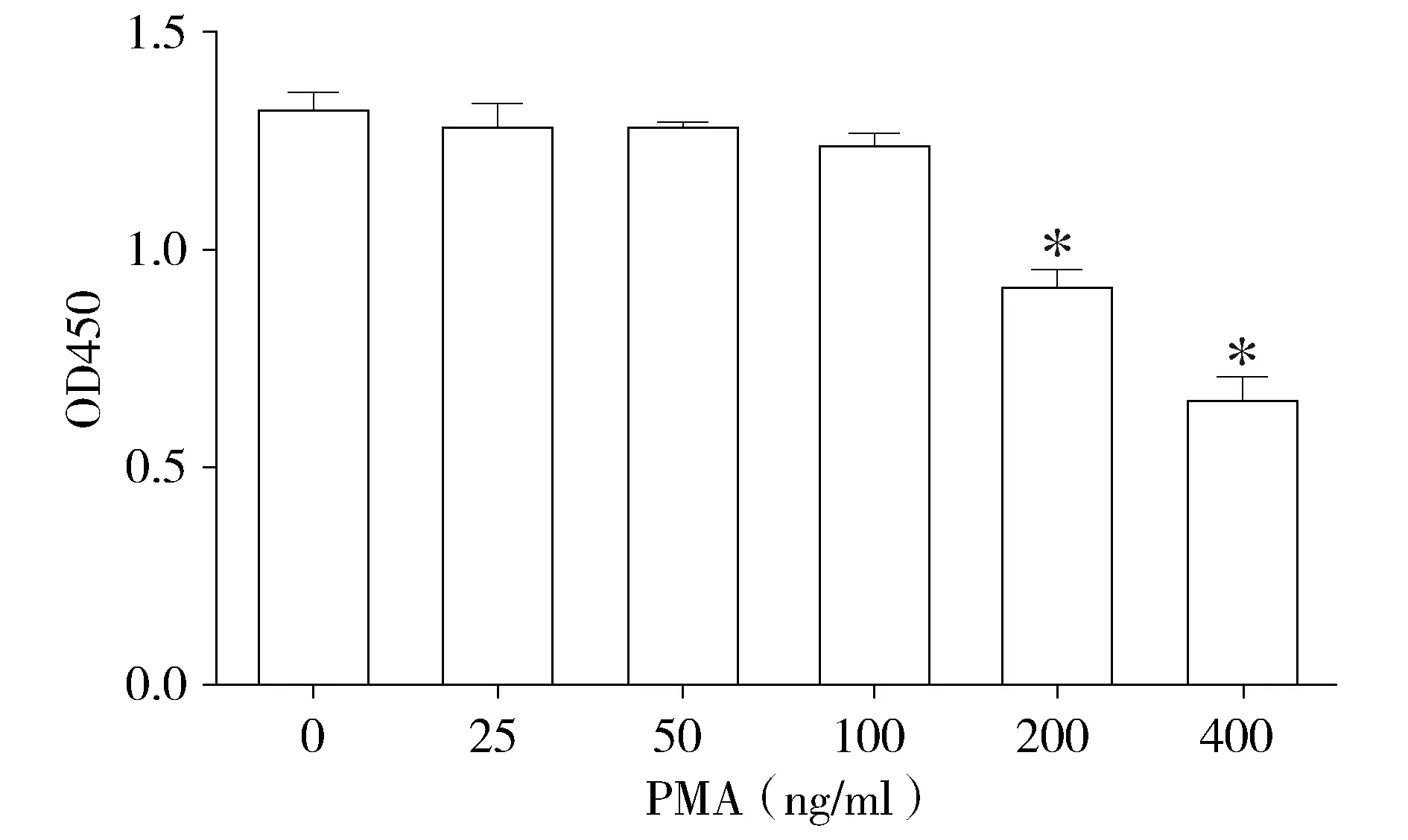
与对照组(0 ng/ml)相比,*P<0.05图1 CCK-8检测不同浓度的PMA对THP-1细胞活力的影响Figure 1 Effect of different concentrations of PMA on THP-1 cell viability by CCK-8 assay
3 讨论
血液中的单核细胞在黏附分子等作用下,进入血管内皮下被激活为巨噬细胞[5]。巨噬细胞是一种具有可塑性和多功能性的固有免疫细胞[1],在机体的促炎和抑炎途径中,都发挥重要作用。而合适的巨噬细胞模型有助于筛选抗炎活性化合物。THP-1细胞经PMA诱导分化可建立巨噬细胞模型已广泛用于单核/巨噬细胞功能研究及抗炎药物筛选[6]。THP-1细胞来源于人急性单核细胞性白血病细胞系,属于血液系统肿瘤细胞范畴。PMA能够诱导THP-1贴壁,在光镜下可见其紧密贴壁,呈现梭形或者多形性,并有伪足形成,分化为成熟巨噬细胞[7]。鉴于其种属来源为人,在某些方面可替代人血液及组织中的人单核/巨噬细胞。虽然这是一个非常经典又常见的细胞模型,但以往文献无论是在PMA剂量、处理时间还是诱导方法等均存在很大的差异及不确定性,导致在结果的解释上具有一定争议[8]。而且关于不同剂量PMA作用THP-1细胞后,细胞表面标志物CD11b、CD14的表达情况,这一方面尚未有全面报道[9],因此,深入探讨PMA诱导THP-1分化为巨噬细胞过程中的细胞表面标志表达为巨噬细胞模型的相关研究提供依据。
本实验中以THP-1细胞为研究对象,研究了PMA对其诱导分化的条件。THP-1细胞具有更类似于人原代单核细胞的表型及功能特征,又具有比人原代单核细胞如外周血单个核细胞更广泛且稳定的来源,故是迄今研究人单核/巨噬细胞功能应用最普遍的体外模型细胞。同时在迄今研究的多种诱导分化剂中,PMA为最常用的THP-1细胞诱导分化剂。文中首先通过CCK-8法检测不同浓度PMA(25,50,100,200,400 ng/ml)对THP-1细胞细胞活力的影响,得出当PMA浓度为200 ng/ml和400 ng/ml时,细胞活力显著下降,而0-100 ng/ml的PMA对细胞活力没有显著影响,这也与大部分文献使用的PMA浓度范围相符。如邹明月等[6]考察的PMA浓度为50 ng/ml和100 ng/ml。Neu等[10]使用的PMA浓度为10 ng/ml。Schwende等[11]指出低剂量PMA(10 ng/ml)即可诱导THP-1细胞完全分化。基于此本实验最终采用的后续实验PMA浓度为10 ng/ml和50 ng/ml。

图2 细胞表面标志CD11b、CD14表达Figure 2 Expression of cell surface markers CD11b and CD14
其次分别用10 ng/ml和50 ng/ml PMA处理THP-1细胞,发现正常培养条件下即对照组THP-1细胞CD14、CD11b表达量不高,而有报道称,PMA、TPA等可诱导未成熟的髓系细胞,向巨噬细胞方向分化,并使单核分化标志物CD11b和CD14的表达上调。CD11b是细胞黏附分子整合蛋白家族成员之一MAC(CD11b/CD18)的α链,正常情况下,它主要在成熟单核细胞、巨噬细胞、自然杀伤细胞上表达,其主要功能是促进炎症的发生和发展,促进吞噬细胞的吞噬功能等,在机体的抗感染免疫中发挥重要作用,故被广泛地用作单核/巨噬分化的标志物[12]。另CD14为LPS受体,主要功能是结合LPS并引起细胞活化,主要存在于单核细胞、巨噬细胞等细胞表面,并且在PMA、TPA等诱导剂作用下表达增加,使THP-1细胞发生分化[13-16]。本文也观察到PMA作用后,CD11b和CD14表达均增加,结果提示THP-1细胞向巨噬细胞分化。并且在比较低的浓度(10 ng/ml)剂量诱导下即可被诱导分化。
综上所述,本研究结果表明,10 ng/ml的PMA可诱导THP-1向巨噬细胞分化。在实际工作中可根据实验结果选择适宜条件建立巨噬细胞模型。
